研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
血小板膜融合细胞外囊泡可靶向增强心梗小鼠血管新生
636 人阅读发布时间:2021-05-24 10:16
【关键词】血管新生、细胞外囊泡EVs、膜融合、血小板模拟物、靶向递送

【摘要】缺血性心脏病的一个主流治疗手段是提高血管新生,EVs可用于刺激血管新生,但是EVs的低靶向性限制了临床应用。本文作者将EVs融合血小板膜后回输至心肌缺血再灌注小鼠模型(MI/R)中验证靶向性和疗效。结果显示血小板膜融合后的EVs可有效增加靶向性,同时提高血管新生能力。

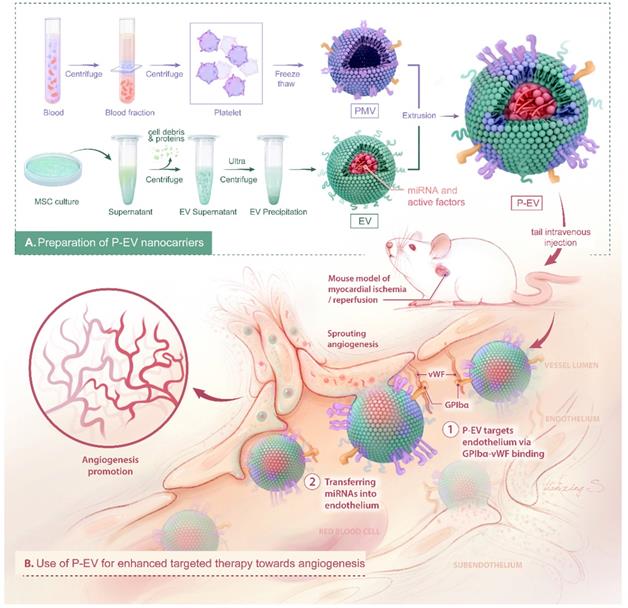
【前言】缺血性心脏病包括局部心肌血流不足、内皮功能紊乱、随年龄增加血管新生能力下降,因而成为全球患者主要死因。目前主要干预手段有药物和血管重建,但是仍然有一部分患者治疗后效果不佳。治疗性的血管新生是一个有前景的方法,通过递送蛋白、基因、干细胞、细胞外囊泡(EVs)等刺激血管新生。EVs因其稳定性好、较少引起免疫排斥反应,有较好的应用前景,但应用受限于较差的靶向性、脱靶效应。血小板膜应用于生物材料,可模拟血小板的归巢过程,因此本文作者将血小板膜融合至EVs中,增加EVs的靶向归巢能力,提高治疗效果。
【结果】
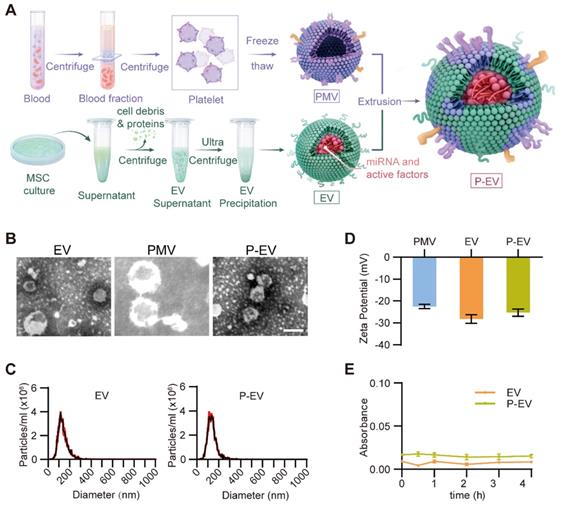
骨髓中分离MSCs,流式鉴定后提取EVs,TEM和NTA鉴定EVs大小和形态。膜融合后检测zeta电位,590nm吸光度判断P-EVs的血清稳定性。结果显示:膜融合后对EVs的基本特征改变不明显。
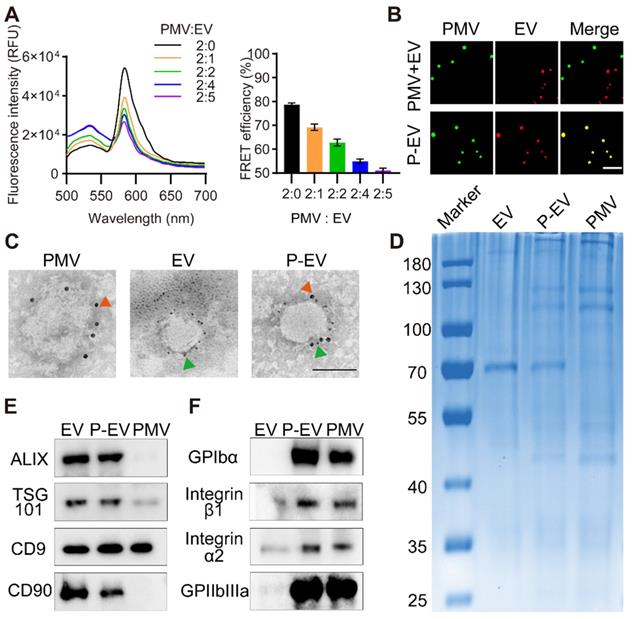
 对PMVs膜染色后检测荧光,验证血小板膜可以融合至EVs,用FRET方法和不同染料标记膜后结构照明显微镜观察融合的效率。免疫电镜和WB检测外泌体marker和P-EVs的总蛋白。结果显示:膜融合较好,血小板粘附相关蛋白也能在融合后的P-EVs中检测到。
对PMVs膜染色后检测荧光,验证血小板膜可以融合至EVs,用FRET方法和不同染料标记膜后结构照明显微镜观察融合的效率。免疫电镜和WB检测外泌体marker和P-EVs的总蛋白。结果显示:膜融合较好,血小板粘附相关蛋白也能在融合后的P-EVs中检测到。
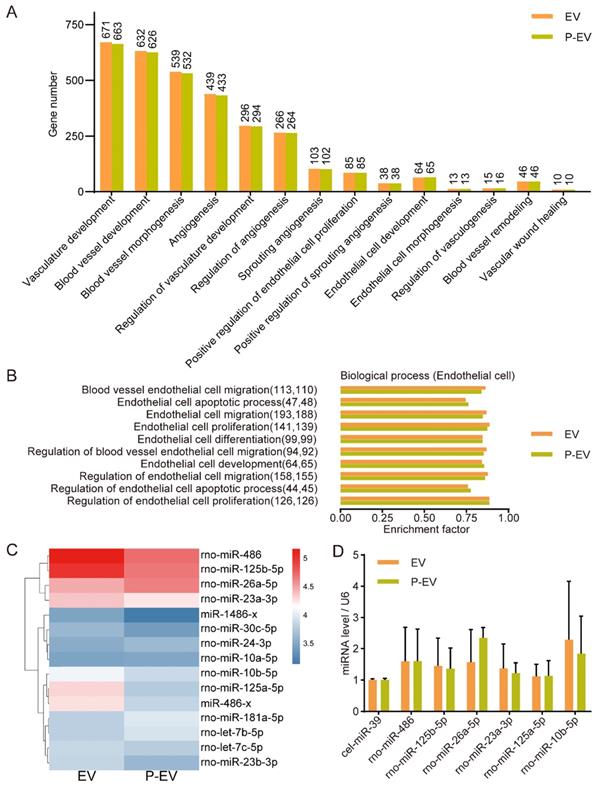
 EVs通常是通过转移miRNAs发挥作用的,因此检测膜融合过程是否会影响EVs中miRNAs含量。对P-EVs和EVs进行miRNA测序,GO富集分析,qRT-PCR验证测序结果。结果显示:工程化的EVs可损害EVs中的一部分内容物,但是其高靶向性可弥补这一缺点。
EVs通常是通过转移miRNAs发挥作用的,因此检测膜融合过程是否会影响EVs中miRNAs含量。对P-EVs和EVs进行miRNA测序,GO富集分析,qRT-PCR验证测序结果。结果显示:工程化的EVs可损害EVs中的一部分内容物,但是其高靶向性可弥补这一缺点。
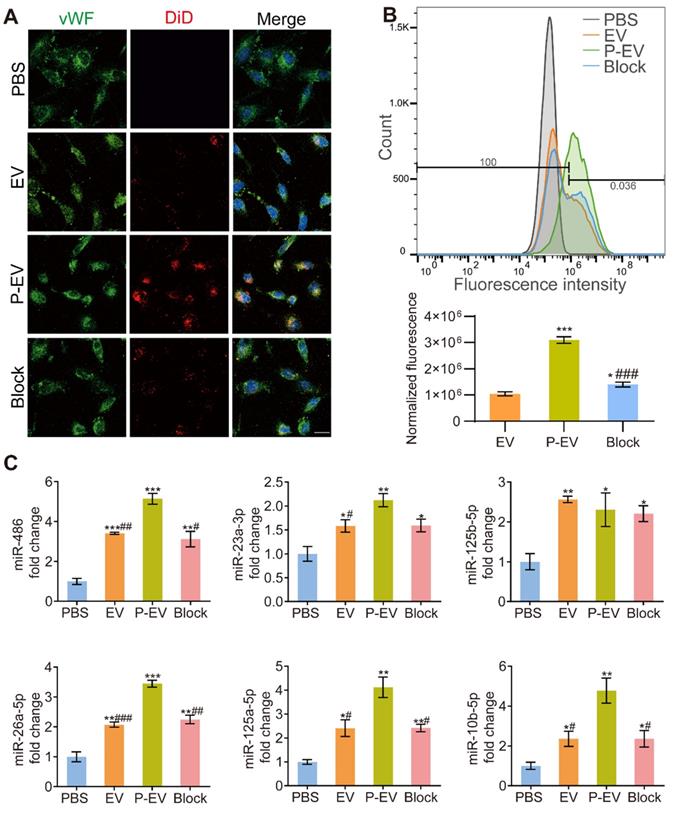
 体外验证P-EVs的靶向性和整合能力。缺氧和常氧下将HUVECs与P-EVs等共培养,DiD标记P-EVs后共聚焦和流式检测HUVECs对P-EVs的整合情况,qRT-PCR验证P-EVs处理后HUVECs中促血管新生的miRNA表达量。结果显示:P-EVs可融合至HUVECs中,并且可以转移促血管新生的miRNAs。
体外验证P-EVs的靶向性和整合能力。缺氧和常氧下将HUVECs与P-EVs等共培养,DiD标记P-EVs后共聚焦和流式检测HUVECs对P-EVs的整合情况,qRT-PCR验证P-EVs处理后HUVECs中促血管新生的miRNA表达量。结果显示:P-EVs可融合至HUVECs中,并且可以转移促血管新生的miRNAs。
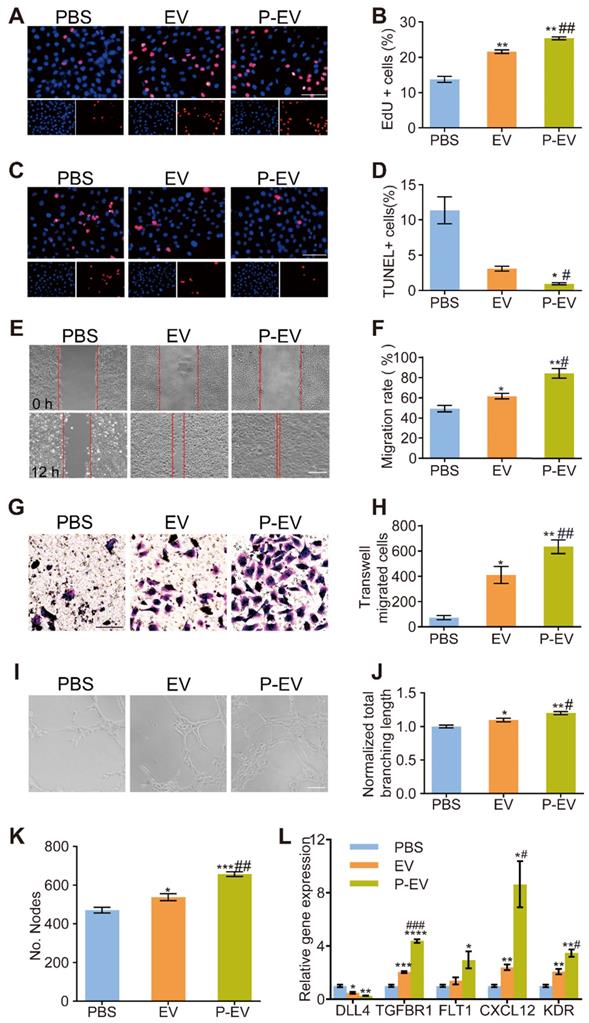
体外验证P-EVs的促血管新生能力,检测P-EVs处理后的HUVECs的增殖、迁移、管道形成能力。结果显示:P-EVs可促进HUVECs的增殖、迁移和血管新生。
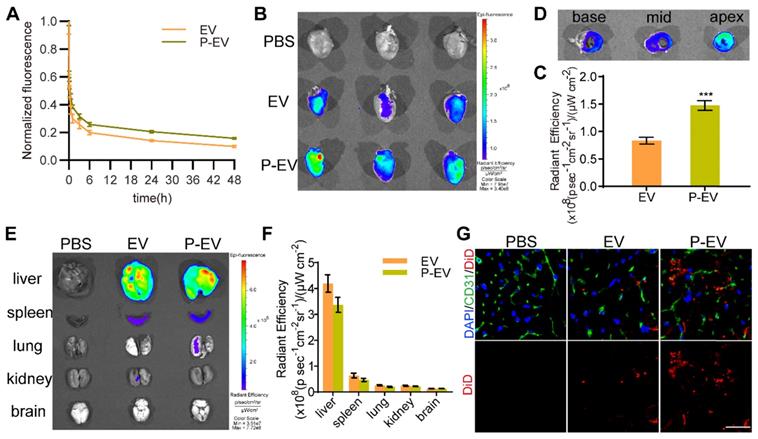
检测P-EVs在体内的药代动力学和靶向能力。DiD标记P-EVs后回输至心肌缺血再灌注损伤的模型鼠体内,原位荧光显像,心脏组织切片后免疫荧光染色检测P-EVs靶向至心肌的能力。结果显示:P-EVs可靶向转移至受损心肌。
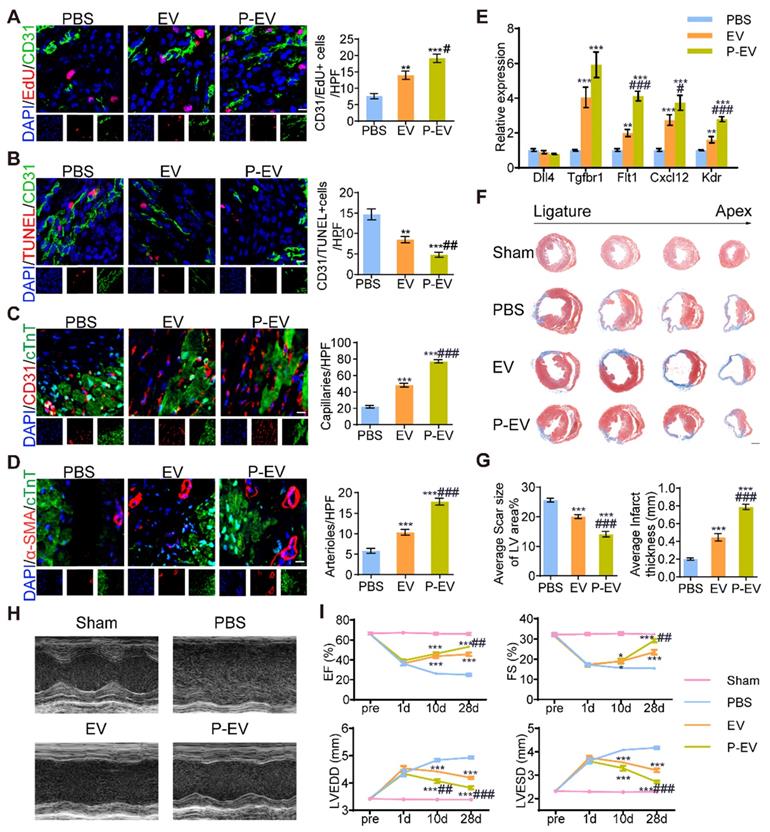
体内检测P-EVs对血管新生能力的促进作用以及整体的功能恢复。7天和28天心脏取材,免疫荧光检测ECs的增殖、毛细血管密度和小动脉密度,qRT-PCR检测血管新生相关基因变化。结果显示:P-EVs可促进体内的血管新生。
心脏切片染色观察心脏形态和心室壁厚度评估心功能,第1、10、28天心电图检测心功能,生存曲线评估整体的恢复情况。结果显示:P-EVs可促进心功能恢复。
安全性、免疫反应、血栓风险评估P-EVs的生物安全性。

【摘要】缺血性心脏病的一个主流治疗手段是提高血管新生,EVs可用于刺激血管新生,但是EVs的低靶向性限制了临床应用。本文作者将EVs融合血小板膜后回输至心肌缺血再灌注小鼠模型(MI/R)中验证靶向性和疗效。结果显示血小板膜融合后的EVs可有效增加靶向性,同时提高血管新生能力。

【前言】缺血性心脏病包括局部心肌血流不足、内皮功能紊乱、随年龄增加血管新生能力下降,因而成为全球患者主要死因。目前主要干预手段有药物和血管重建,但是仍然有一部分患者治疗后效果不佳。治疗性的血管新生是一个有前景的方法,通过递送蛋白、基因、干细胞、细胞外囊泡(EVs)等刺激血管新生。EVs因其稳定性好、较少引起免疫排斥反应,有较好的应用前景,但应用受限于较差的靶向性、脱靶效应。血小板膜应用于生物材料,可模拟血小板的归巢过程,因此本文作者将血小板膜融合至EVs中,增加EVs的靶向归巢能力,提高治疗效果。
【结果】
骨髓中分离MSCs,流式鉴定后提取EVs,TEM和NTA鉴定EVs大小和形态。膜融合后检测zeta电位,590nm吸光度判断P-EVs的血清稳定性。结果显示:膜融合后对EVs的基本特征改变不明显。




体外验证P-EVs的促血管新生能力,检测P-EVs处理后的HUVECs的增殖、迁移、管道形成能力。结果显示:P-EVs可促进HUVECs的增殖、迁移和血管新生。

检测P-EVs在体内的药代动力学和靶向能力。DiD标记P-EVs后回输至心肌缺血再灌注损伤的模型鼠体内,原位荧光显像,心脏组织切片后免疫荧光染色检测P-EVs靶向至心肌的能力。结果显示:P-EVs可靶向转移至受损心肌。

体内检测P-EVs对血管新生能力的促进作用以及整体的功能恢复。7天和28天心脏取材,免疫荧光检测ECs的增殖、毛细血管密度和小动脉密度,qRT-PCR检测血管新生相关基因变化。结果显示:P-EVs可促进体内的血管新生。
心脏切片染色观察心脏形态和心室壁厚度评估心功能,第1、10、28天心电图检测心功能,生存曲线评估整体的恢复情况。结果显示:P-EVs可促进心功能恢复。
安全性、免疫反应、血栓风险评估P-EVs的生物安全性。








