研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
文献解读:外泌体靶向递送雷公藤内酯素
1561 人阅读发布时间:2022-04-25 18:42
众所周知,外泌体Exo因其独特的优势,已被作为纳米递送材料用于各项研究中,但靶向性是评估药物递送和Exo治疗效率的重要指标,上海复旦大学刘继勇教授课题组提出了一种基于工程Exo的高效药物递送纳米载体的新策略。

文章链接:https://pubs.acs.org/doi/10.1021/acsami.1c10325
肿瘤坏死因子相关凋亡诱导配体TRAIL是一种II型跨膜蛋白,存在于细胞膜和Exo膜上,是死亡受体DR5(黑色素瘤的治疗靶点)的高亲和力配体,激活DR5后诱导细胞凋亡,现开发的几种基于TRAIL的药物,均具有半衰期短、靶向不足、生物利用度差和载体的临床适用性弱等劣势,因此需提高TRAIL的递送和功效。雷公藤内酯TPL具有多种药理活性,但因水溶性差、体内清除快和生物毒性严重,限制了临床应用。而巨噬细胞能特异性结合肿瘤组织,其来源的Exo继承其靶向能力,因此作者制备了TRAIL过表达RAW264.7细胞的Exo,装载TPL,能在体内外发挥治疗黑色素瘤的作用。
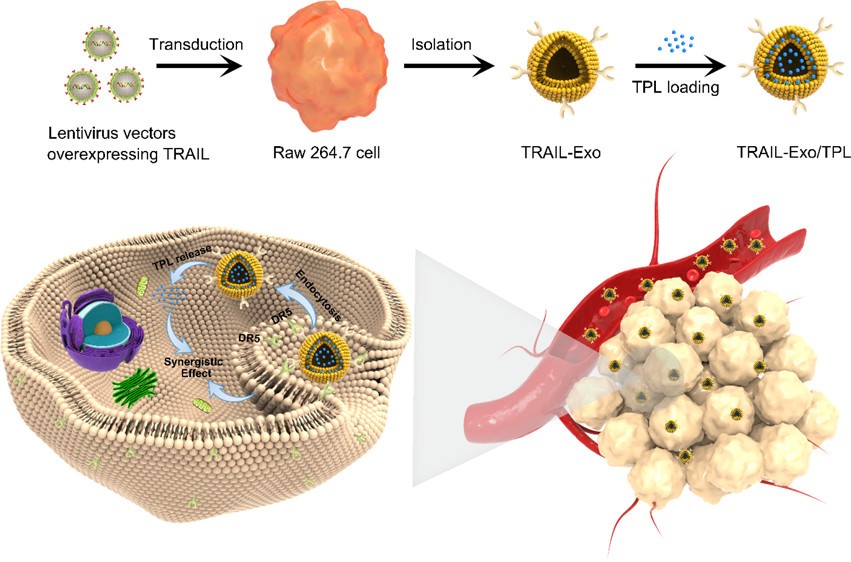
技术路线:
结果:
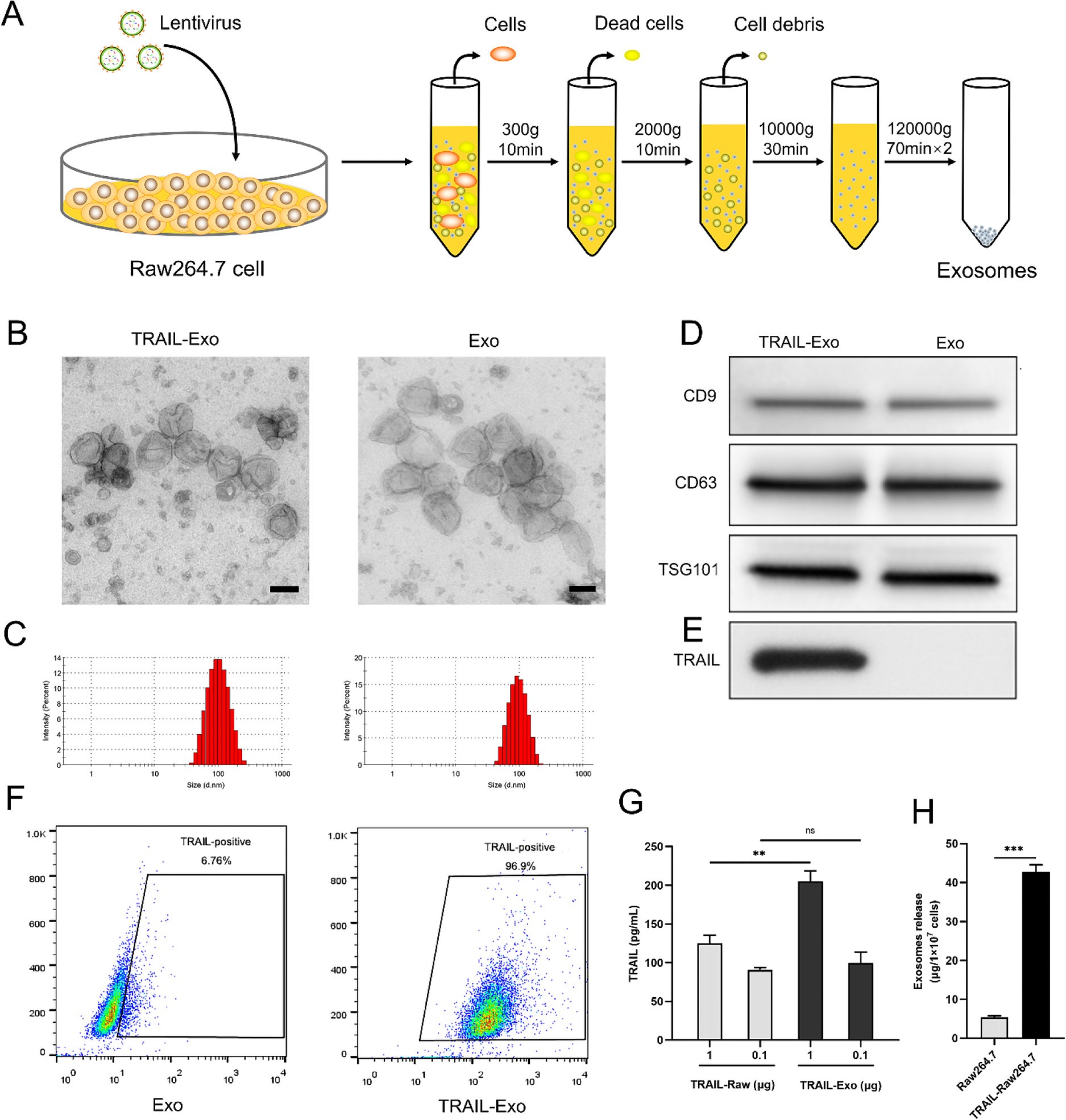
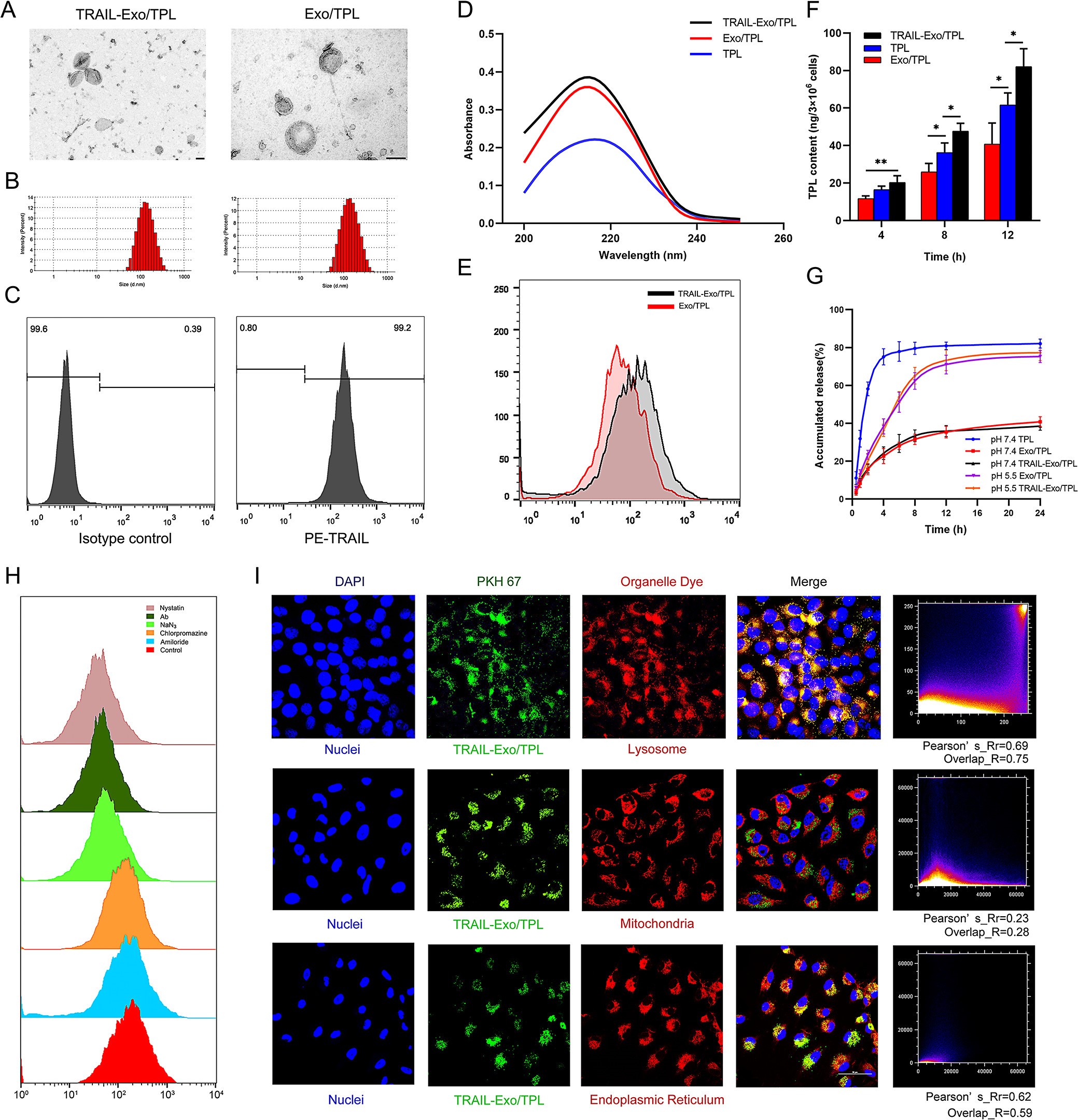
1. Exo的制备和表征
在RAW264.7细胞中过表达TRAIL后,TRAIL蛋白定位于细胞膜上。RAW264.7和TRAIL-RAW264.7细胞分泌的Exo与典型Exo的特征一致,但TRAIL-RAW264.7来源的Exo中含有TRAIL,且定位于Exo膜上。另TRAIL-RAW264.7细胞中的TRAIL含量要低于TRAIL-EXo,这与已发表的研究一致,TRAIL过表达的细胞能分泌含高水平TRAIL的Exo,同时促进Exo的分泌。
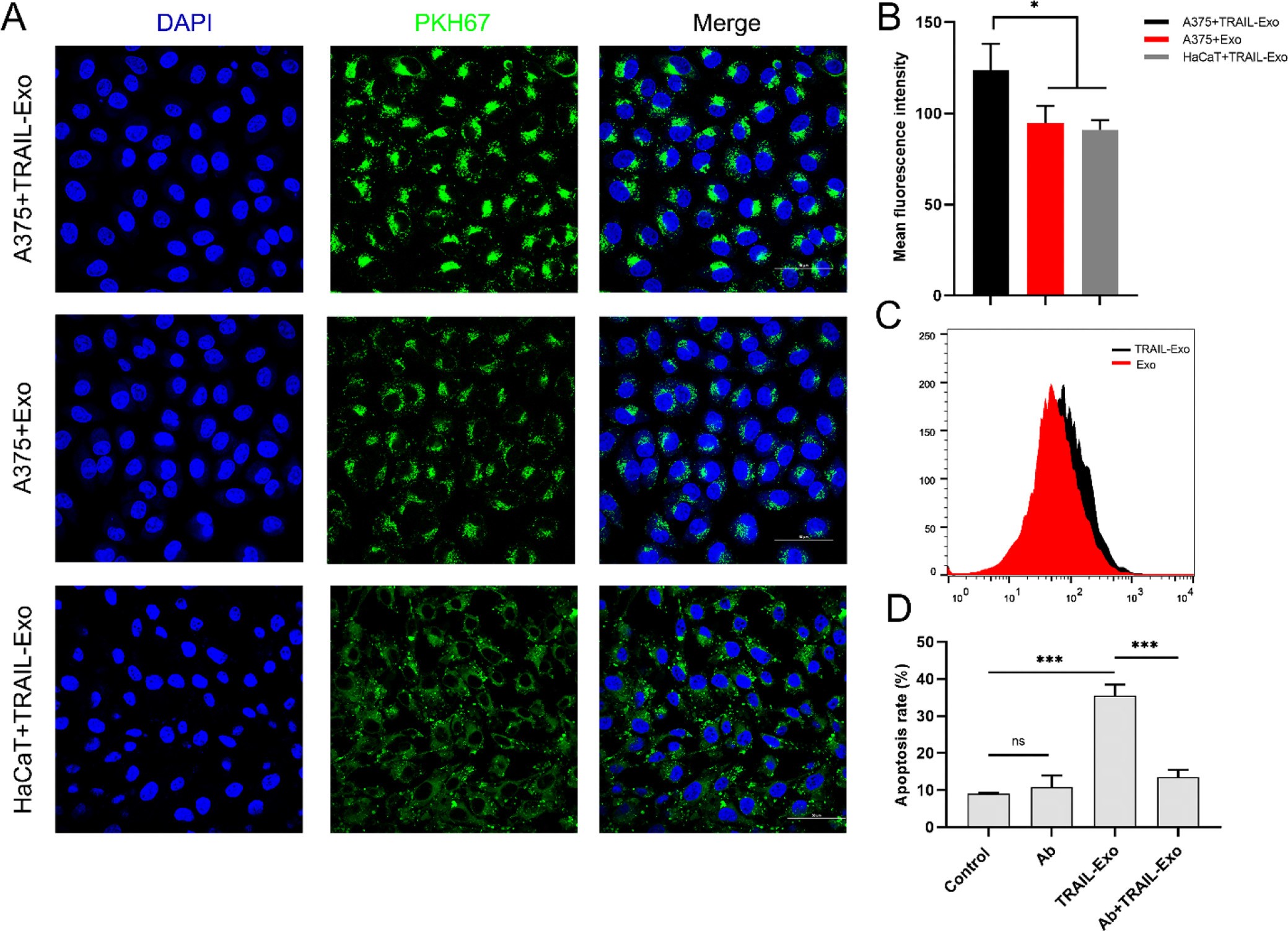
2. 体外细胞对Exo的摄取及其对细胞凋亡的影响
与TRAIL-Exo处理的HaCaT细胞和Exo处理的A375细胞相比,A375细胞能摄取更多的TRAIL-Exo,表明细胞摄取TRAIL-Exo不仅与其表面特征有关,还与受体介导的细胞类型有关,DR5和TRAIL的存在促进了细胞摄取Exo。
50ug/mL的TRAIL-Exo处理A375细胞24h,能诱导细胞凋亡,但若提前使用TRAIL抗体处理TRAIL-Exo,细胞凋亡率被消减,说明TRAIL-Exo能通过激活DR5诱导细胞凋亡。
3. 载TPL的Exo制备、表征及稳定性
通过超声方式将TPL载入Exo中,TRAIL-Exo的包封率为51.87+-4.85%,载药量为4.93+0.48%,载药后除粒径增大外,并不影响Exo的形态结构及TRAIL的存在。
通过监测不同储存条件下粒径随时间的变化探究TRAIL-Exo/TPL的稳定性。在4℃的PBS中7天内和在37℃的10%无Exo血清中24hours内,均未观察到明显的TRAIL-Exo/TPL聚集和不可忽略的变化。
4. TRAIL-Exo/TPL的细胞内化、摄取机制及细胞内定位
FCS分析结果表明与Exo/TPL相比,A375细胞能摄取更多的TRAIL-Exo/TPL。HPLC-MS/MS对细胞中的TPL进行量化,发现TRAIL-Exo/TPL处理的细胞内TPL浓度在12hours时分别是TPL和Exo/TPL的1.33倍和2.01倍。表明TRAIL-Exo/TPL可以更有效地将TPL递送到细胞内。
细胞可以通过多种方式摄取Exo,如受体-配体结合、胞饮作用、膜融合、吞噬和内吞作用。作者借用各途径的抑制剂,分析出细胞摄取TRAIL-Exo/TPL依赖于多种途径,包括小窝蛋白、DR5、能量和网格蛋白,但不依赖于胞饮,且以小窝蛋白介导的内吞作用为主。
PKH67标记的TRAIL-Exo/TPL与A375细胞共孵育时发现TRAIL-Exo/TPL在溶酶体、内质网和线粒体均有分布,且优先分布于溶酶体中,这为Exo的分解和TPL的释放提供便利。
5. 药物释放
体内药物的释放与其清除及副作用及利用率息息相关,因此作者通过通过透析的方式探究了TPL的释放,发现pH 7.4下游离TPL在4h内就呈现快速释放,而TRAIL-Exo/TPL和Exo/TPL在24h时后释放率仅35.9%和37.4%。然而在pH 5.5时,TRAIL-Exo/TPL和Exo/TPL在24hours后累计释放率达80%以上,说明Exo膜在生理环境下可以保护TPL,且酸性环境能通过增加Exo膜的流动性增强TPL释放。
6 . TRAIL-Exo/TPL的细胞毒性及对细胞凋亡、周期和迁移侵袭的影响
CCK8结果表明Exo对A375细胞无毒性,但TRAIL-Exo以浓度依赖性方式对A375细胞表现出细胞毒性,且TRAIL-Exo/TPL对细胞的杀伤力明显高于TPL和Exo/TPL。从FCS结果可以看出,与其他组相比,TRAIL-Exo/TPL具有明显的促A375细胞凋亡作用,这是TRAIL-DR5和TLP的双重作用导致的。周期结果显示TRAIL-Exo/TPL抑制了细胞G0/G1和S期,起到协同促凋亡作用。Transwell和划痕实验结果显示,TRAIL-Exo/TPL抑制了细胞的迁移侵袭能力,证明TRAIL-Exo/TPL降低了细胞的穿透效率和趋化能力。

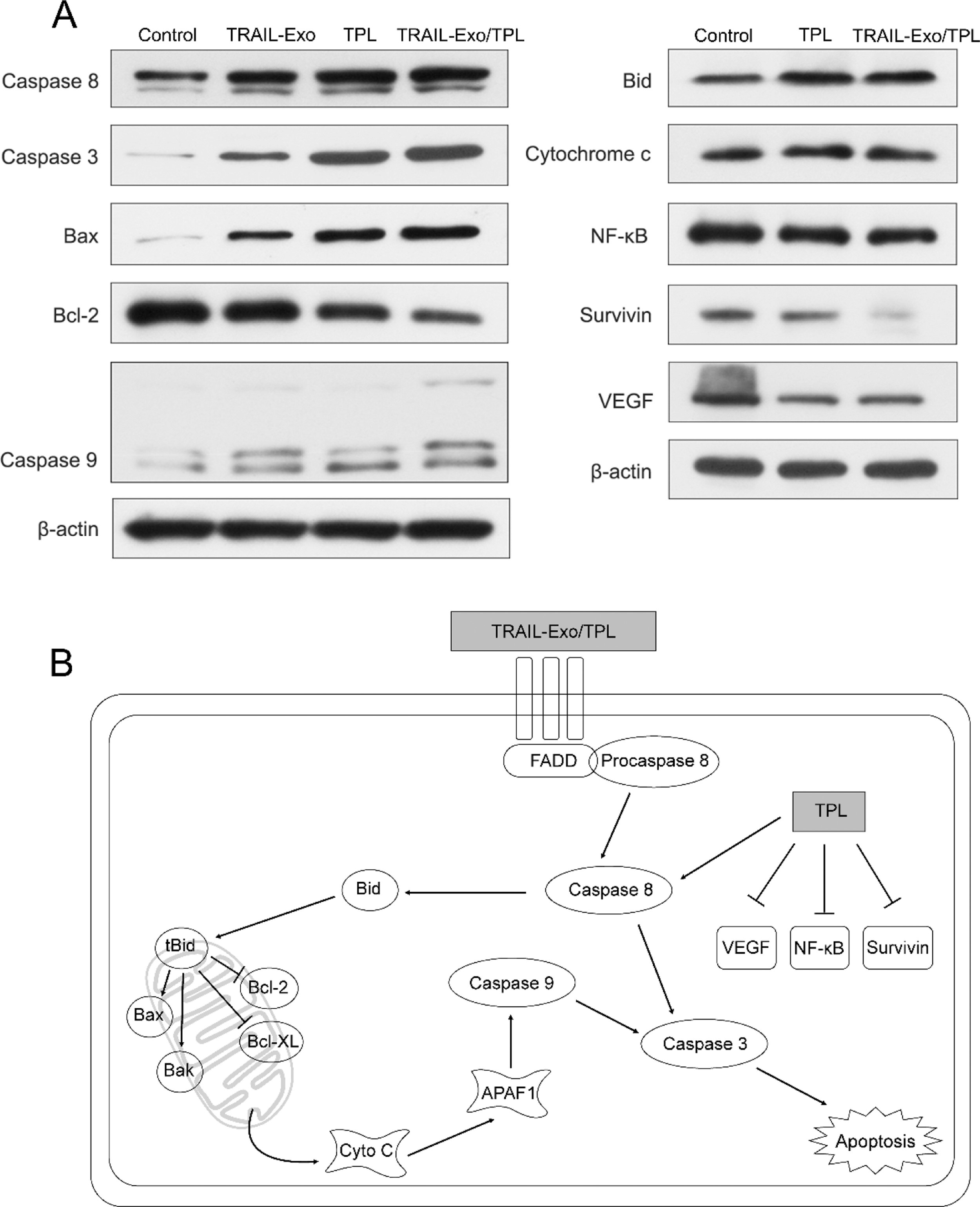
7. 协同机制
从已发表的研究中已知与TRAIL和TPL相关的凋亡信号通路,本研究通过western blot验证了TRAIL-Exo或TPL处理后,细胞内caspase-3、caspase-8、caspase-9、Bax、Bid和细胞色素C的表达受到上调,Bcl-2、NF-kB、VEGF和survivin表达下调,表明外在的TRAIL和内在的线粒体途径是TRAIL-Exo/TPL协同抗肿瘤作用的原因。
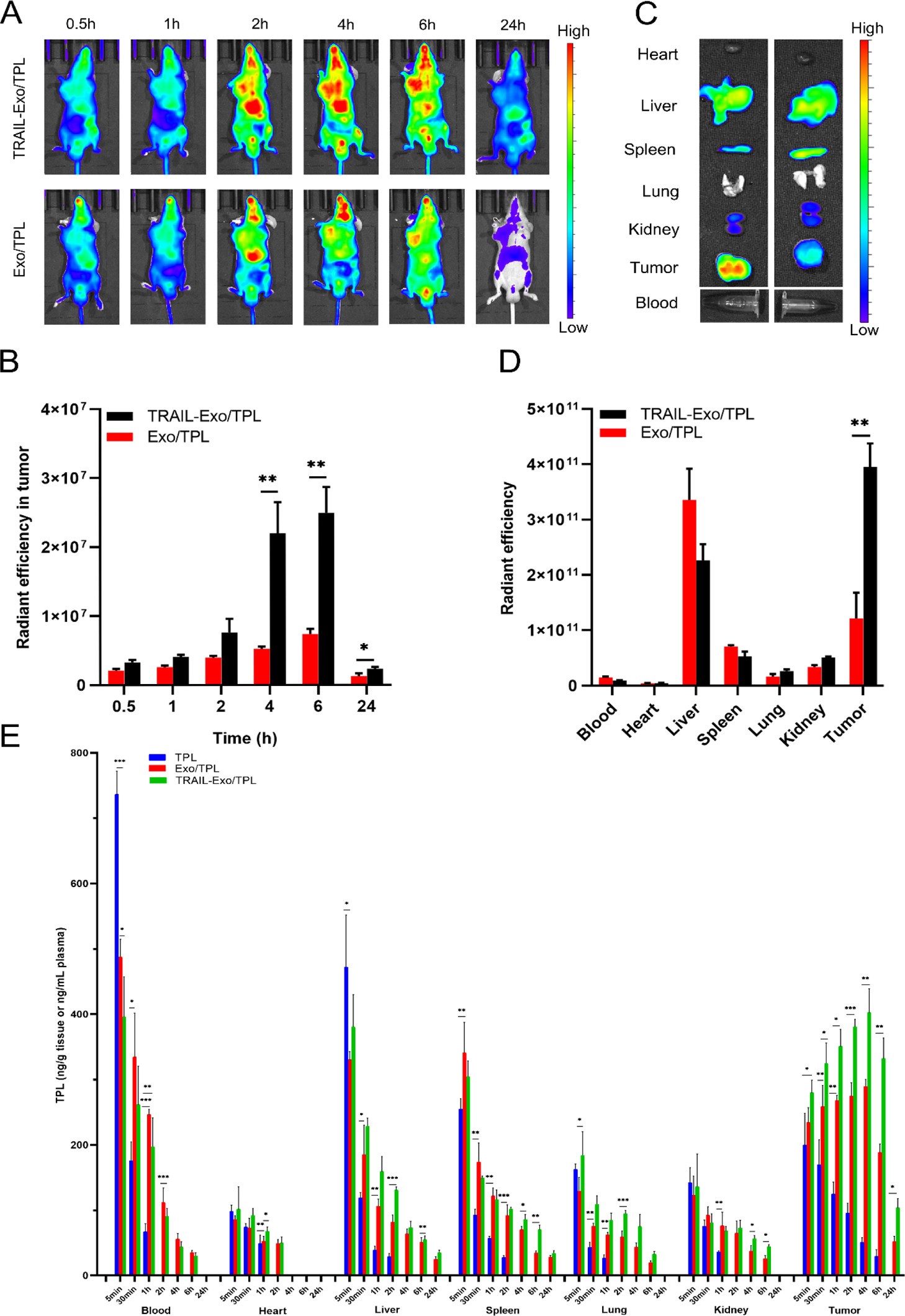
8. 生物分布
通过小鼠静脉注射,发现TRAIL-Exo/TPL以时间依赖性方式在肿瘤部位积累,6h达到峰值,24h后依然存在,说明工程化的药物递送系统能在体内复杂环境中保持高度稳定、长时间循环。TRAIL-Exo/TPL在给药4h后就能使肿瘤部位的TPL达到峰值,是Exo/TPL和游离TPLDE1.39倍和7.94倍。
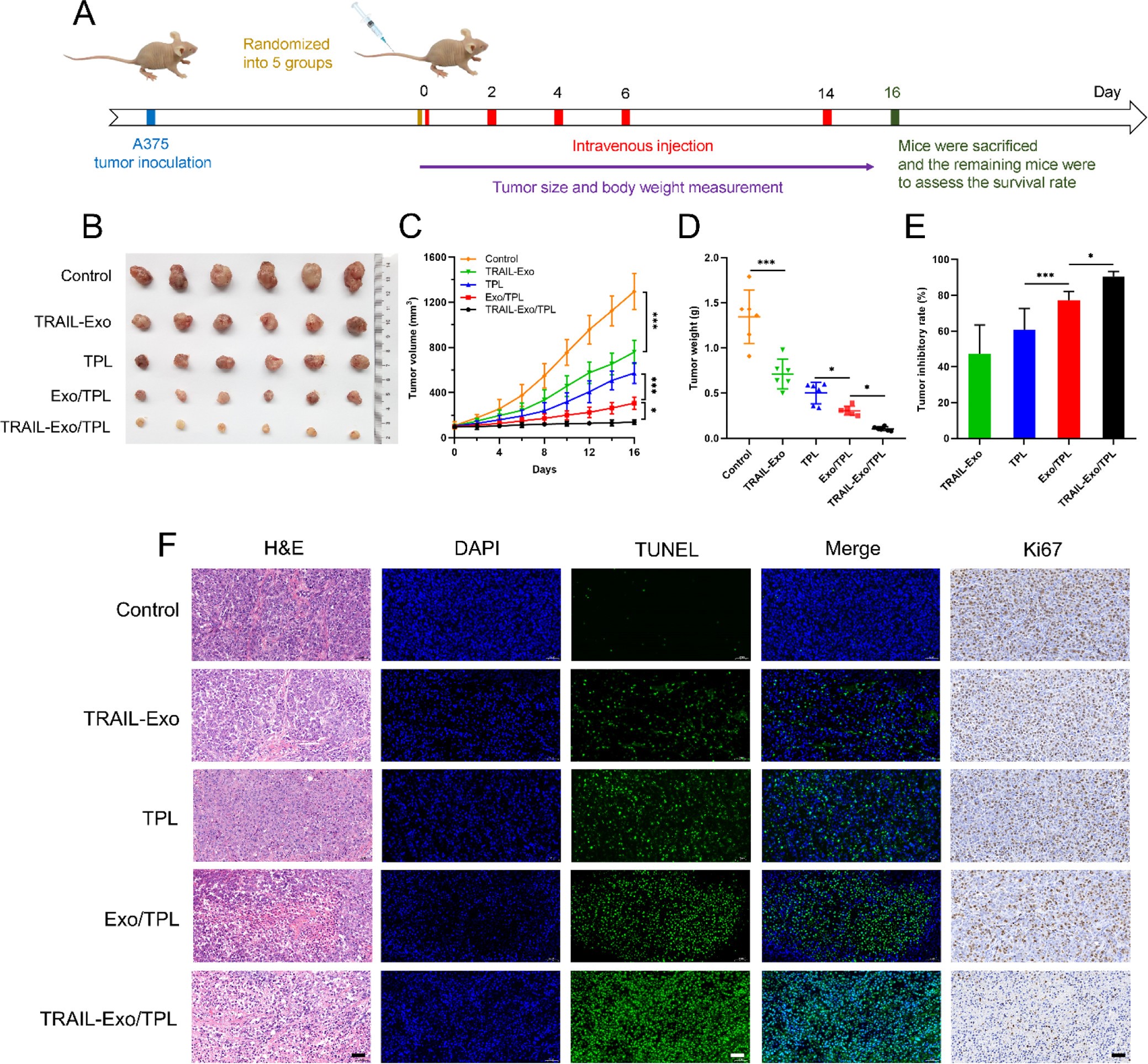
9. 体内治疗效果、生物安全和生物相容性
在A375小鼠肿瘤模型上探究TRAIL-Exo/TPL的治疗效果,发现TRAIL-Exo/TPL能很好的抑制肿瘤的增长,提高小鼠的存活时间,该组肿瘤组织表现最明显的病理病变。
TRAIL-Exo/TPL的突出治疗效果可能归结于:1)工程化Exo具有靶向能力;2)TRAIL-Exo可以在生理环境下保护药物;3)酸性的肿瘤环境有利于药物释放;4)携带Exo的生物流体促进Exo趋向肿瘤周围。
相对于TPL治疗组,TRAIL-Exo/TPL组小鼠未见明显的体重和器官重量下降,肝肾功能正常,各项血液指标正常,无骨髓抑制,说明TRAIL-Exo/TPL具有生物相容性,对肿瘤治疗具有良好的耐受性。
总结:
本研究表明巨噬细胞衍生的TRAIL工程化Exo,可作为纳米递送材料用于治疗黑色素瘤。TRAIL-Exo通过特异性结合DR5,增强Exo的靶向性并诱导细胞凋亡,作为载体,负载TPL后,可通过激活外源性和内源性凋亡通路增强细胞毒性,抑制肿瘤迁移侵袭,促进肿瘤凋亡。
【欢迎来电/邮件咨询】
电话:021-54376058
手机:18516646410/13917998048(微信同号)
邮箱:yanzaibio@yihaowan.cn, yanzaibio@163.com
地址: 上海市闵行区放鹤路1088号博济科技园6号楼109室

文章链接:https://pubs.acs.org/doi/10.1021/acsami.1c10325
肿瘤坏死因子相关凋亡诱导配体TRAIL是一种II型跨膜蛋白,存在于细胞膜和Exo膜上,是死亡受体DR5(黑色素瘤的治疗靶点)的高亲和力配体,激活DR5后诱导细胞凋亡,现开发的几种基于TRAIL的药物,均具有半衰期短、靶向不足、生物利用度差和载体的临床适用性弱等劣势,因此需提高TRAIL的递送和功效。雷公藤内酯TPL具有多种药理活性,但因水溶性差、体内清除快和生物毒性严重,限制了临床应用。而巨噬细胞能特异性结合肿瘤组织,其来源的Exo继承其靶向能力,因此作者制备了TRAIL过表达RAW264.7细胞的Exo,装载TPL,能在体内外发挥治疗黑色素瘤的作用。

技术路线:

结果:
1. Exo的制备和表征
在RAW264.7细胞中过表达TRAIL后,TRAIL蛋白定位于细胞膜上。RAW264.7和TRAIL-RAW264.7细胞分泌的Exo与典型Exo的特征一致,但TRAIL-RAW264.7来源的Exo中含有TRAIL,且定位于Exo膜上。另TRAIL-RAW264.7细胞中的TRAIL含量要低于TRAIL-EXo,这与已发表的研究一致,TRAIL过表达的细胞能分泌含高水平TRAIL的Exo,同时促进Exo的分泌。

2. 体外细胞对Exo的摄取及其对细胞凋亡的影响
与TRAIL-Exo处理的HaCaT细胞和Exo处理的A375细胞相比,A375细胞能摄取更多的TRAIL-Exo,表明细胞摄取TRAIL-Exo不仅与其表面特征有关,还与受体介导的细胞类型有关,DR5和TRAIL的存在促进了细胞摄取Exo。
50ug/mL的TRAIL-Exo处理A375细胞24h,能诱导细胞凋亡,但若提前使用TRAIL抗体处理TRAIL-Exo,细胞凋亡率被消减,说明TRAIL-Exo能通过激活DR5诱导细胞凋亡。

3. 载TPL的Exo制备、表征及稳定性
通过超声方式将TPL载入Exo中,TRAIL-Exo的包封率为51.87+-4.85%,载药量为4.93+0.48%,载药后除粒径增大外,并不影响Exo的形态结构及TRAIL的存在。
通过监测不同储存条件下粒径随时间的变化探究TRAIL-Exo/TPL的稳定性。在4℃的PBS中7天内和在37℃的10%无Exo血清中24hours内,均未观察到明显的TRAIL-Exo/TPL聚集和不可忽略的变化。
4. TRAIL-Exo/TPL的细胞内化、摄取机制及细胞内定位
FCS分析结果表明与Exo/TPL相比,A375细胞能摄取更多的TRAIL-Exo/TPL。HPLC-MS/MS对细胞中的TPL进行量化,发现TRAIL-Exo/TPL处理的细胞内TPL浓度在12hours时分别是TPL和Exo/TPL的1.33倍和2.01倍。表明TRAIL-Exo/TPL可以更有效地将TPL递送到细胞内。
细胞可以通过多种方式摄取Exo,如受体-配体结合、胞饮作用、膜融合、吞噬和内吞作用。作者借用各途径的抑制剂,分析出细胞摄取TRAIL-Exo/TPL依赖于多种途径,包括小窝蛋白、DR5、能量和网格蛋白,但不依赖于胞饮,且以小窝蛋白介导的内吞作用为主。
PKH67标记的TRAIL-Exo/TPL与A375细胞共孵育时发现TRAIL-Exo/TPL在溶酶体、内质网和线粒体均有分布,且优先分布于溶酶体中,这为Exo的分解和TPL的释放提供便利。
5. 药物释放
体内药物的释放与其清除及副作用及利用率息息相关,因此作者通过通过透析的方式探究了TPL的释放,发现pH 7.4下游离TPL在4h内就呈现快速释放,而TRAIL-Exo/TPL和Exo/TPL在24h时后释放率仅35.9%和37.4%。然而在pH 5.5时,TRAIL-Exo/TPL和Exo/TPL在24hours后累计释放率达80%以上,说明Exo膜在生理环境下可以保护TPL,且酸性环境能通过增加Exo膜的流动性增强TPL释放。

6 . TRAIL-Exo/TPL的细胞毒性及对细胞凋亡、周期和迁移侵袭的影响
CCK8结果表明Exo对A375细胞无毒性,但TRAIL-Exo以浓度依赖性方式对A375细胞表现出细胞毒性,且TRAIL-Exo/TPL对细胞的杀伤力明显高于TPL和Exo/TPL。从FCS结果可以看出,与其他组相比,TRAIL-Exo/TPL具有明显的促A375细胞凋亡作用,这是TRAIL-DR5和TLP的双重作用导致的。周期结果显示TRAIL-Exo/TPL抑制了细胞G0/G1和S期,起到协同促凋亡作用。Transwell和划痕实验结果显示,TRAIL-Exo/TPL抑制了细胞的迁移侵袭能力,证明TRAIL-Exo/TPL降低了细胞的穿透效率和趋化能力。

7. 协同机制
从已发表的研究中已知与TRAIL和TPL相关的凋亡信号通路,本研究通过western blot验证了TRAIL-Exo或TPL处理后,细胞内caspase-3、caspase-8、caspase-9、Bax、Bid和细胞色素C的表达受到上调,Bcl-2、NF-kB、VEGF和survivin表达下调,表明外在的TRAIL和内在的线粒体途径是TRAIL-Exo/TPL协同抗肿瘤作用的原因。

8. 生物分布
通过小鼠静脉注射,发现TRAIL-Exo/TPL以时间依赖性方式在肿瘤部位积累,6h达到峰值,24h后依然存在,说明工程化的药物递送系统能在体内复杂环境中保持高度稳定、长时间循环。TRAIL-Exo/TPL在给药4h后就能使肿瘤部位的TPL达到峰值,是Exo/TPL和游离TPLDE1.39倍和7.94倍。

9. 体内治疗效果、生物安全和生物相容性
在A375小鼠肿瘤模型上探究TRAIL-Exo/TPL的治疗效果,发现TRAIL-Exo/TPL能很好的抑制肿瘤的增长,提高小鼠的存活时间,该组肿瘤组织表现最明显的病理病变。
TRAIL-Exo/TPL的突出治疗效果可能归结于:1)工程化Exo具有靶向能力;2)TRAIL-Exo可以在生理环境下保护药物;3)酸性的肿瘤环境有利于药物释放;4)携带Exo的生物流体促进Exo趋向肿瘤周围。
相对于TPL治疗组,TRAIL-Exo/TPL组小鼠未见明显的体重和器官重量下降,肝肾功能正常,各项血液指标正常,无骨髓抑制,说明TRAIL-Exo/TPL具有生物相容性,对肿瘤治疗具有良好的耐受性。

总结:
本研究表明巨噬细胞衍生的TRAIL工程化Exo,可作为纳米递送材料用于治疗黑色素瘤。TRAIL-Exo通过特异性结合DR5,增强Exo的靶向性并诱导细胞凋亡,作为载体,负载TPL后,可通过激活外源性和内源性凋亡通路增强细胞毒性,抑制肿瘤迁移侵袭,促进肿瘤凋亡。
【欢迎来电/邮件咨询】
电话:021-54376058
手机:18516646410/13917998048(微信同号)
邮箱:yanzaibio@yihaowan.cn, yanzaibio@163.com
地址: 上海市闵行区放鹤路1088号博济科技园6号楼109室






