研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
心肌细胞外泌体抑制肿瘤铁死亡敏感性,IF=38,高分文章,值得收藏!
969 人阅读发布时间:2023-05-17 14:53
哈尔滨医科大学杨宝峰及杜伟杰共同通讯2023你那3月27日在Signal Transduction and Targeted Therapy(IF=38)在线发表题为“Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure”的研究论文,作者首次揭示心肌梗死通过释放源自心肌细胞的富含mir -22-3p的外泌体抑制erastin(典型铁死亡激活剂)诱导的铁死亡。因此,靶向外泌体介导的心肌细胞/肿瘤病理通讯可能为基于铁死亡的抗肿瘤治疗提供一种新的途径。该研究表明心肌梗死(MI)降低了肿瘤细胞对异种移植瘤小鼠模型的典型铁死亡激活剂的敏感性。在小鼠中,心肌梗死后血浆外泌体显著降低了肿瘤细胞对铁死亡诱导剂的敏感性。miR-22-3p在慢性心肌梗死小鼠和心衰患者心肌细胞和血浆外泌体中的表达显著上调,并被包装在外泌体中转移到肿瘤细胞。

心脏遭受缺血性损伤时,心肌细胞会释放许多不同种类的细胞外囊泡,其中包括外泌体。外泌体由细胞膜包裹而成,内含脂质、蛋白质和核酸等生物分子。
缺血性心力衰竭是一种心脏疾病,是心肌细胞遭受缺血性损伤后无法恢复其正常功能,导致心脏功能受损的结果。缺血性心力衰竭患者可能面临合并癌症的风险,因为缺血性心脏疾病与癌症之间存在相互关联。一些研究表明,心肌细胞释放的外泌体可能在缺血性心力衰竭患者中发挥了重要作用,但与癌症的关联关系还不清楚。铁死亡(Ferroptosis)是一种新型的非凋亡性细胞死亡方式,与肿瘤的发生和治疗密切相关。铁死亡是一种过程性死亡,与铁离子的代谢失衡和脂质过氧化物的积累有关,通常在一些肿瘤细胞中表现出特异性。下面,作者探讨了心肌细胞分泌的外泌体对肿瘤细胞铁死亡的影响。
MI诱导的心力衰竭通过erastin减弱对肿瘤生长的抑制
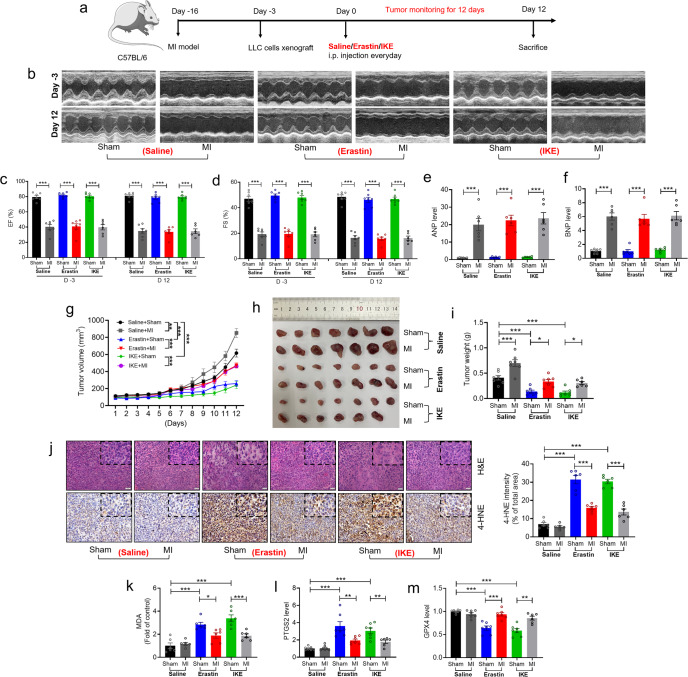
使用典型的铁死亡激活剂erastin和IKE,结合Sham或MI的实验模型,在异种移植瘤中抑制肿瘤生长(图a)。与对照小鼠相比,MI后心功能显著降低(图a-d)。与假手术对照组相比,MI小鼠中公认的HF标志物ANP和BNP的mRNA水平显著升高(图e-f),MI小鼠的肿瘤体积和重量显著增加,MI可加速肿瘤生长(图g-i)。与对照组相比,erastin或IKE处理显著增加了肿瘤组织中铁死亡水平,但这些作用被MI显著抑制(图j-m)。这些结果表明,心肌梗死诱导的HF在体内抑制了肿瘤对铁死亡的敏感性。
外泌体对erastin诱导的体内肿瘤铁死亡的影响
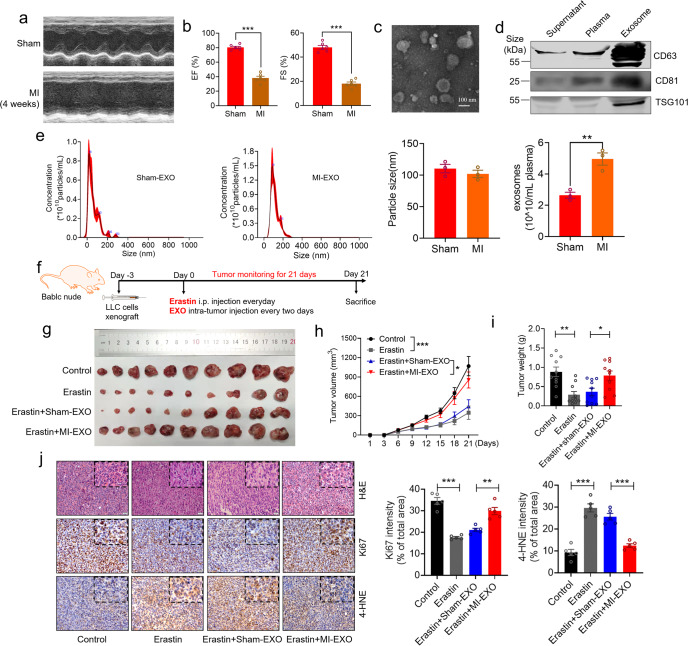
作者建立了心肌梗死诱导的HF小鼠模型(图a-b)。通过超离心分离小鼠血浆外泌体,均表达外泌体标志物并在典型外泌体大小的正常范围内(图c-e)。为了评估血浆外泌体在erastin处理的异种移植瘤上的活性,连续21天每2天给BALBc裸鼠接种等量外泌体后监测肿瘤生长(图f)。在LLC(小鼠肺癌模型)异种移植瘤中,erastin诱导脂质过氧化并抑制肿瘤生长,使用MI-EXO治疗显著恢复肿瘤生长 (图g-i)。免疫组化染色显示,erastin处理后Ki67染色下降,铁死亡水平增加,MI-EXO显著逆转这些效应 (图j)。这些结果表明,来自MI诱导的HF的外泌体可以减弱肿瘤对铁死亡的敏感性。
外泌体对体外培养erastin诱导的肿瘤细胞铁死亡的影响
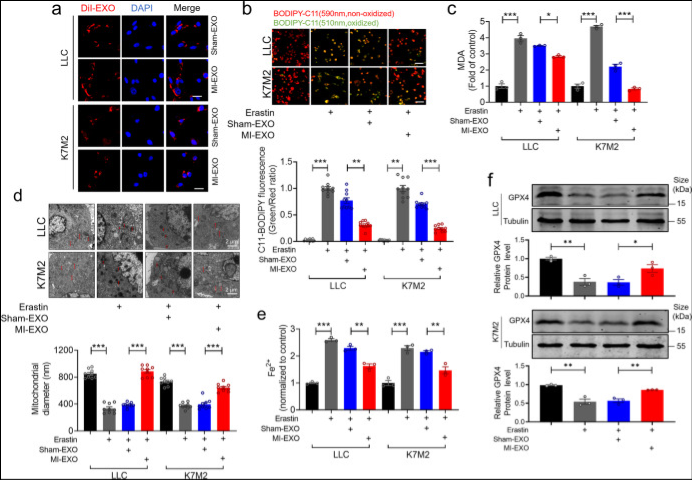
将Sham-EXOs或MI-EXOs与小鼠LLC肺癌细胞株或K7M2骨肉瘤细胞株共培养。Dil标记的外泌体在12小时在两株细胞系中均检测到(图a),表明外泌体可以与肿瘤细胞有效融合。此外,erastin增加了细胞中脂质ROS的积累和MAD水平,MI-EXO抑制这种效应以及erastin诱导的铁死亡 (图b-c)。如图3所示,在LLC和K7M2细胞中,erastin处理后线粒体缩短,MI-EXO处理比sham-EXO处理更能防止这种变形。
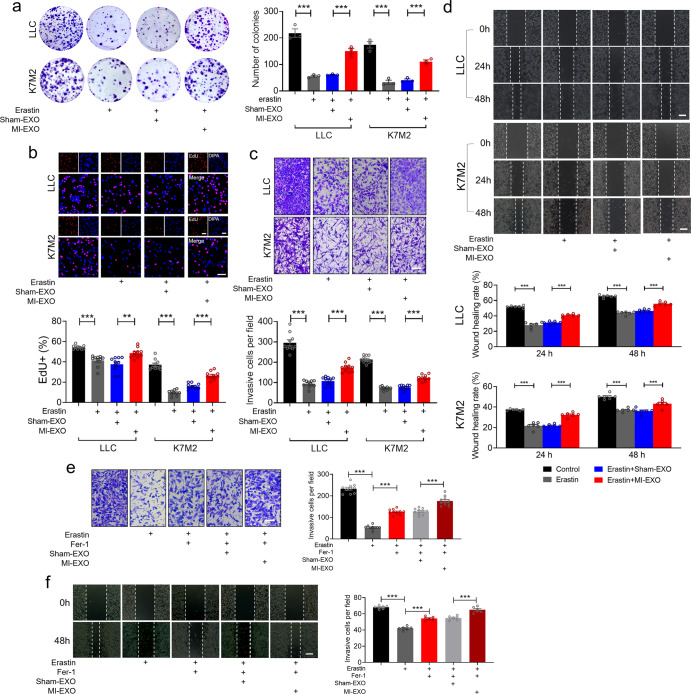
Erastin显著抑制LLC和K7M2细胞的增殖、侵袭和迁移,MI-EXO处理减轻了erastin的作用(图4a-d)。作者用铁死亡抑制剂铁他汀-1 (fer1)处理细胞发现,应用fer1显著减弱了erastin对LLC细胞的侵袭和迁移的抑制作用,而MI-EXO进一步增强了这种抑制作用(图4e-f)。这些数据表明MI-EXO抑制了癌细胞的铁死亡。
HF衍生的外泌体miR-22-3p抑制肿瘤铁死亡
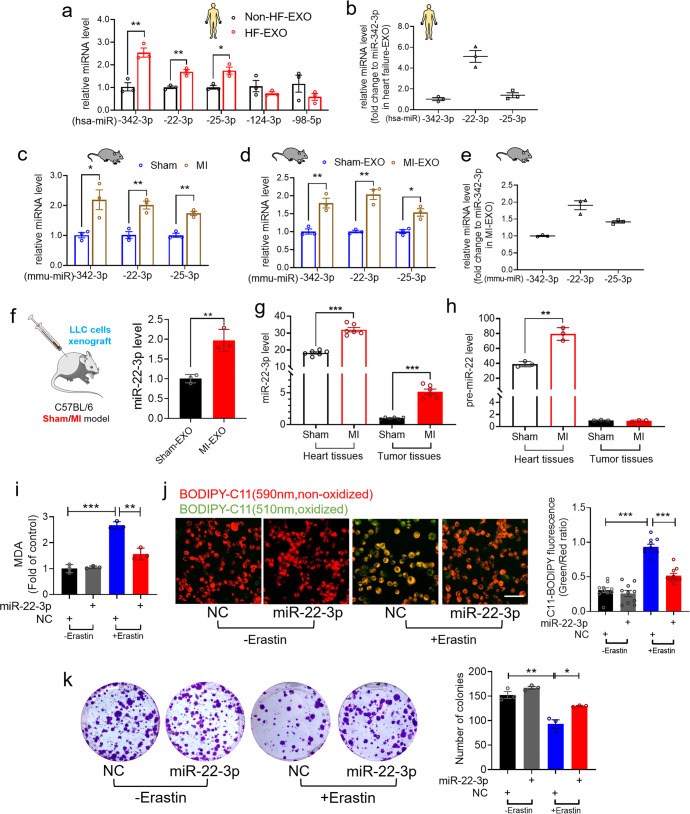
miR-342-3p、miR-22-3p和miR-25-3p在HF-EXO中表达明显高于非HF-EXO(图a),其中miR-22-3p是HF-EXO血浆外泌体中表达最丰富的miRNAs(图b)。这表明miR-22-3p可能在MI-HF环境中抑制肿瘤细胞对铁死亡的敏感性。MI后4周小鼠心肌组织和血浆外泌体中miR-342-3p、miR-22-3p和miR-25-3p的表达显著增加(图c-e)。
此外,小鼠缺血心肌和血浆外泌体中的miR-223p水平均上调。与假手术的异种移植小鼠相比,MI的异种移植小鼠外泌体miR-22-3p含量升高(图f)。假手术小鼠心脏组织中miR-22-3p的水平比肿瘤组织中大约高18.3倍。然而,与假对照相比,MI患者肿瘤组织中miR-22-3p的表达显著升高(图g)。值得注意的是,心肌梗死动物的心肌组织中pre-miR-22的水平显著上调,而在心肌梗死动物的肿瘤组织中则没有上调(图h)。这些结果表明,外泌体miR-22-3p来源于心肌梗死诱导的HF,削弱了erastin诱导的对铁死亡的敏感性。
来自心肌细胞的外泌体miR-22-3p抑制肿瘤细胞的铁死亡
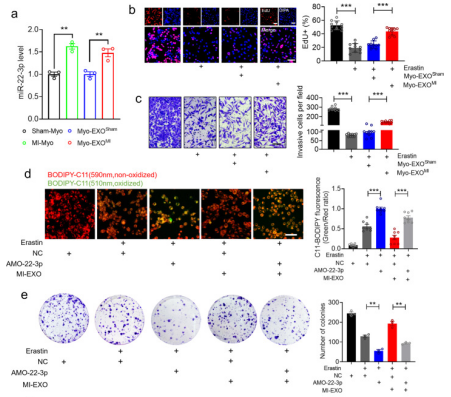
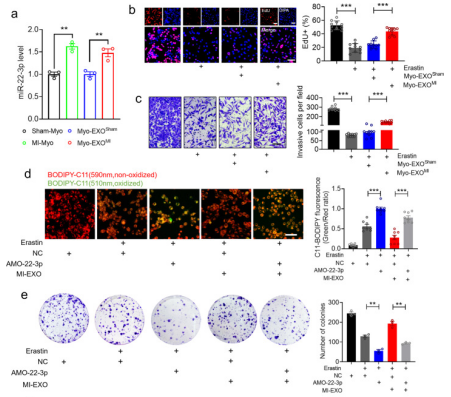
作者从经过假手术(Sham-myo)或MI (MI-myo)的小鼠中获取成年心室心肌细胞和纯化的心肌外泌体(Myo-EXOSham)和(Myo-EXOMI)。与Sham-Myo和MyoEXOsham组相比,MI-Myo和MyoEXOMI组的miR-22-3p分别上调(图a)。更重要的是,在经erastin处理的LLC细胞中,细胞增殖和侵袭被抑制,添加Myo-EXOMI可恢 (图b-c)。作者采用通过将AMO-22-3p转染到癌细胞中敲除miR-22-3p,进一步促erastin引起的脂质ROS生成的积累,抑制了肿瘤细胞的集落形成能力,说明内源性miR-223p对肿瘤细胞具有铁死亡的保护作用(图d-e)。
miR-22-3p与运铁相关基因ACSL4的直接相互作用
作者通过CLIP-seq确定酰基- CoA ACSL4为miR-22-3p的候选靶基因。ACSL4 mRNA中miR-22-3p的预测结合位点如图a所示。ACSL4是一个重要的前铁链基因,肺癌组织中的ACSL4水平明显低于癌旁组织(图b)。与对照相比,erastin或IKE处理显著增加了肿瘤组织中ACSL4的表达,但MI显著抑制了这些效应(图7c)。ACSL4蛋白水平在单独使用erastin处理后升高,但在存在erastin的情况下,miR-22-3p模拟物转染后降低(图d-e)。如图f所示,共转染miR-22-3p,通过转染含有ACSL4基因序列的质粒,可以显著挽救过表达ACSL4后LLC细胞中菌落形成能力的抑制作用。miR-22-3p转染消除了脂质ros积累的减少和ACSL4蛋白表达的减少 (图h-j)。这些数据表明,miR-22-3p通过靶向LLC细胞中的ACSL4抑制erastin诱导的铁死亡。
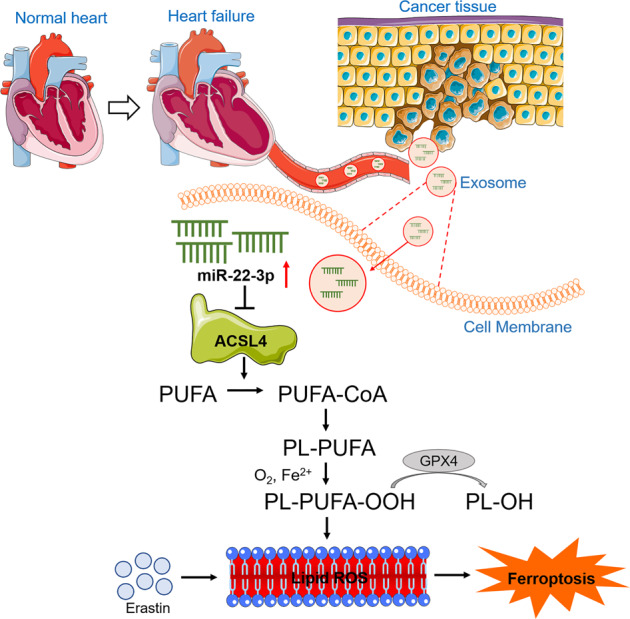
作者认为心肌外泌体是一种保护心肌梗死后癌细胞免于铁死亡的新信使。在缺血心肌细胞中,成熟的miR-22-3p显著增加。MiR-22-3p被包裹在外泌体中,并从心肌细胞转移到肿瘤细胞,在肿瘤细胞中,MiR-22-3p抑制ACSL4的表达,ACSL4是铁死亡敏感性的关键决定因素。心肌特异性阻断miR-22-3p的生物发生或抑制靶基因ACSL4的激活可能是阻断外泌体介导的心肌与肿瘤组织间病理通讯的一种新的有效治疗途径。
总之,本研究首次揭示了心肌梗死患者心脏与肿瘤之间的新信号通路:MI→心脏源性外泌体→肿瘤细胞→外泌体释放miR22-3p→ACSL4的抑制→脂质过氧化的抑制→铁离子活化敏感性的抑制→肿瘤生长的加重(图8)。这些发现具有重要的临床意义。

心脏遭受缺血性损伤时,心肌细胞会释放许多不同种类的细胞外囊泡,其中包括外泌体。外泌体由细胞膜包裹而成,内含脂质、蛋白质和核酸等生物分子。
缺血性心力衰竭是一种心脏疾病,是心肌细胞遭受缺血性损伤后无法恢复其正常功能,导致心脏功能受损的结果。缺血性心力衰竭患者可能面临合并癌症的风险,因为缺血性心脏疾病与癌症之间存在相互关联。一些研究表明,心肌细胞释放的外泌体可能在缺血性心力衰竭患者中发挥了重要作用,但与癌症的关联关系还不清楚。铁死亡(Ferroptosis)是一种新型的非凋亡性细胞死亡方式,与肿瘤的发生和治疗密切相关。铁死亡是一种过程性死亡,与铁离子的代谢失衡和脂质过氧化物的积累有关,通常在一些肿瘤细胞中表现出特异性。下面,作者探讨了心肌细胞分泌的外泌体对肿瘤细胞铁死亡的影响。
MI诱导的心力衰竭通过erastin减弱对肿瘤生长的抑制

使用典型的铁死亡激活剂erastin和IKE,结合Sham或MI的实验模型,在异种移植瘤中抑制肿瘤生长(图a)。与对照小鼠相比,MI后心功能显著降低(图a-d)。与假手术对照组相比,MI小鼠中公认的HF标志物ANP和BNP的mRNA水平显著升高(图e-f),MI小鼠的肿瘤体积和重量显著增加,MI可加速肿瘤生长(图g-i)。与对照组相比,erastin或IKE处理显著增加了肿瘤组织中铁死亡水平,但这些作用被MI显著抑制(图j-m)。这些结果表明,心肌梗死诱导的HF在体内抑制了肿瘤对铁死亡的敏感性。
外泌体对erastin诱导的体内肿瘤铁死亡的影响

作者建立了心肌梗死诱导的HF小鼠模型(图a-b)。通过超离心分离小鼠血浆外泌体,均表达外泌体标志物并在典型外泌体大小的正常范围内(图c-e)。为了评估血浆外泌体在erastin处理的异种移植瘤上的活性,连续21天每2天给BALBc裸鼠接种等量外泌体后监测肿瘤生长(图f)。在LLC(小鼠肺癌模型)异种移植瘤中,erastin诱导脂质过氧化并抑制肿瘤生长,使用MI-EXO治疗显著恢复肿瘤生长 (图g-i)。免疫组化染色显示,erastin处理后Ki67染色下降,铁死亡水平增加,MI-EXO显著逆转这些效应 (图j)。这些结果表明,来自MI诱导的HF的外泌体可以减弱肿瘤对铁死亡的敏感性。
外泌体对体外培养erastin诱导的肿瘤细胞铁死亡的影响

将Sham-EXOs或MI-EXOs与小鼠LLC肺癌细胞株或K7M2骨肉瘤细胞株共培养。Dil标记的外泌体在12小时在两株细胞系中均检测到(图a),表明外泌体可以与肿瘤细胞有效融合。此外,erastin增加了细胞中脂质ROS的积累和MAD水平,MI-EXO抑制这种效应以及erastin诱导的铁死亡 (图b-c)。如图3所示,在LLC和K7M2细胞中,erastin处理后线粒体缩短,MI-EXO处理比sham-EXO处理更能防止这种变形。

Erastin显著抑制LLC和K7M2细胞的增殖、侵袭和迁移,MI-EXO处理减轻了erastin的作用(图4a-d)。作者用铁死亡抑制剂铁他汀-1 (fer1)处理细胞发现,应用fer1显著减弱了erastin对LLC细胞的侵袭和迁移的抑制作用,而MI-EXO进一步增强了这种抑制作用(图4e-f)。这些数据表明MI-EXO抑制了癌细胞的铁死亡。
HF衍生的外泌体miR-22-3p抑制肿瘤铁死亡

miR-342-3p、miR-22-3p和miR-25-3p在HF-EXO中表达明显高于非HF-EXO(图a),其中miR-22-3p是HF-EXO血浆外泌体中表达最丰富的miRNAs(图b)。这表明miR-22-3p可能在MI-HF环境中抑制肿瘤细胞对铁死亡的敏感性。MI后4周小鼠心肌组织和血浆外泌体中miR-342-3p、miR-22-3p和miR-25-3p的表达显著增加(图c-e)。
此外,小鼠缺血心肌和血浆外泌体中的miR-223p水平均上调。与假手术的异种移植小鼠相比,MI的异种移植小鼠外泌体miR-22-3p含量升高(图f)。假手术小鼠心脏组织中miR-22-3p的水平比肿瘤组织中大约高18.3倍。然而,与假对照相比,MI患者肿瘤组织中miR-22-3p的表达显著升高(图g)。值得注意的是,心肌梗死动物的心肌组织中pre-miR-22的水平显著上调,而在心肌梗死动物的肿瘤组织中则没有上调(图h)。这些结果表明,外泌体miR-22-3p来源于心肌梗死诱导的HF,削弱了erastin诱导的对铁死亡的敏感性。
来自心肌细胞的外泌体miR-22-3p抑制肿瘤细胞的铁死亡

作者从经过假手术(Sham-myo)或MI (MI-myo)的小鼠中获取成年心室心肌细胞和纯化的心肌外泌体(Myo-EXOSham)和(Myo-EXOMI)。与Sham-Myo和MyoEXOsham组相比,MI-Myo和MyoEXOMI组的miR-22-3p分别上调(图a)。更重要的是,在经erastin处理的LLC细胞中,细胞增殖和侵袭被抑制,添加Myo-EXOMI可恢 (图b-c)。作者采用通过将AMO-22-3p转染到癌细胞中敲除miR-22-3p,进一步促erastin引起的脂质ROS生成的积累,抑制了肿瘤细胞的集落形成能力,说明内源性miR-223p对肿瘤细胞具有铁死亡的保护作用(图d-e)。
miR-22-3p与运铁相关基因ACSL4的直接相互作用

作者通过CLIP-seq确定酰基- CoA ACSL4为miR-22-3p的候选靶基因。ACSL4 mRNA中miR-22-3p的预测结合位点如图a所示。ACSL4是一个重要的前铁链基因,肺癌组织中的ACSL4水平明显低于癌旁组织(图b)。与对照相比,erastin或IKE处理显著增加了肿瘤组织中ACSL4的表达,但MI显著抑制了这些效应(图7c)。ACSL4蛋白水平在单独使用erastin处理后升高,但在存在erastin的情况下,miR-22-3p模拟物转染后降低(图d-e)。如图f所示,共转染miR-22-3p,通过转染含有ACSL4基因序列的质粒,可以显著挽救过表达ACSL4后LLC细胞中菌落形成能力的抑制作用。miR-22-3p转染消除了脂质ros积累的减少和ACSL4蛋白表达的减少 (图h-j)。这些数据表明,miR-22-3p通过靶向LLC细胞中的ACSL4抑制erastin诱导的铁死亡。

作者认为心肌外泌体是一种保护心肌梗死后癌细胞免于铁死亡的新信使。在缺血心肌细胞中,成熟的miR-22-3p显著增加。MiR-22-3p被包裹在外泌体中,并从心肌细胞转移到肿瘤细胞,在肿瘤细胞中,MiR-22-3p抑制ACSL4的表达,ACSL4是铁死亡敏感性的关键决定因素。心肌特异性阻断miR-22-3p的生物发生或抑制靶基因ACSL4的激活可能是阻断外泌体介导的心肌与肿瘤组织间病理通讯的一种新的有效治疗途径。
总之,本研究首次揭示了心肌梗死患者心脏与肿瘤之间的新信号通路:MI→心脏源性外泌体→肿瘤细胞→外泌体释放miR22-3p→ACSL4的抑制→脂质过氧化的抑制→铁离子活化敏感性的抑制→肿瘤生长的加重(图8)。这些发现具有重要的临床意义。






