研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
肝星状细胞来源的外泌体缺失miR-148a-3p通过 ITGA5/PI3K/Akt轴促进肝癌的进展,10分+,高分文章轻松拿捏!
584 人阅读发布时间:2023-06-07 16:10
目前,肝细胞癌(HCC)是世界范围内癌症相关死亡的主要原因之一,虽然肝星状细胞(HSCs)在肝癌的发生发展中起着重要作用,但其与肿瘤细胞相互作用的分子机制尚不清楚。作者通过miRNA阵列分析筛选出肝癌细胞共培养的HSCs (LX-2细胞)中异常低表达的miR-148a-3p;HSCs中过表达miR-148a-3p可明显抑制共培养的HCC细胞体外和体内增殖;从外泌体的方向分析发现miR-148a-3p过表达的HSCs分泌的外泌体可在体内体外抑制肝癌的进展;在肝癌细胞中,miR-148a-3p通过靶向ITGA5进一步抑制PI3K/Akt信号的活性,从而介导肝癌进展抑制作用。
发表杂志:《International journal of biological sciences》
文章标题:《Exosome-depleted MiR-148a-3p derived from Hepatic Stellate Cells Promotes Tumor Progression via ITGA5/PI3K/Akt Axis in Hepatocellular Carcinoma》

一、与肝癌细胞共培养的肝星状细胞(HSCs)的miRNA表达谱

A:作者将人HSC细胞株LX-2分别与三种肝癌细胞株PLC/PRF/5(PLC)、SMMC-7721(7721)和 HCCLM3(LM3)共培养两周,来研究HSC与肿瘤细胞在微环境中的相互作用。
B-D:利用miRNA阵列分析鉴定共培养LX-2细胞的表达谱。从阵列中存在的2549个miRNAs探针中发现,在PLC/PRF/5, SMMC-7721或HCCLM3 LX-2共培养的细胞中分别检测到51、34或61个异常miRNAs。
E:有28个miRNAs是3种共培养细胞中都表达异常的。
F:进一步KEGG富集分析发现miR-148a-3p显著参与癌症相关通路。
根据以上结果,miR-148a-3p被用于后续实验的研究。
二、miR-148a-3p在HSCs和原发性肝癌相关成纤维细胞中低表达以及HSC中过表达miR-148a-3p抑制共培养的HCC细胞体外和体内增殖
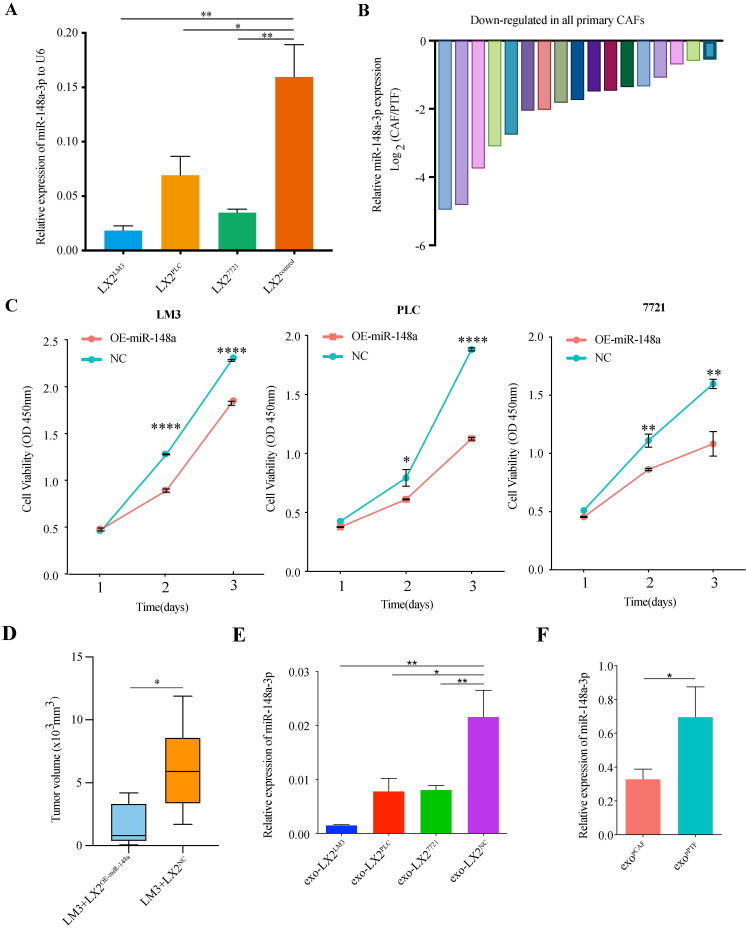
A:LX-2细胞分别与PLC/PRF/5, SMMC-7721或HCCLM3共培养,然后检测共培养LX-2细胞中miR-148a-3p的表达。结果显示,与对照组相比,共培养的LX-2细胞中miR-148a-3p的表达均显著降低。
B:作者收集HCC肿瘤组织,通过磁珠分选出CAFs,检测miR-148a-3p的表达情况。通过对CAFs的形态学观察并结合WB和IHC检测,鉴定CAFs。作在检测到的17个成对组织样本中,与正常成纤维细胞比较,CAFs中的miR-148a的表达水平均显著下调。
C:过表达miR-148a-3p的LX-2细胞与HCC细胞共培养。结果显示,与过表达miR-148a-3p的LX-2细胞共培养,HCC细胞的细胞活力显著受到抑制。
D:LM3和LX-2 OE-miR-148a 或control (LX-2 NC)通过皮下注射入Balb/c无胸腺雄性小鼠中,研究HSCs对HCC的体内作用。4周后,结果显示,注射LX-2 OE-miR-148a相比于对照组,肿瘤组织更小。
E-F:miR-148a-3p在与共培养的LX-2细胞的外泌体中低表达,同时HCC患者来源的原发性CAFs分泌的外泌体中的表达也呈低水平状态。
三、miR-148a-3p过表达 HSCs来源的外泌体在体外和体内可抑制肝癌的致瘤功能
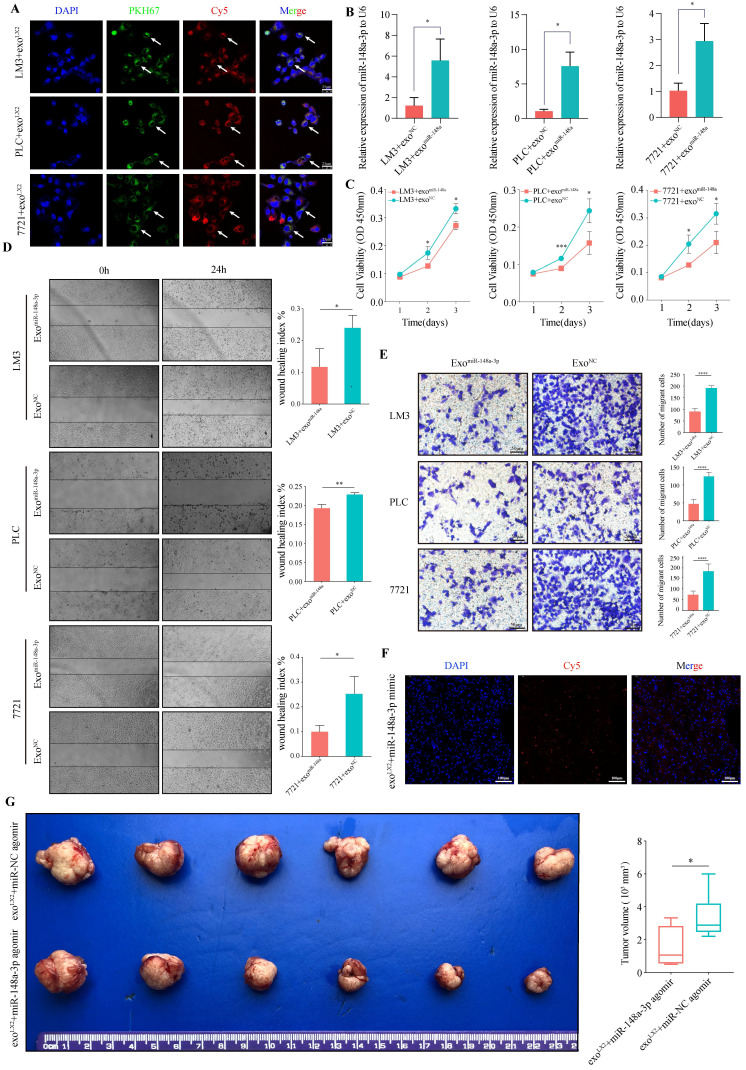
A:利用共聚焦显微镜观察发现,过表达miR-148a-3pLX-2细胞的外泌体可被HCC细胞顺利摄取。
B:与对照组相比,在miR-148a-3p过表达的外泌体共培养的HCC细胞表现出更高的miR-148a-3p水平。
C:研究外泌体miR-148a-3p被HCC细胞摄取后是否具有抑癌作用,作者通过测定其增殖和侵袭能力进行评估。结果显示,miR-148a-3p 过表达的外泌体显著抑制肿瘤细胞的增殖能力、细胞活力和侵袭能力。
F:从转染Cy5标记的hsa-miR-148a-3p agomir或agomir NC 的LX-2细胞培养基中分离得到外泌体,随后,外泌体通过尾静脉注入原位肝肿瘤BALB/c小鼠中,连续注射4周,每周3次。通过扫描激光共聚焦显微镜对肿瘤冷冻切片进行评估,检测到agomir的Cy5信号,表明肿瘤细胞摄取了外泌体。
G:过表达miR-148a-3p外泌体可显著抑制肝癌细胞增殖。
四、miR-148a-3p作为肿瘤抑制因子,通过靶向ITGA5影响PI3K/Akt信号通路,抑制肝癌细胞的恶性特征
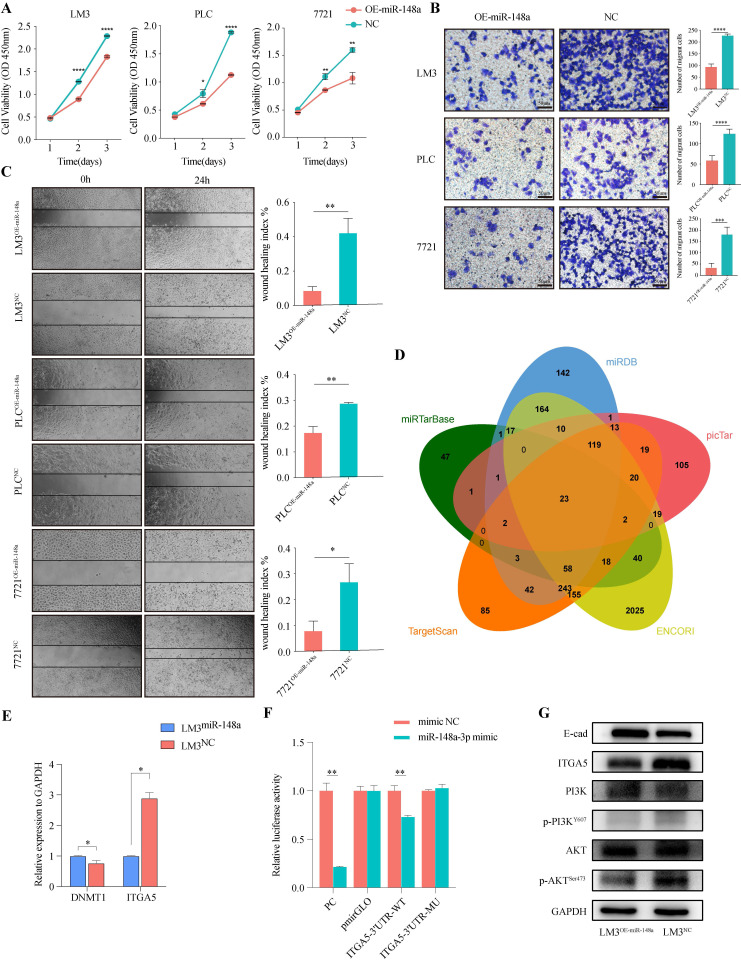
A-C:为了评估miR-148a-3p在HCC细胞中的功能,作者将过表达的miR-148a慢病毒或对照分别转染到PLC、7721和LM3中。通过实验发现,过表达miR-148a可显著抑制HCC细胞增殖、侵袭和迁移。
D:为了进一步寻找miR-148a-3p抑制HCC进展的潜在机制,作者在5个miRNA靶基因预测数据库中(miRDB, miRTargetBase, miRanda, TargetScan, picTar)寻找miR-148a-3p的候选靶基因。
E:作者通过qRT-PCR分析验证靶基因的表达,发现ITGA5与miR-148a-3p的表达变化相反。
F:在293T细胞中进行双荧光素酶报告基因检测,结果表明,与ITGA5-3'UTR-WT相比,miR-148a-3p的过表达显著降低了ITGA5-3'UTR-WT的萤火虫荧光素酶活性。
G:作者评估HCC细胞中过表达miR-148a-3p后PI3K和Akt的水平及其磷酸化状态,结果显示ITGA5、磷酸化PI3K (P-PI3K)和磷酸化Akt (P-Akt)表达显著降低,而E-cad水平水平显著增高。
这些结果表明,miR-148a-3p/ITGA5轴通过EMT调控PI3K/Akt信号的活性,介导HCC细胞的恶性特征。
五、miR-148a-3p和ITGA5与HCC患者预后相关
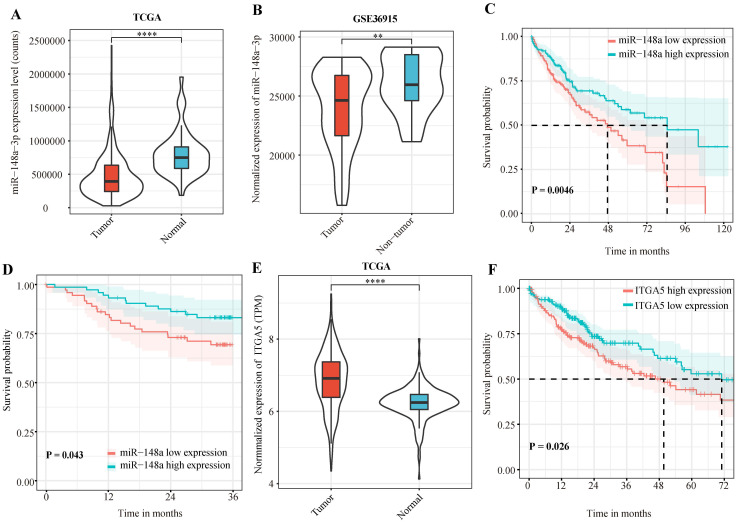
A-B:为了探讨miR-148a-3p在HCC患者中表达的临床意义,作者通过TCGA-LIHC数据集发现,与正常组织相比,miR-148a-3p在肝癌组织中表达下调,而且GSE 36915数据集验证了这一结果。
C:根据miR-148a-3p在肿瘤组织中的中位表达量将患者分为高表达亚组和低表达亚组。结果表明,miR-148a-3p低表达患者的OS时间明显短于高表达组。
D:随后对146例HCC患者血浆样本进行生信分析。结合TCGA数据,血浆中miR-148a-3p低表达患者的OS时间明显较短。
E-F:利用TCGA数据库检测HCC患者的ITGA5,发现ITGA5在肿瘤组织中明显上调,这与HCC患者的OS较差有关。






