研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
我宣布!“国自然热点”才是发文利器!15+的两大国自然热点联合文章,简直太牛了吧!!!
506 人阅读发布时间:2024-12-05 13:47
自噬相关物质降解和非常规分泌的鉴定,能够将自噬与多种生理过程和疾病状况联系起来。然而,协调这两种途径的机制仍未可知。本文证明了从溶酶体降解到分泌型自噬途径的转换是由蛋白酪氨酸磷酸酶1B (PTP1B,由PTPN1编码)控制的,PTP1B使突触融合蛋白17 (STX17)的两个酪氨酸残基去磷酸化,减少自噬体-溶酶体融合,同时将细胞转换为分泌型自噬途径,而PTP1B过表达和肿瘤来源的细胞外囊泡(EVs)均可激活成骨细胞的分泌型自噬通路。

湾湾今天分享的是一篇发表在【J EXTRACELL VESICLES】(IF:15.5)上题为“A switch from lysosomal degradation to secretory autophagy initiates osteogenic bone metastasis in prostate cancer”的研究,该研究揭示了肿瘤调节的 PTP1B 在自噬体命运决定中的重要性,并提出 LC3+ EVs在塑造骨转移生态位中的作用。
研究成果
1. PTPN1敲除介导自噬体成熟为自溶酶体,不依赖于溶酶体酸化
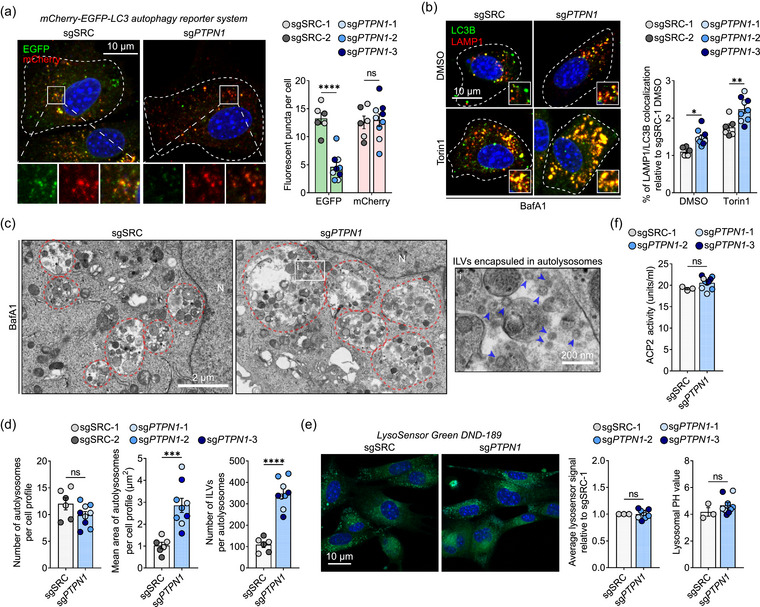
图1 PTPN1敲除以独立于溶酶体酸化方式介导自噬体成熟为自噬体
图1a:左图,使用共聚焦显微镜对转染mCherry-EGFP-LC3报告质粒的sgSRC和sg PTPN1细胞进行EGFP和mCherry荧光成像。右图是每个细胞EGFP和mCherry阳性荧光点的定量。
图1b:左图,sgSRC和sg PTPN1中LC3B和LAMP1的代表性免疫荧光染色细胞。用BafA1 处理细胞2小时,并在指定位置添加Torin1 6小时。右图,定量显示了LC3B和LAMP1相对于用DMSO载体处理的sgSRC-1细胞的共定位百分比(%)。
图1c:左图和中图,sgSRC和sg PTPN1的代表性TEM图像用BafA1处理细胞2小时。右图是封装在自溶酶体中的ILV示例(对应于中间图像中的i)。
图1d:定量显示每个细胞轮廓的自溶酶体数量、单个自溶酶体的平均面积以及自溶酶体内部的ILV数量。
图1e:sgSRC和sg PTPN1之间溶酶体功能的定量比较细胞。条形图显示相对于sgSRC-1 细胞的平均溶酶体染色强度(左)和溶酶体PH值(右)。
图1f:sgSRC和sgPTPN1细胞之间ACP2活性的定量比较。
这些结果表明PTPN1敲除以独立于溶酶体酸化的方式介导自噬体成熟为自溶酶体。
2. PTP1B在Tyr157和Tyr227处使STX17去磷酸化
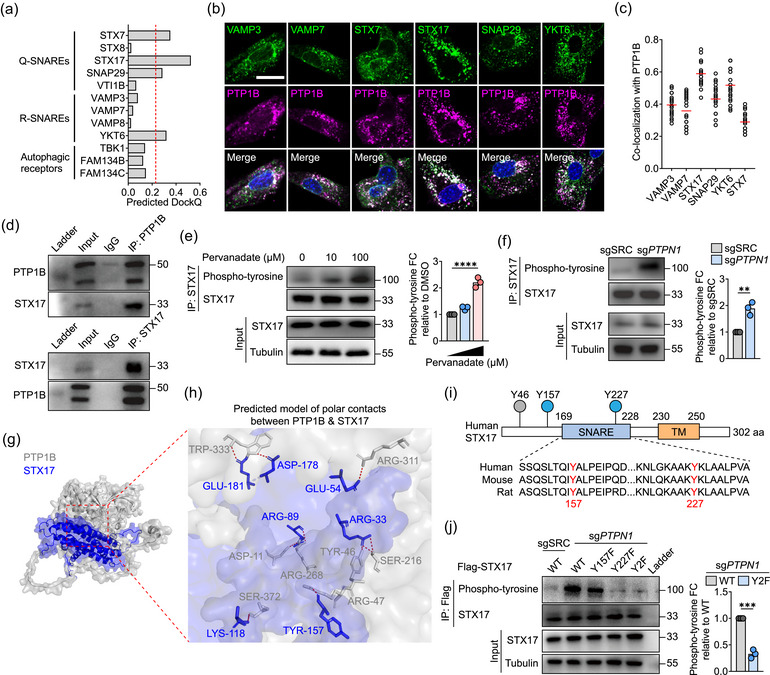
图2 PTP1B在Tyr157和Tyr227处使STX17去磷酸化
图2a:与PTP1B相互作用涉及的每种蛋白质的预测DockQ分数。
图2b:细胞中PTP1B和3个Q-SNARE或3个R-SNARE的代表性免疫荧光染色。
图2c:如(b)所示,在n = 20 个细胞中对PTP1B和所示SNARE蛋白(绿色点)之间的共定位进行定量,数据以皮尔逊相关系数 (r) 表示。
图2d:来自三个独立实验的代表性蛋白质印迹图像。
图2e:左图,蛋白质印迹分析显示用指定浓度的过钒酸盐处理15分钟的细胞的免疫沉淀实验。右图,相对于DMSO的磷酸酪氨酸倍数变化的定量分析。
图2f:左图,蛋白质印迹分析显示sgSRC和sg PTPN1细胞的免疫沉淀实验。右图,相对于sgSRC的磷酸酪氨酸倍数变化的定量分析。
图2g,h:PTP1B/STX17复合物的预测三维异二聚体模型。
图2i:顶部,人类STX17结构域结构的示意图。底部,三个物种中STX17的SNARE结构域的氨基酸序列比对。
图2j:左,SG PTPN1用STX17的WT、Y157F、Y227F和Y2F突变体转染的细胞用抗FLAG抗体进行免疫沉淀并进行蛋白质印迹分析。右侧的条形图显示了相对于WT的Y2F突变的磷酸酪氨酸水平的量化。
这些结果表明PTP1B靶向Q-SNARE STX17的苯丙氨酸突变(磷酸突变体Y157F和Y227F)残基并使其去磷酸化。
3. STX17去磷酸化负调控SNARE复合物形成和自噬体-溶酶体融合
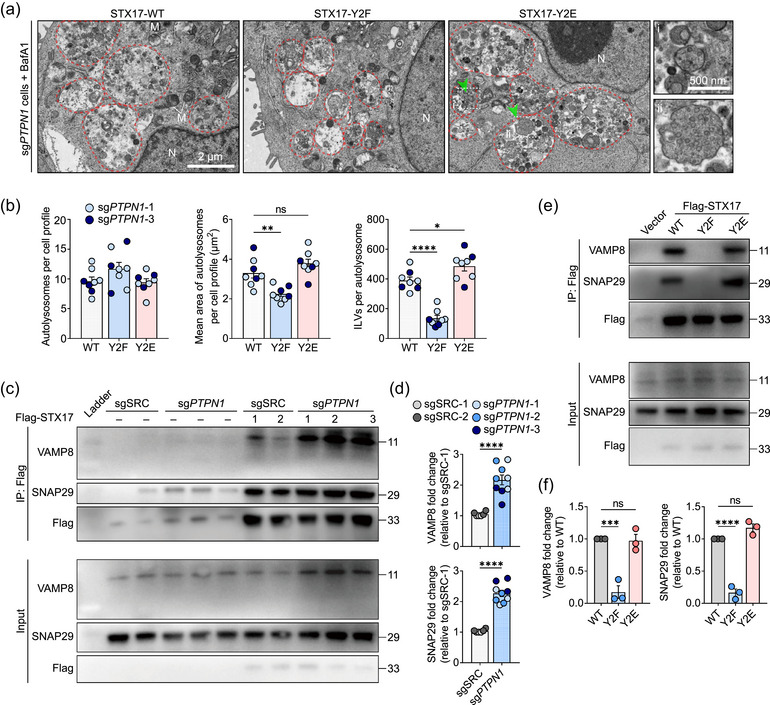
图3 STX17去磷酸化负向调节SNARE复合物形成和自噬体-溶酶体融合
图3a:转染STX17-WT、STX17-Y2F和STX17-Y2E突变体的sg PTPN1细胞的代表性TEM图像。
图3b:定量显示每个细胞轮廓的自溶酶体数量、单个自溶酶体的平均面积以及自溶酶体内部的ILV数量。
图3c:用抗FLAG抗体对来自sgSRC和sg PTPN1细胞培养物的裂解物进行免疫沉淀,并进行蛋白质印迹分析。
图3d:条形图显示sg PTPN1细胞相对于sgSRC-1细胞的VAMP8和SNAP29倍数变化的量化。
图3e:用抗FLAG抗体免疫沉淀来自用STX17-WT、STX17-Y2F和STX17-Y2E突变体转染的sg PTPN1细胞的细胞培养物的裂解物,并进行蛋白质印迹分析。
图3f:条形图显示相对于STX17-WT,STX17-Y2F和STX17-Y2E中VAMP8和SNAP29倍数变化的量化。
这些结果表明PTP1B对STX17 的去磷酸化阻碍了STX17-SNAP29-VAMP8 SNARE复合物和自噬体-溶酶体融合的形成。
4. PTP1B决定溶酶体降解途径向分泌性自噬途径的转变
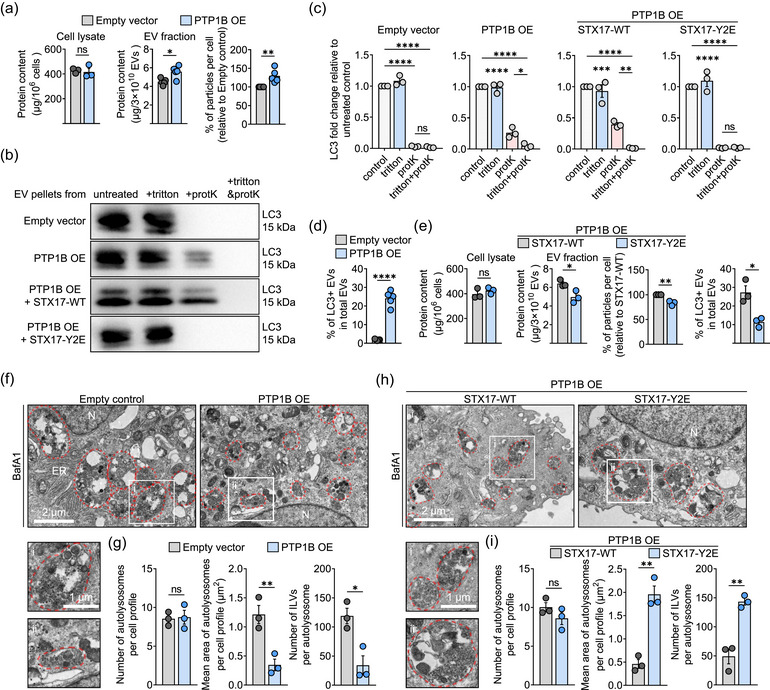
图4 PTP1B决定从溶酶体降解到分泌性自噬途径的转换
图4a:使用BCA测定确定PTP1B OE细胞的细胞裂解物和EVs级分的左图和中图的定量蛋白质含量。右图定量显示了单个PTP1B OE细胞相对于空载体转染细胞的颗粒浓度。
图4b:在不存在或存在0.2% triton的情况下用蛋白酶K处理来自所示细胞的EVs托盘。所示为LC3存在的代表性印迹。
图4c:相对于(b)中未经处理的样品对照的LC3倍数变化的定量分析。
图4d:使用NTA和流式细胞仪测定从空对照和PTP1B OE细胞中提取的总EVs中LC3+EVs 比例的百分比 (%)。
图4e:左图和中左图,来自用STX17-WT和STX17-Y2E突变体转染的PTP1B OE细胞的细胞裂解物和EVs级分的定量蛋白质含量。右中,定量显示来自STX17-Y2E细胞的颗粒相对于用 STX17-WT转染的细胞的浓度。右图是来自STX17-WT和STX17-Y2E细胞的 LC3+ EVs 占总EVs的百分比(%)。
图4f:顶部,PTP1B OE细胞和空载体对照细胞的代表性TEM图像。左下角描绘了单个自溶酶体的示例(对应于顶部图像中的i和ii)。
图4g:定量显示PTP1B OE细胞和空载体对照细胞中每个细胞轮廓的自溶酶体数量、单个自溶酶体的平均面积以及自溶酶体内部的ILV数量。
图4h:顶部,用STX17-WT和STX17-Y2E突变体转染的PTP1B OE细胞的代表性TEM图像。左下角描绘了单个自溶酶体的示例(对应于顶部图像中的i和ii)。
图4i:定量显示用STX17-WT和STX17-Y2E突变体转染的PTP1B OE细胞中每个细胞轮廓的自溶酶体数量、单个自溶酶体的平均面积以及自溶酶体内部的ILV数量。
这些结果表明PTP1B对STX17的去磷酸化可作为分泌性自噬途径的激活剂,PTP1B水平升高控制着从自溶酶体降解到分泌性自噬途径的转变。
5. 分泌性自噬途径的成骨细胞LC3+ EVs启动早期矿化,成骨骨转移微环境中存在LC3+EVs
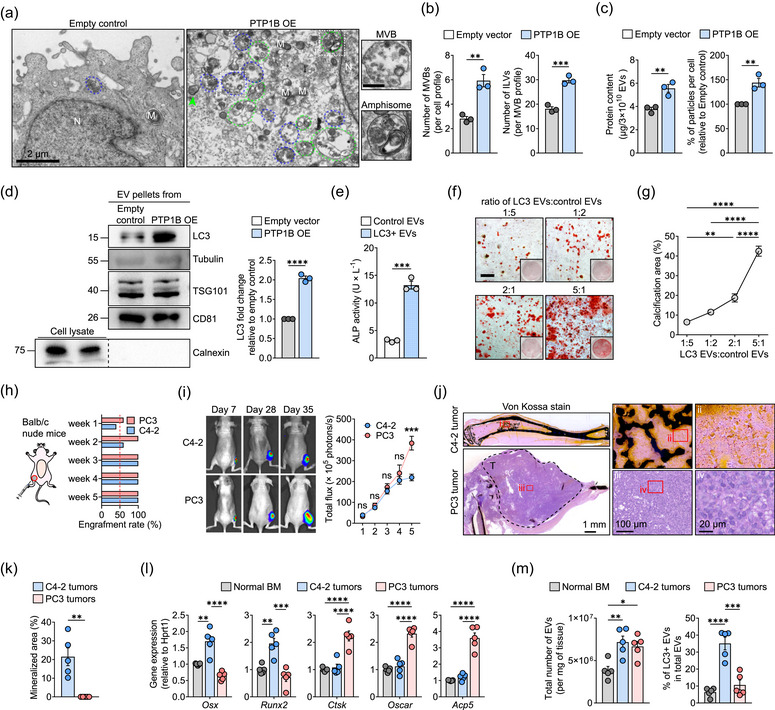
图5 来自分泌性自噬途径的成骨细胞LC3+EVs启动早期矿化
图5a:空对照和PTP1B OE MC3T3-E1细胞的代表性TEM图像。
图5b:定量显示 ( a )中每个细胞轮廓的MVB数量和每个MVB轮廓的ILV数量。
图5c:左图,来自PTP1B OE MC3T3-E1细胞的EVs级分的定量蛋白质含量。右侧,定量显示了PTP1B OE MC3T3-E1细胞相对于空对照MC3T3-E1细胞的颗粒浓度。
图5d:从PTP1B过表达细胞中收集EVs样本。左图进行了蛋白质印迹分析,检查LC3、微管蛋白、TSG101、CD81和Calnexin。右图,相对于空对照细胞的LC3倍数变化的定量分析。
图5e:从PTP1B OE MC3T3-E1细胞中分离LC3+EVs,并测定ALP活性。
图5f:与 3 × 10 8混合EVs一起培养10天成骨诱导的MC3T3-E1细胞的代表性ARS染色图像。
图5g:定量显示(f)中钙化区域的百分比(%)。
图5h:左图,胫骨内接种肿瘤细胞的示意图。右图是该小鼠模型中C4-2和PC3细胞系的植入率。
图5i:左图是接种C4-2和PC3 后7、28和35天的小鼠的代表性生物发光图像。右图通过生物发光成像定量显示了移植的C4-2和PC3肿瘤的荧光素酶强度。
图5j:接种C4-2和PC3 28天的小鼠胫骨的代表性Von Kossa染色图像。描绘了C4-2肿瘤骨髓微环境中成骨性病变的例子,而PC3肿瘤不表现出成骨性病变的表型(对应于左图中的 i 和 iii)。描绘了位于细胞外基质中的钙化结节的示例(对应于左图中的 ii 和 iv)。
图5k:定量显示(j)中成骨病变内矿化区域的百分比(%)。
图5l:RT-qPCR分析显示接种后28天C4和PC3肿瘤中成骨标志物(Osx、Runx2)和破骨细胞相关基因(Ctsk、Oscar、Acp5)的mRNA水平。
图5m:左图定量显示了C4-2和PC3肿瘤中的EVs分布。接种后28天对小鼠实施an乐死,然后收获肿瘤并分析每毫克组织的EVs积累。使用Balb/c裸鼠的正常骨髓作为对照。右图是从 C4-2 和 PC3 肿瘤中提取的 LC3+ EVs 占总EVs的百分比 (%)。
图5a-d结果表明 PTP1B 过表达有效触发MC3T3-E1细胞中的分泌性自噬;图5e-g的数据证明了通过PTP1B介导的分泌性自噬途径产生的成骨细胞LC3+EVs具有启动矿化的能力。图5h-m研究结果表明LC3+EVs在成骨骨转移微环境中特定存在。
6. 肿瘤EVs诱导成骨细胞产生LC3+EVs
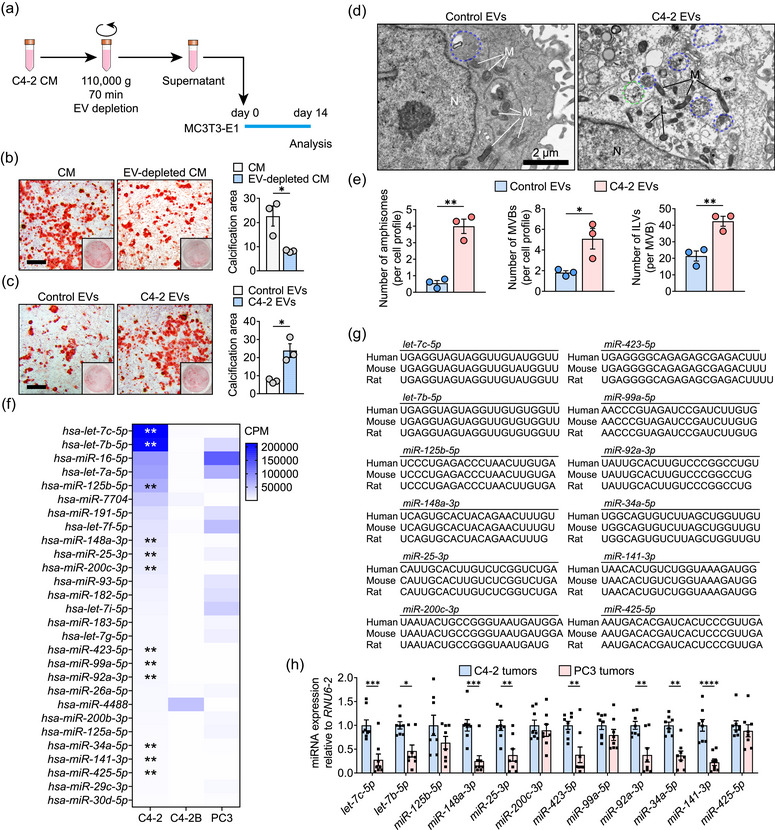
图6 肿瘤EVs诱导成骨细胞产生LC3+ EVs
图6a:示意图显示MC3T3-E1细胞在14天的成骨诱导期间与EVs耗尽的C4-2 CM一起培养。
图6b:左图,在不存在或存在EVs的情况下与C4-2 CM一起培养的MC3T3-E1细胞的代表性 ARS 染色图像。右图,钙化面积的百分比 (%) 被量化。
图6c:左图,用 3 × 10 8 C4-2 EVs培养的MC3T3-E1细胞的代表性ARS染色图像。右图,钙化面积的百分比 (%) 被量化。
图6d:使用 3 × 10 8 C4-2 EVs培养的MC3T3-E1细胞的代表性TEM图像。
图6e:定量显示了每个细胞轮廓的两性体和MVB数量,以及(d)中每个MVB轮廓的ILV 数量。
图6f:热图显示了C4-2 EVs中表达量最高的28个microRNA。
图6h:接种后28天检测C4-2和PC3肿瘤中12个microRNA的表达水平。
结果表明,来自C4-2的细胞外囊泡(EVs)可以诱导成骨谱系细胞的分泌性自噬,并促进其产生LC3+ EVs。
7. 肿瘤RAB27A表达的消除或成骨细胞PTPN1敲低减少肿瘤相关骨重塑
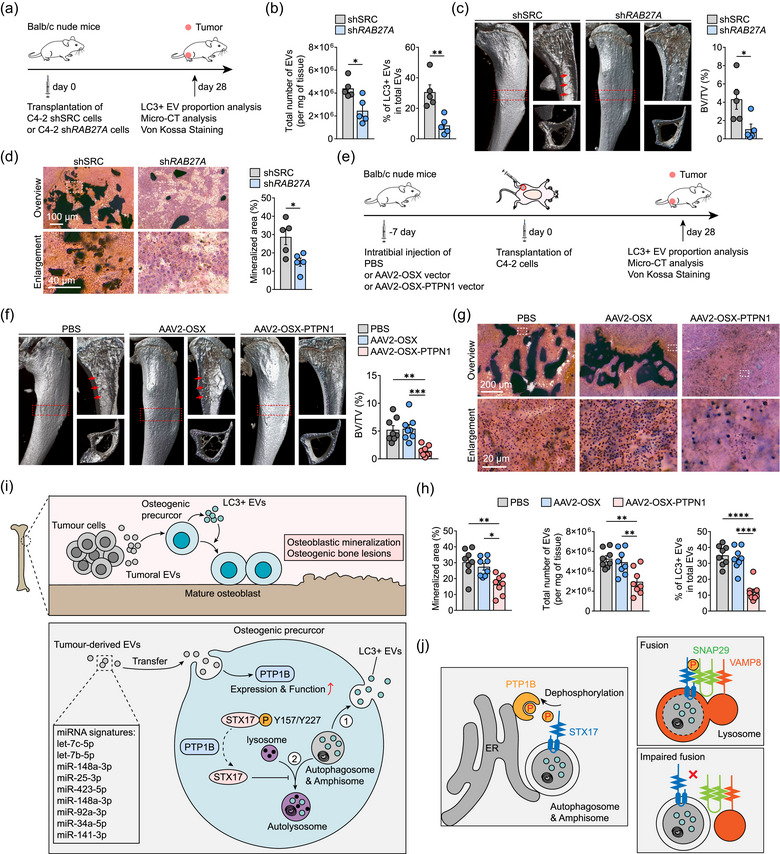
图7 肿瘤RAB27A表达的消除或成骨细胞PTPN1敲低可减少肿瘤相关的骨重塑
图7a:产生携带sh RAB27A C4-2人前列腺癌细胞异种移植物的小鼠的示意图。接种后 28 天对小鼠实施an乐死,以评估 LC3+ EVs和成骨病变的比例。
图7b:左图,定量显示shSRC和sh RAB27A C4-2肿瘤中的EVs分布。对小鼠实施an乐死,并收获肿瘤以分析每毫克组织的EVs积累。右图是从shSRC和sh RAB27A C4-2肿瘤中提取的LC3+ EVs占总EVs的百分比 (%) 。
图7c:左图,接种shSRC和sh RAB27A C4-2细胞28天的胫骨的代表性显微CT图像。右图,感兴趣区域的骨小梁体积分数(BV/TV)的量化(由左图中的红色虚线框表示)。
图7d:左图为接种shSRC和sh RAB27A的小鼠胫骨的、C4-2细胞的代表性Von Kossa染色图像28 天。右图,对成骨病变内矿化区域的百分比(%)进行了量化。
图7e:AAV2病毒敲低成骨细胞特异性PTPN1的实验程序。
图7f:左图,用AAV2-OSX -PTPN1、AAV2-OSX和PBS处理的小鼠胫骨的代表性显微CT 图像。右图,骨小梁体积分数 (BV/TV) 的量化
图7g:用AAV2-OSX-PTPN1处理的小鼠胫骨的代表性Von Kossa染色图像、AAV2-OSX和 PBS。
图7h:左侧,量化显示(e)中成骨病变内矿化区域的百分比 (%) 。中间,定量显示指定组小鼠肿瘤中的EVs分布。右图为从指定组小鼠肿瘤中提取的总EVs中LC3+EVs比例的百分比 (%)。
图7i:目前的成骨肿瘤细胞模型证明了总结肿瘤相关骨重塑中心原则的模型。
图7j:阐明PTP1B控制的STX17去磷酸化和STX17-SNAP29-VAMP8 SNARE复合物形成的模型。
这些结果表明,肿瘤相关的骨重塑不仅仅受骨转移微环境中LC3+EVs产生总量的控制。相反,成骨细胞PTPN1可以特异性增强分泌性自噬途径,该过程由骨转移微环境中的肿瘤EVs启动。
结论
该研究结果揭示了肿瘤调节的PTP1B在自噬体命运决定中的意义,并提出了LC3+EVs在塑造骨转移生态位中的作用。






