研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
创新发文+1!11+工程化外泌体的新启发,想在国自然热点中脱颖而出,有技术更要有新招~
633 人阅读发布时间:2025-02-28 14:47
嵌合抗原受体(CAR)-T细胞疗法彻底改变了造血系统恶性肿瘤的治疗方式。然而,它们在治疗实体癌方面的疗效却令人存疑。实体癌中有效CAR-T细胞治疗的主要障碍包括CAR-T细胞向肿瘤的浸润有限、不利的肿瘤微环境(TME)以及T细胞衰竭。此外,与血液系统恶性肿瘤不同(其中癌细胞通常表达特定的表面标志物),实体瘤表达肿瘤相关抗原,而这些抗原在正常组织中的表达水平较低。靶向肿瘤但产生脱靶毒性的风险很高,Her2-CART细胞和GD2-CART细胞临床试验中的灾难性毒性就说明了这一点。对于实体瘤,明显存在对更好的细胞疗法未被满足的临床需求。
细胞外囊泡(sEVs)是纳米级的囊泡,在体液中相对稳定,能够穿越生物屏障到达特定部位。sEVs具有其亲代细胞的许多特征,并表现出出色的生物相容性。来自细胞毒性免疫细胞的sEVs会将穿孔素、溶菌酶和其他细胞毒性分子携带至癌细胞。然而,未修饰的免疫细胞来源的sEVs缺乏肿瘤靶向能力。CAR-T细胞释放的sEVs表面具有CAR,并且在临床前模型中已显示出对某些癌症有良好的靶向和治疗效果。

湾湾今天分享的是发表在【ScienceAdvances】(IF:11.7)上题为“EngineeredextracellularvesicleswithDR5agonisticscFvssimultaneouslytargettumorandimmunosuppressivestromalcells”的研究,该研究在源自自然杀伤细胞的sEVs表面构建了DR5激动性单链可变片段(scFvs)的表达。血小板衍生生长因子受体跨膜结构域将DR5-scFvs传递到sEVs表面。DR5-scFvsEVs能迅速诱导不同类型的DR5+癌细胞、髓源性抑制细胞(MDSCs)和癌症相关成纤维细胞(CAFs)的凋亡。DR5-scFvsEVs在体外和体内都能特异性迁移到DR5+肿瘤。全身性给予DR5-scFvsEVs显著抑制DR5+黑色素瘤、肝癌和乳腺癌的生长,延长小鼠寿命,且无明显毒性。在体内,DR5-scFvsEVs比DR5抗体更有效。在器官型患者来源的黑色素瘤切片培养中,DR5-scFvsEVs能有效抑制黑色素瘤细胞和MDSCs,并激活CD8+T细胞。该研究表明,DR5-scFvsEVs可通过靶向肿瘤微环境(TME)中的肿瘤细胞和免疫抑制基质细胞来抑制肿瘤生长。
研究结果
1.DR5-scFvs诱导DR5+肿瘤细胞凋亡
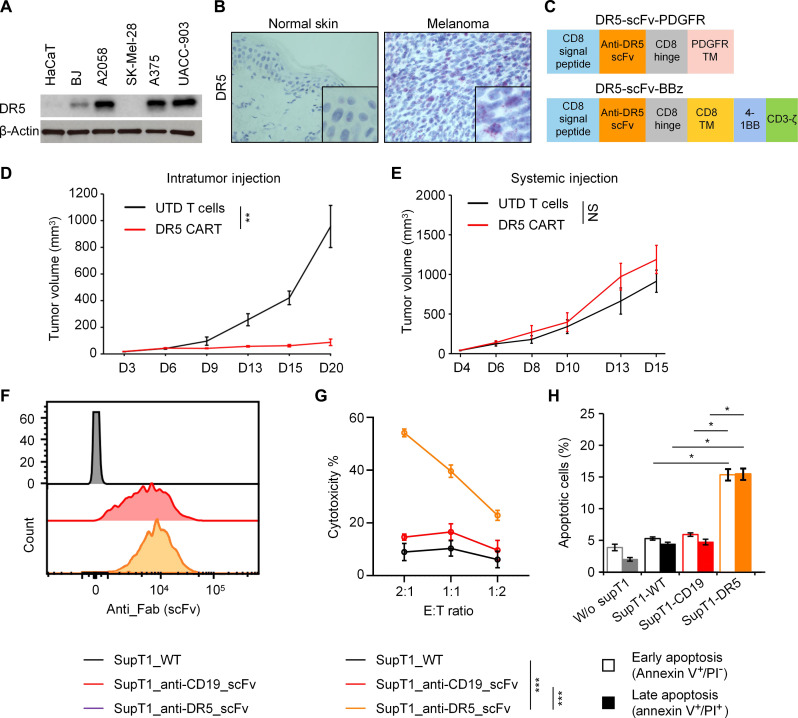
图1A:不同细胞类型中DR5的表达。从不同细胞中提取蛋白质,并使用抗DR5抗体进行westernblo t分析。
图1B:DR5在黑色素瘤细胞中高表达。使用原位杂交检测正常皮肤(左图)和黑色素瘤(右图)中DR5mRNA的表达。
图1C:DR5–4-1BBzCAR和DR5-PDGFR慢病毒载体的示意图。
图1D-E:DR5CAR-T细胞在体内对肿瘤的影响。通过将A375细胞皮下注射到裸鼠右侧腹部建立黑色素瘤异种移植模型(n=5)。未转染的T(UTD)细胞或DR5-scFvCAR-T细胞(每次注射2.5×10^6个)通过瘤内注射(D)或尾静脉注射(E)注入小鼠体内。
图1F:转染的SupT1细胞中CARscFv的表达。用CD19-CAR或DR5-CAR慢病毒载体转染SupT1细胞。使用流式细胞术检测SupT1细胞中CD19-scFvs或DR5-scFv的表达。
图1G:DR5-CARSupT1细胞或CD19-CARSupT1细胞对A375细胞的荧光素酶杀伤测定。将A375细胞用DR5-CARSupT1细胞或CD19-CARSupT1细胞以指定的效应细胞与靶细胞比例(E:T比例)处理。
图1H:DR5-CARSupT1细胞诱导A375细胞凋亡。用野生型(WT)、CD19-CAR或DR5-CAR转染的SupT1细胞处理的A375细胞进行膜联蛋白V-异硫氰酸荧光素(FITC)/PI染色。
以上结果表明,DR5激动性scFvs对靶细胞有直接的细胞毒性。
2.PDGFR-TM增加了sEVs中DR5-scFvs的表面表达
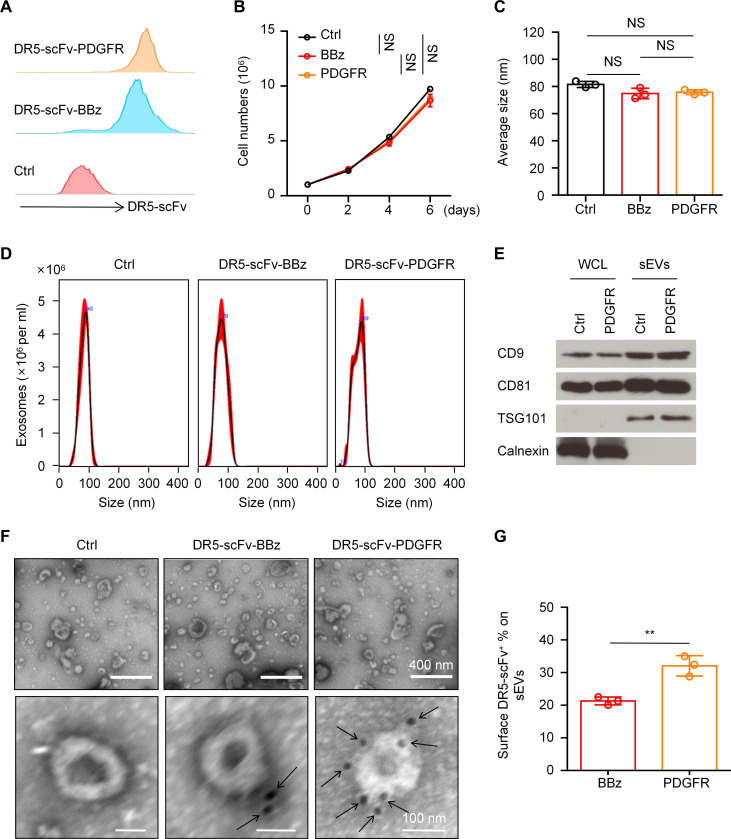
图2A:NK92细胞中DR5-scFv的表达。用DR5–4-1BBz或DR5-PDGFR慢病毒载体转染NK92细胞。对DR5-scFv阳性细胞进行分选和培养。使用流式细胞术分析NK92细胞中DR5-scFv的表达。
图2B:不同载体转染不影响NK92细胞的增殖。在指定时间点计数对照组、DR5-BBz-NK92和DR5-PDGFR-NK92细胞的数量。
图2C-D:使用NanoSightNS300对sEVs进行纳米颗粒跟踪分析。来自对照组、DR5–4-1BBz–NK92或DR5-PDGFR-NK92细胞的sEVs大小分布的代表性图像和柱状图。
图2E:Westernblot检测NK92细胞全细胞裂解液(WCL)和NK92细胞来源的sEVs中的sEV标志物CD9、CD81、TSG101和内质网标志物钙连蛋白。
图2F:工程化sEVs的TEM图像。用抗DR5-scFvs的金结合抗体标记sEVs。
图2G:不同类型NK92来源的sEVs的磁珠流式细胞术分析。柱状图显示了不同组中DR5-scFv阳性sEVs的百分比。
以上结果表明,在将DR5-scFv传递到sEVs表面方面,PDGFR跨膜结构域优于CD8跨膜结构域。
3.DR5-scFvsEVs以剂量和DR5表达依赖的方式对肿瘤细胞表现出细胞毒性
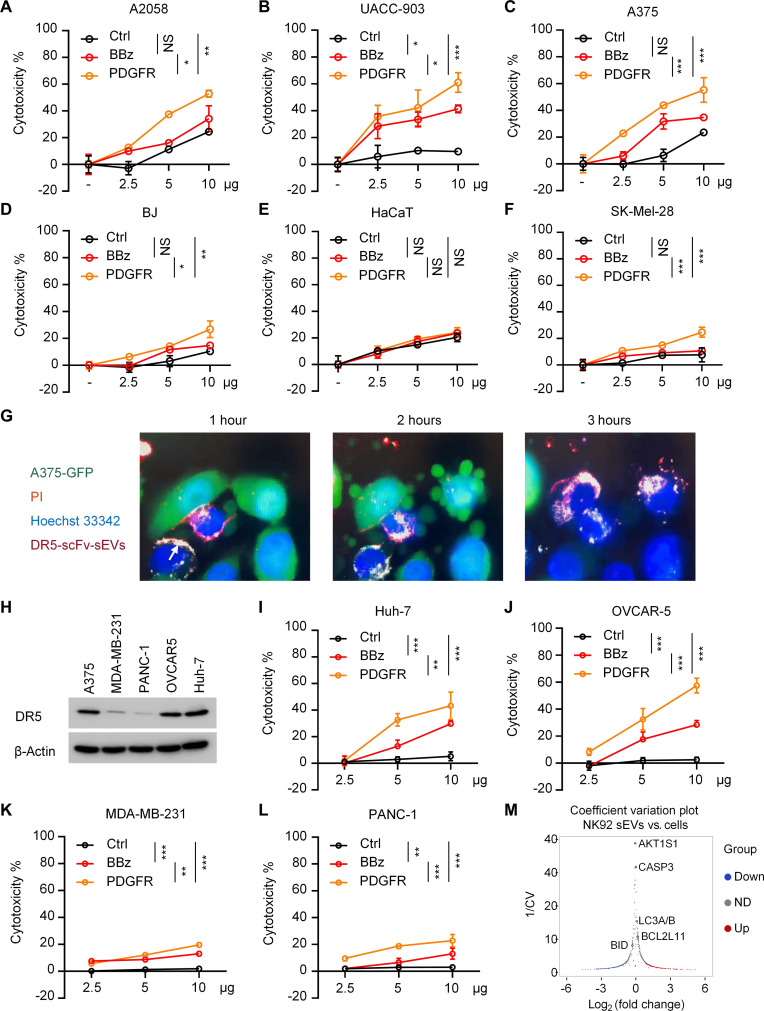
图3A-F:DR5-scFvsEVs在不同细胞中的荧光素酶杀伤测定。用对照、DR5-BBz和DR5-PDGFR-NK92细胞来源的0、2.5、5或10μg的EVs处理A2058(A)、UACC-903(B)、A375-WT(人黑色素瘤细胞系)(C)、BJ(人成纤维细胞系)(D)、HaCaT(人角质形成细胞系)(E)和SK-Mel-28(人黑色素瘤细胞系)(F)。
图3G:用DR5-scFvsEVs处理的A375-GFP细胞的代表性图像。A375-GFP细胞(绿色)用DR5-scFvsEVs(深红色)处理3小时。这些细胞用PI(红色)和Hoechst33342(蓝色)染色。在指定时间点拍摄图像。
图3H:不同上皮癌细胞系中DR5的表达。从不同细胞中提取蛋白质,并使用抗DR5抗体进行westernblot分析。
图3I-L:DR5-scFvsEVs在不同癌细胞中的荧光素酶杀伤测定。用对照、DR5–4-1BBz和DR5-PDGFR-NK92细胞来源的0、2.5、5或10μg的sEVs处理Huh-7(人肝癌细胞)(I)、OVCAR-5(人卵巢癌细胞)(J)、MDA-MB-231(人乳腺癌细胞)(K)和PANC-1(人胰腺癌细胞系)(L),并进行荧光素酶测定。
图3M:NK92细胞和NK92-sEVs中蛋白质的变异系数图。使用491种抗体进行RPPA。
4.DR5-scFvsEVs对高DR5表达的黑色素瘤细胞具有特异性
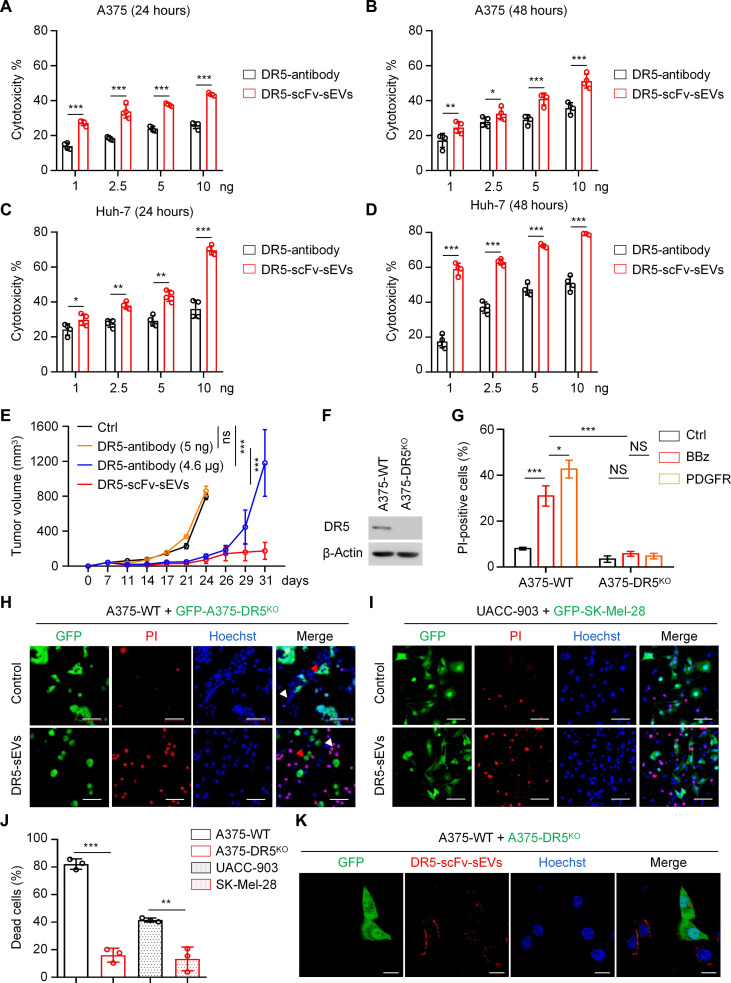
图4A-D:在A375和Huh-7细胞中使用tigatuzumab和DR5-scFvsEVs进行的荧光素酶杀伤测定。用等量的DR5抗体分子或sEVs中的DR5-scFvs处理A375(A、B)和Huh-7(C、D)细胞。
图4E:通过尾静脉向裸鼠注射低剂量DR5抗体(5ng)、高剂量DR5抗体(4.6μg)或DR5-scFvsEVs(每只小鼠100μg)。每周治疗两次。在指定时间点测量肿瘤体积。
图4F:对A375-DR5WT和A375-DR5KO细胞的蛋白质进行westernblot分析。使用CRISPR/Cas9敲除了A375中的DR5。
图4G:DR5-scFvsEVs诱导黑色素瘤细胞凋亡。用指定的sEVs处理A375-DR5WT和A375-DR5KO细胞24小时,并用PI染色。柱状图显示了PI阳性黑色素瘤细胞的百分比。
图4H-J:DR5-scFvsEVs在高DR5表达细胞中诱导的凋亡多于低DR5表达细胞。将A375-DR5WT(无GFP标签)和A375-DR5KO(有GFP标签)细胞(H),或UACC-903(无GFP标签)和SK-Mel-28(有GFP标签)细胞(I)混合,并与10μg的DR5-scFvsEVs或对照sEVs孵育24小时。进行PI(红色)和Hoechst33342(蓝色)染色。
图4J:死亡细胞百分比的柱状图。
图4K:DR5-scFvsEVs优先结合DR5野生型细胞。用深红色染料(红色)标记DR5-scFvsEVs。将A375-DR5WT(无GFP标签)和A375-DR5KO(有GFP标签)细胞与预先染色的DR5-scFvsEVs孵育2小时。拍摄A375细胞摄取DR5-scFvsEVs的代表性图像。
以上结果表明,在控制肿瘤生长方面,DR5-scFvsEVs比DR5单克隆抗体具有优势。
5.DR5-scFvsEVs迁移至DR5+黑色素瘤并在体内抑制肿瘤生长
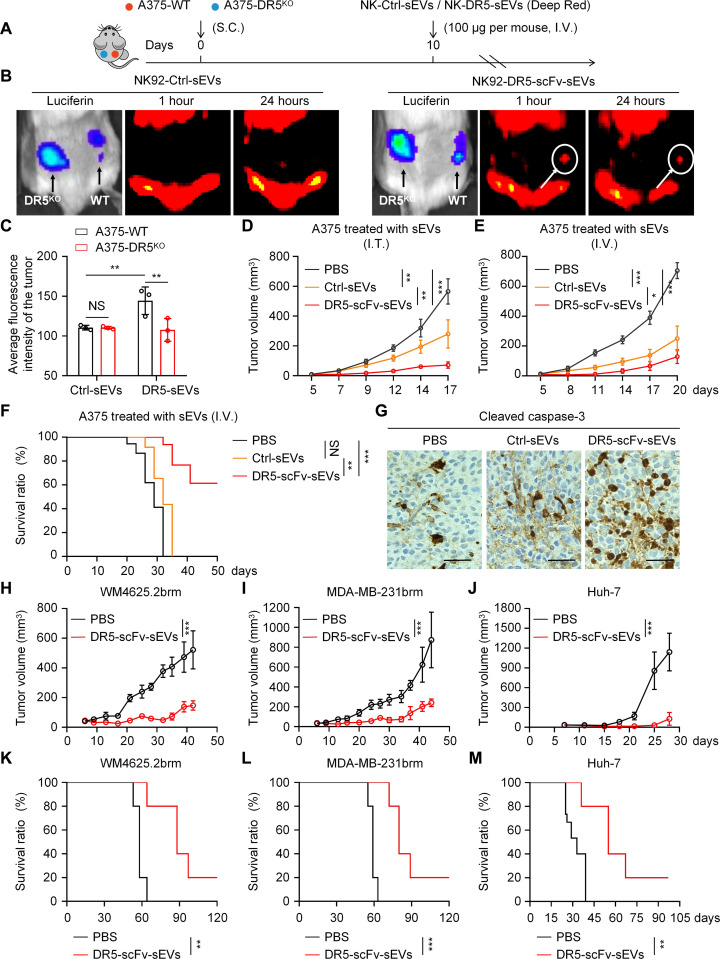
图5A:通过将A375-DR5WT细胞皮下注射到NSG小鼠的右侧腹部,将A375-DR5KO细胞注射到左侧腹部来建立黑色素瘤异种移植小鼠模型。在指定时间通过尾静脉向小鼠注射预先染色的对照sEVs或DR5-scFvsEVs(每只小鼠100μg,红色)。
图5B:在指定时间点肿瘤和标记的sEVs的代表性图像。使用荧光素对肿瘤进行成像。
图5C:不同组的平均荧光强度柱状图。
图5D-G:DR5-scFvsEVs在体内抑制黑色素瘤肿瘤生长。向小鼠瘤内(D)或通过尾静脉(E-G)注射DR5-scFvsEVs(每只小鼠100μg)或等量的PBS。(D-E)在指定时间点测量肿瘤体积。(F)三组小鼠的Kaplan-Meier生存曲线。(G)DR5-scFvsEVs诱导黑色素瘤细胞凋亡。
图5H-M:DR5-scFvsEVs在体内抑制多种不同类型的肿瘤生长。通过将WM4625.2brm、MDA-MB-231brm或Huh-7细胞皮下注射到裸鼠的右侧腹部来建立异种移植小鼠模型。通过尾静脉(静脉内)向小鼠注射DR5-scFvsEVs(每只小鼠100μg)或等量的PBS。在指定时间测量肿瘤体积。(K-M)不同组荷瘤小鼠的Kaplan-Meier生存曲线。
以上结果表明,DR5-scFvsEVs在体内优先迁移到DR5+肿瘤细胞,并且肿瘤微环境(TME)不会阻止sEVs的进入。此外,DR5-scFvsEVs显著抑制了这些肿瘤的生长并延长了治疗小鼠的存活时间。
6.DR5-scFvsEVs靶向黑色素瘤中的MDSCs和CAFs
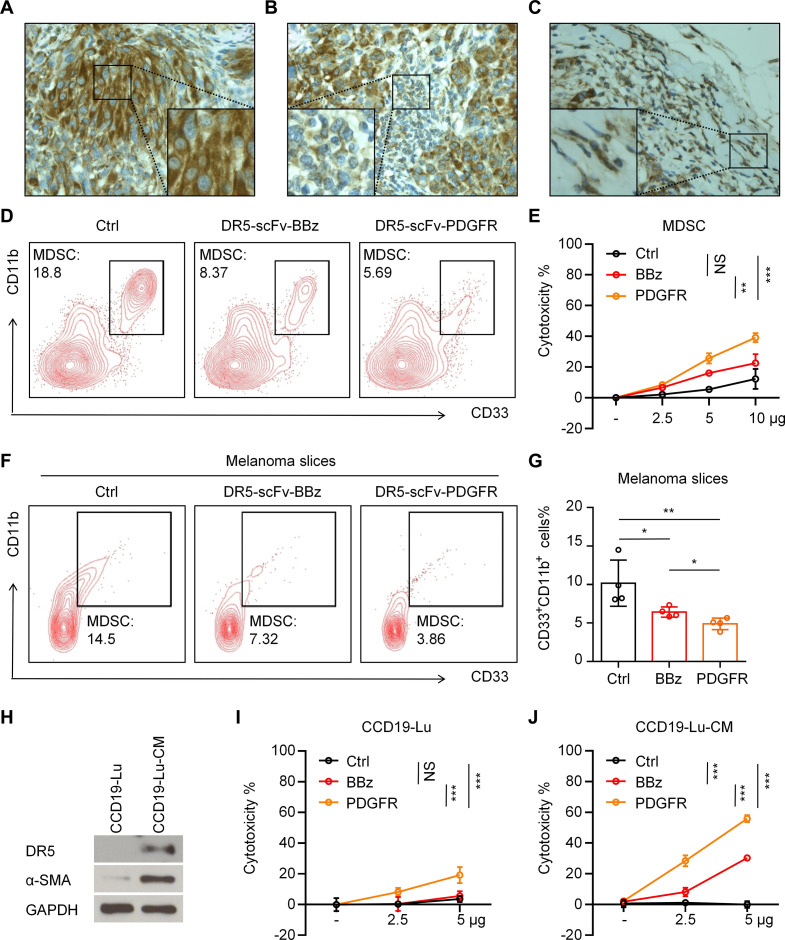
图6A-C:通过免疫组织化学检测发现,在黑色素瘤患者组织中,DR5在黑色素瘤细胞(A)、MDSCs(B)和CAFs(C)中高表达。
图6D-E:DR5-scFvsEVs对MDSCs表现出细胞毒性。通过GM-CSF和IL-6诱导MDSCs,并使用指定的sEVs处理24小时。(D)流式细胞术图显示了不同组中CD33+CD11b+细胞的百分比。(E)指定sEVs对MDSCs的杀伤测定。
图6F-G:DR5-scFvsEVs在器官型患者来源的黑色素瘤组织切片中杀死MDSCs。获得黑色素瘤的组织切片并用sEVs处理。显示了CD33+CD11b+MDSC的流式细胞术图(F)和不同组中CD33+CD11b+活细胞百分比的柱状图(G)
图6H:在由CCD19-Lu细胞诱导的CAFs中,DR5高表达。生成人工诱导的CAFs。从细胞中提取蛋白质,并使用抗DR5抗体进行免疫印迹分析。β-肌动蛋白用作对照。
图6I-J:使用DR5-scFvsEVs的CAF杀伤测定。对照CCD19-Lu细胞(I)和诱导的CAFs(J)用对照、DR5-BBz-NK92和DR5-PDGFR-NK92细胞来源的0、2.5、5或10μg的sEVs处理。
以上结果表明,DR5-scFvsEVs对MDSCs和CAFs具有细胞毒性。
7.DR5-scFvsEVs重编程黑色素瘤中的肿瘤微环境
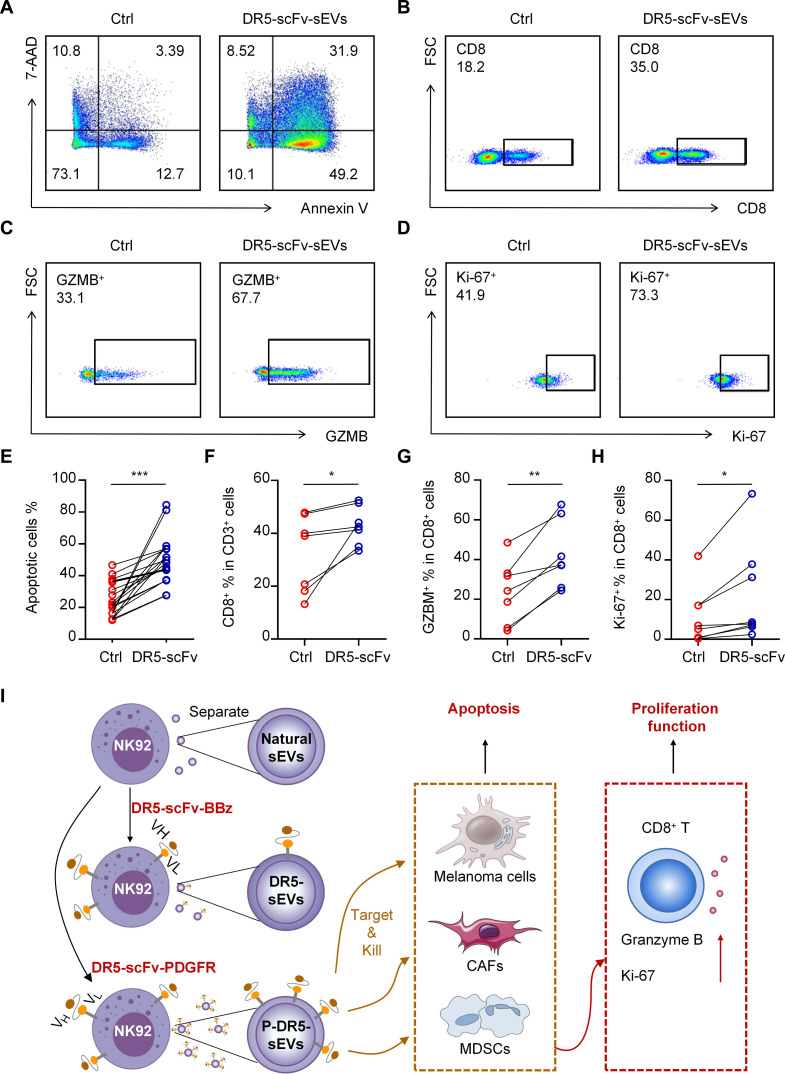
图7A:DR5-scFvsEVs诱导黑色素瘤组织切片中的细胞凋亡。对sEV处理的肿瘤切片进行膜联蛋白V凋亡测定。展示了对照或DR5-scFvsEV处理的黑色素瘤切片中凋亡细胞的代表性流式细胞术图。
图7B-D:DR5-scFvsEVs增强患者来源的黑色素瘤组织切片中CD8+T细胞的功能。CD3+细胞中CD8+T细胞百分比(B)、CD8+T细胞中颗粒酶B(C)和Ki-67(D)百分比的代表性流式细胞术图。
图7E:来自八位患者的不同黑色素瘤切片中凋亡细胞的柱状图。
图7F-H:不同组中CD3+细胞中CD8+T细胞百分比(F)、CD8+T细胞中颗粒酶B(G)和Ki-67(H)百分比的柱状图。
图7I:DR5-scFvsEVs重编程肿瘤微环境的示意图,其可能被开发为一种新型癌症疗法。
结论
综上,该研究开发了表达高水平DR5-scFvs的工程化sEVs。这些武装的sEVs特异性地靶向DR5+肿瘤细胞、MDSCs和CAFs。对这些细胞的抑制减轻了免疫抑制性肿瘤微环境,使其他免疫细胞。本研究的结果表明,工程化的DR5-scFvsEVs代表了一种有前途的癌症免疫治疗策略。有可能用不同的scFvs来武装sEVs以靶向各种癌症,使其成为一种通用的现成平台技术,可适用于治疗实体癌。






