研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:10+,生物细胞学前沿大瓜!桔梗外泌体成急性肺损伤治疗“潜力股”?快来一探究竟!
1155 人阅读发布时间:2025-04-10 09:28
急性肺损伤(ALI)是一种严重的呼吸系统疾病,死亡率高达40%,目前全球尚无有效临床治疗方法。新鲜药用植物在治疗炎症性疾病方面比干燥形式更具疗效,桔梗(PG)作为经典中药材,在治疗肺部疾病方面有悠久历史,但以往对其新鲜形式的研究较少。纳米技术在生物医学领域的应用备受关注,植物来源的外泌体样纳米颗粒(如桔梗外泌体样纳米颗粒,PGLNs)有望为探索新鲜草药的物质基础和机制提供方向。

今天分享的是发表在【J Nanobiotechnology】(IF:10.6)上题为“Platycodon grandiflorum exosome-like nanoparticles: the material basis of fresh platycodon grandiflorum optimality and its mechanism in regulating acute lung injury”的研究,本研究旨在探讨新鲜PG对ALI小鼠的治疗效果,分析PGLNs的特性、生物相容性及其治疗ALI的机制。
研究结果
1、新鲜PG在减轻LPS诱导的小鼠ALI方面比干燥PG具有更好的治疗效果
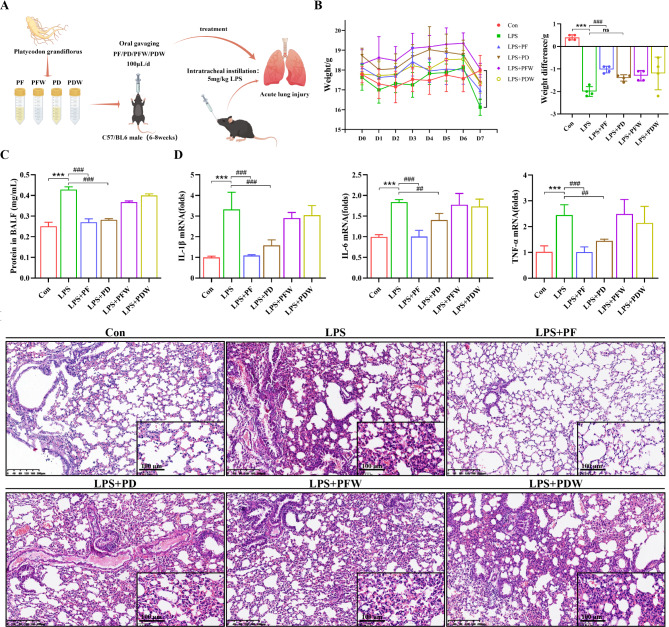
图1A:LPS和PG(PF、PFW、PD、PDW)在ALI模型小鼠中的给药方案。
图1B:显示了各组小鼠在接受PF、PFW、PD和PDW治疗7天内的体重变化。结果表明,LPS干预后小鼠体重显著下降,而新鲜PG(PF)治疗能显著缓解体重下降情况,干燥PG(PD)治疗也有一定改善,但不如PF明显。
图1C:呈现了各组小鼠肺泡灌洗液中的蛋白质浓度。PF和PD治疗均显著降低了LPS诱导的ALI小鼠肺泡灌洗液中的总蛋白含量,说明PG(新鲜或干燥)能有效减轻炎症渗出。
图1D:展示了各组小鼠肺组织中IL-1β、IL-6和TNF-α的mRNA水平。PF和PD治疗均显著降低了这些促炎因子的mRNA表达水平。
图1E:为各组小鼠肺切片的HE染色结果。LPS刺激导致肺泡壁增厚、肺间质水肿、肺泡出血、肺泡腔塌陷和大量炎症细胞浸润;PF治疗显著改善了肺组织结构和炎症细胞浸润,PD治疗虽有改善,但仍可见肺泡出血、间质水肿等炎症损伤。
这些结果表明,新鲜或干燥的PG干预均可显著修复LPS刺激后的肺炎症损伤,改善肺病理变化,且新鲜PG的治疗效果更好。
2、PGLNs的分离和表征
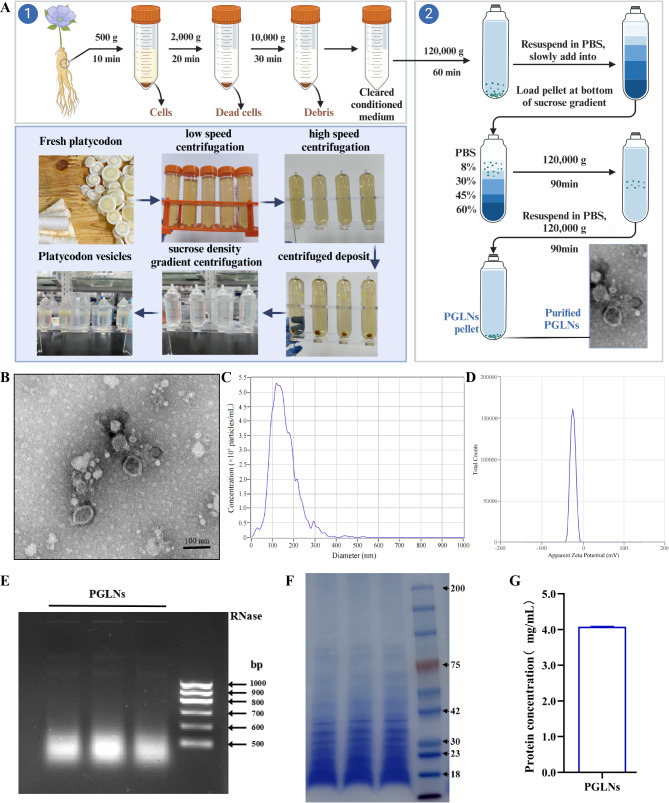
图2A:展示了通过差速离心和蔗糖密度梯度离心制备PGLNs的过程。
图2B:透射电镜(TEM)图像显示,PGLNs呈圆形或椭圆形囊泡,具有双层膜结构,平均直径为90nm,符合外泌体样纳米颗粒的一般特征。
图2C:纳米颗粒跟踪分析(NTA)检测结果显示,PGLNs的平均粒径分布为141.2nm,颗粒含量较高(平均为1.4×10⁸particles/mL)。
图2D:PGLNs的Zeta电位为-23.5mV,表明其具有良好的稳定性和分散性。
图2E:琼脂糖凝胶电泳检测结果显示,PGLNs含有核酸相关物质。
图2F:SDS-PAGE和考马斯亮蓝染色检测结果表明,PGLNs含有蛋白质相关物质。
图2G:BCA法测定PGLNs的蛋白质浓度结果显示,新鲜PGLNs的浓度约为4.0mg/mL,每50g新鲜PG可获得1mLPGLNs,产量较高。
这些结果表明,成功分离和纯化出了PGLNs,其具有纳米级尺寸、囊泡样结构,且含有核酸和蛋白质等物质,产量较高。
3、PGLNs的蛋白质组学表征

图3A:直方图展示了PGLNs中检测到的总蛋白数量,共检测到112种蛋白质成分。
图3B:显示了PGLNs中总蛋白的分子量分布,约70%的蛋白质分子量在0-80kDa,约30%大于80kDa。
图3C:展示了PGLNs中总蛋白的亚细胞定位,37种蛋白质位于细胞质,15种位于质膜。
图3D:基于PGLNs蛋白质组学的GO功能分析结果表明,PGLNs含有多种与膜成分相关的蛋白质,参与信号转导和各种代谢途径。
图3E:KEGG分析结果进一步突出了PGLNs的囊泡样特征及其可能的药效物质基础。
这些结果表明,PGLNs含有多种具有不同分子质量和生物学功能的蛋白质,在信号转导和代谢途径中发挥作用,为其潜在的药效提供了物质基础。
4、PGLNs的生物安全性评估
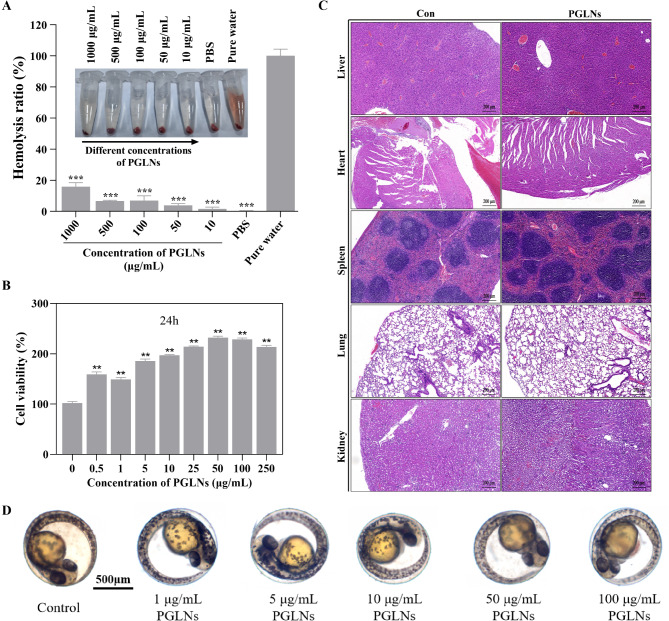
图4A:不同浓度PGLNs(1000、500、100、50、10µg/mL)对红细胞的溶血活性检测结果显示,所有浓度的PGLNs溶血活性均较低,为PGLNs的静脉给药提供了依据。
图4B:细胞活性检测结果表明,RAW264.7细胞在与不同浓度PGLNs孵育24小时后,细胞活性均有所增加,说明PGLNs可促进RAW264.7细胞增殖。
图4C:小鼠肝脏、心脏、脾脏、肺和肾脏组织切片的H&E染色结果显示,PGLNs组与对照组相比,组织形态无明显病理变化,表明PGLNs具有良好的生物安全性。
图4D:不同浓度PGLNs干预斑马鱼受精卵1天后的结果显示,斑马鱼幼虫形态与对照组相比无显著差异,未观察到异常表型,表明PGLNs在测试浓度下无明显毒性。
这些结果表明,PGLNs具有良好的生物相容性,为其作为天然药物制剂的给药提供了安全基础。
5、PGLNs减轻LPS诱导的小鼠ALI,这可能与调节巨噬细胞极化有关

图5A:展示了LPS和PGLNs在ALI小鼠中的给药方案示意图。
图5B:LPS组和LPS+PGLNs组小鼠体重差异结果显示,LPS刺激后小鼠体重显著下降,PGLNs干预后体重下降明显缓解。
图5C:各组小鼠肺组织的宏观图像显示,LPS刺激后肺组织明显充血、水肿,体积增大;PGLNs干预后,肺组织的充血和水肿得到明显改善。
图5D:BCA法检测小鼠肺泡灌洗液中蛋白质浓度结果表明,LPS刺激后肺泡灌洗液中总蛋白含量显著升高,PGLNs干预后明显降低。
图5E:RT-qPCR检测小鼠肺组织中IL-1β、IL-6、TNF-α、IL-10和TGF-β1的mRNA水平结果显示,PGLNs显著下调了促炎因子IL-1β、IL-6和TNF-α的mRNA表达水平,上调了TGF-β1的mRNA表达水平。
图5F:小鼠肺切片的H&E染色结果显示,LPS刺激导致肺组织结构明显紊乱,肺泡壁增厚,肺泡腔狭窄或消失,伴有大量渗出和炎症细胞浸润;PGLNs治疗显著减轻了这些病理变化。
图5G:组织免疫荧光检测小鼠肺组织中M1促炎巨噬细胞标志物CD86的荧光表达结果显示,LPS刺激下CD86荧光强度较高,PGLNs干预后显著降低。
图5H:组织免疫荧光检测小鼠肺组织中M2抗炎巨噬细胞标志物CD206的荧光表达结果显示,LPS刺激下CD206荧光强度较低,PGLNs干预后显著升高。
这些结果表明,PGLNs治疗可修复炎症损伤,改善小鼠肺组织的病理变化,对LPS诱导的小鼠ALI具有保护作用,且这种保护作用可能与调节巨噬细胞极化有关。
6、PGLNs在体外调节巨噬细胞极化
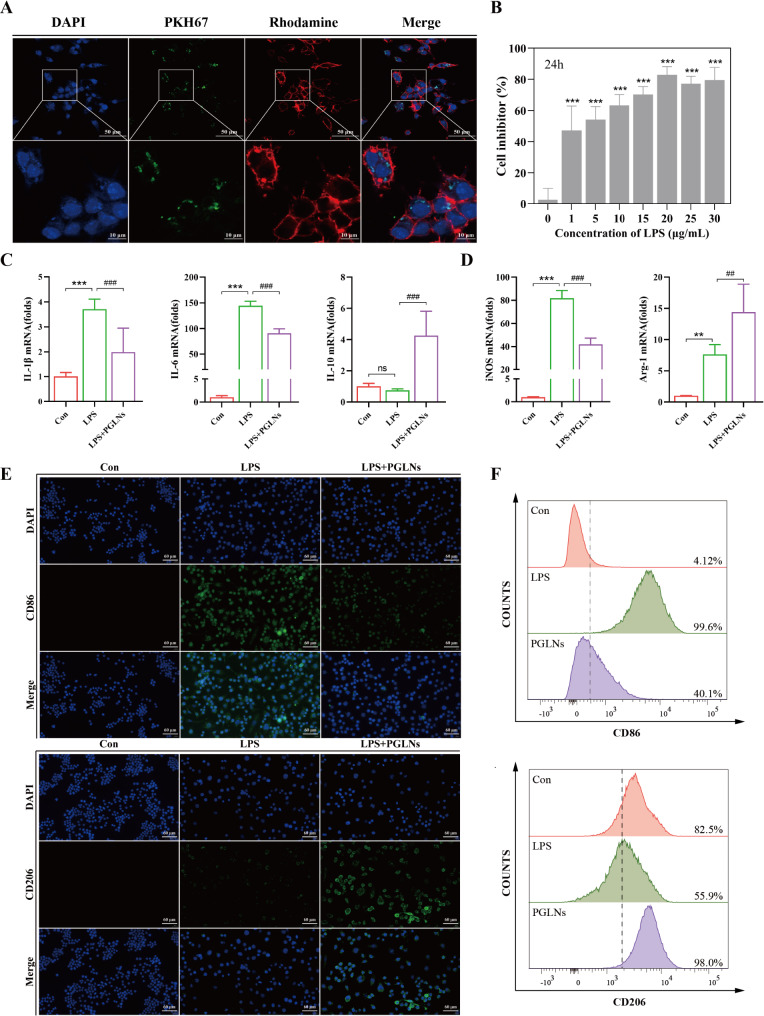
图6A:共聚焦图像显示,PKH67标记的PGLNs与RAW264.7细胞显著共定位,大部分PGLNs荧光位于细胞骨架内,表明RAW264.7细胞可有效摄取PGLNs。
图6B:不同浓度LPS诱导RAW264.7细胞24小时后的活性检测结果显示,LPS不同程度地抑制了RAW264.7细胞的活性,后续实验采用1µg/mLLPS构建炎症细胞模型。
图6C:RT-qPCR检测结果显示,PGLNs显著降低了LPS刺激的细胞模型中促炎因子IL-1β和IL-6的mRNA表达水平,增加了IL-10的mRNA表达水平,表明PGLNs可有效改善LPS诱导的炎症细胞损伤。
图6D:RT-qPCR检测结果显示,PGLNs显著降低了M1促炎细胞标志物iNOS的mRNA表达水平,增加了M2抗炎细胞标志物Arg-1的mRNA表达水平。
图6E:细胞免疫荧光结果显示,LPS刺激下M1促炎细胞标志物CD86的荧光强度显著增强,M2抗炎细胞标志物CD206的荧光强度不明显;PGLNs干预后,荧光强度变化趋势相反。
图6F:流式细胞术分析结果显示,PGLNs可调节RAW264.7细胞的极化,与上述结果趋势一致。
这些结果表明,PGLNs能有效被RAW264.7细胞摄取,并调节细胞极化,抑制炎症反应,改善LPS诱导的炎症细胞损伤。
7、PGLNs影响LPS诱导的RAW264.7细胞的代谢紊乱
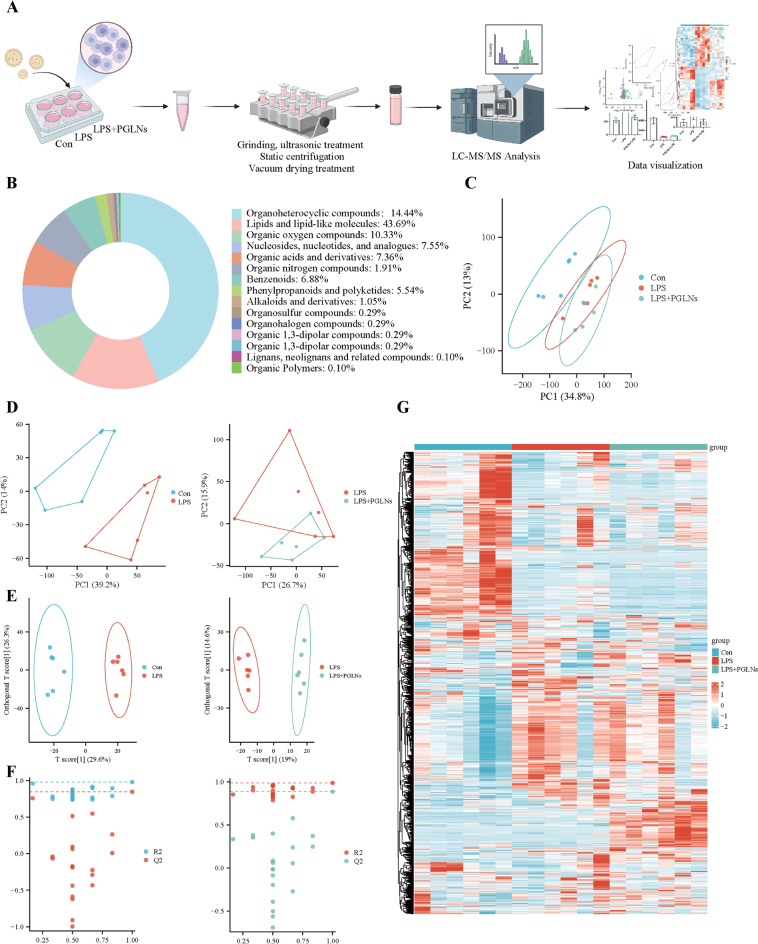
图7A:展示了代谢组学分析的流程示意图。
图7B:通过与代谢组学数据库对比,共鉴定出1588种物质,包括脂质、有机酸、有机杂环化合物等多种类别。
图7C:PCA得分图显示所有样本均分布在95%置信区间内,表明PCA模型可靠,可用于分析样本间的差异。
图7D:PCA得分图显示对照组与LPS组、LPS组与LPS+PGLNs组之间存在明显分离,表明各组代谢存在差异。
图7E:OPLS-DA得分图进一步显示了各组之间的差异,且OPLS-DA置换检验结果(图7F)表明该模型具有良好的拟合度和预测能力。
图7G:聚类分析热图显示,PGLNs干预可影响LPS诱导的RAW264.7细胞的代谢紊乱。
这些结果表明,PGLNs干预能够影响LPS诱导的RAW264.7细胞的代谢紊乱。
8、LPS和LPS+PGLNs处理后RAW264.7细胞中差异代谢物的分析
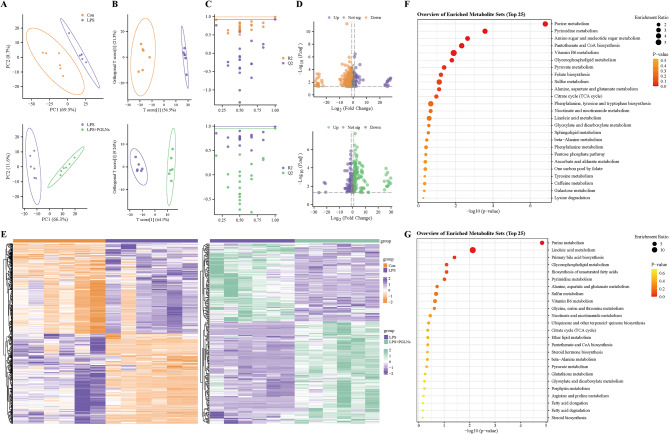
图8A:PCA得分图显示Convs.LPS组和LPSvs.LPS+PGLNs组之间差异显著分离,样本聚类在一起。
图8B:OPLS-DA得分图进一步展示了不同组间差异代谢物的分布情况。
图8C:OPLS-DA置换检验结果表明不同组间差异显著。
图8D:结合P值和代谢物差异幅度可视化了组间代谢物变化的变异性。
图8E:聚类分析热图显示Convs.LPS组和LPSvs.LPS+PGLNs组的代谢物存在显著差异。
图8F:Convs.LPS组差异代谢物KEGG富集因子气泡图显示,LPS发挥作用的机制主要与嘌呤代谢、嘧啶代谢等途径相关。
图8G:LPSvs.LPS+PGLNs组差异代谢物KEGG富集因子气泡图显示,PGLNs调节的差异主要与亚油酸代谢、初级胆汁酸生物合成等途径相关。
这些结果表明,PGLNs通过不同的代谢中间产物调节LPS诱导的RAW264.7细胞的代谢异常。
9、Convs.LPS和LPSvs.LPS+PGLNs的差异代谢物聚类热图

图9A:Convs.LPS组差异代谢物主要富集在生物碱及其衍生物、苯类化合物、核苷、核苷酸及其类似物、有机酸及其衍生物和有机氮化合物等。
图9B:LPSvs.LPS+PGLNs组差异代谢物主要富集在苯类化合物、脂质和类脂分子、核苷、核苷酸及其类似物、有机酸及其衍生物、有机氧化合物和有机杂环化合物等。
这些结果表明,LPS刺激和PGLNs干预导致的RAW264.7细胞代谢物变化存在显著差异,且涉及不同的代谢物类别和代谢途径。
10、PGLNs治疗LPS诱导的RAW264.7细胞炎症的潜在生物标志物
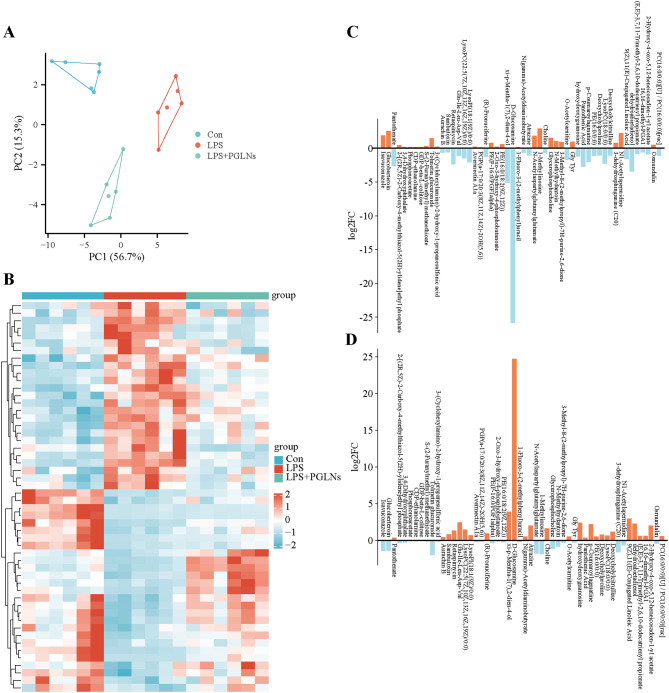
图10A:PCA得分图展示了潜在生物标志物在Con、LPS和LPS+PGLNs组间的分布情况。
图10B:聚类分析热图显示LPS和LPS+PGLNs组间代谢物水平存在显著差异,且LPS+PGLNs组有恢复到Con组水平的趋势。
图10C:Convs.LPS组潜在生物标志物的差异倍数分析结果显示,各代谢物变化情况不同。
图10D:LPSvs.LPS+PGLNs组潜在生物标志物的差异倍数分析结果显示,PGLNs干预后,LPS刺激引起的52种代谢物异常均有不同程度的逆转,其中D-葡萄糖胺的差异倍数较高。
这些结果表明,PGLNs能在不同程度上纠正LPS诱导的RAW264.7细胞中异常的代谢物水平。
11、PGLNs治疗LPS诱导的RAW264.7细胞炎症的关键代谢物分析
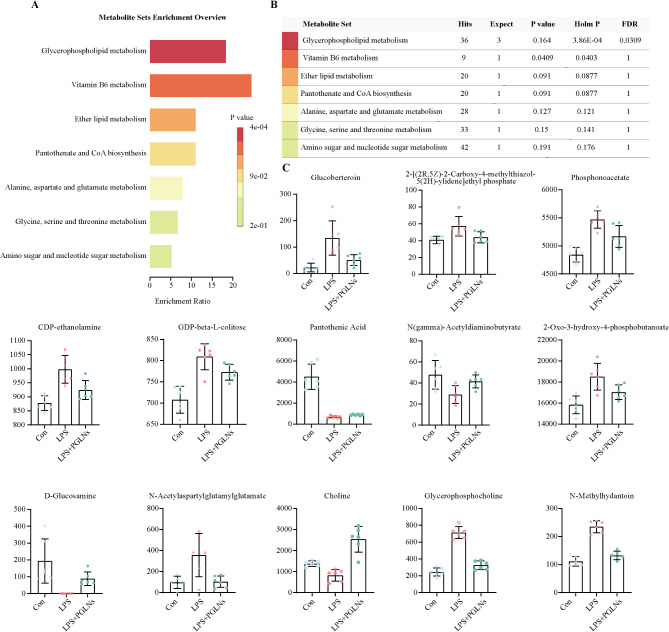
图11A:潜在生物标志物的KEGG富集图展示了相关代谢途径。
图11B:潜在生物标志物的代谢途径富集信息表明,PGLNs的代谢生物标志物主要涉及甘油磷脂代谢、维生素B6代谢等多种代谢途径。
图11C:对PGLNs干预后细胞中13种潜在代谢物的变化进行了定量分析。
这些结果表明,PGLNs可能通过调节氨基酸和脂质代谢、糖酵解途径等代谢途径,调节巨噬细胞极化,从而减轻肺部炎症。
12、PGLNs药理机制的代谢途径关系图
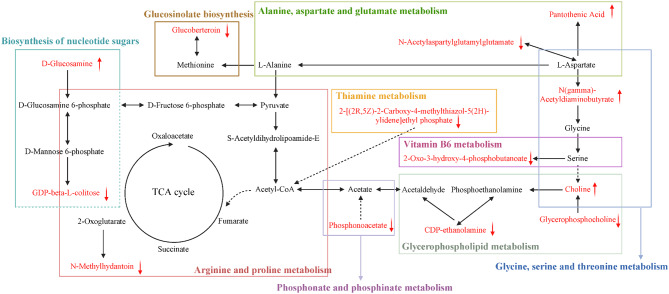
图12:展示了PGLNs可能通过调节氨基酸和脂质代谢、糖酵解途径等,调节巨噬细胞极化,进而减轻肺部炎症的代谢途径关系。该图直观呈现了PGLNs发挥药理作用的潜在代谢途径关联,为理解其治疗机制提供了依据。
结论
该研究表明,新鲜PG比干燥PG具有更好的抗炎和修复效果。从新鲜PG中提取的PGLNs在体内外均能改善炎症,首次揭示PGLNs可抑制LPS诱导的RAW264.7巨噬细胞炎症,减轻LPS诱导的小鼠ALI。PGLNs可促进M2抗炎巨噬细胞的表达,抑制M1促炎巨噬细胞的表达,并在体外调节巨噬细胞代谢,包括糖酵解、脂质和氨基酸代谢途径。这些发现为PGLNs的治疗应用提供了系统的认识。






