研载生物科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Adv Res】13分,足细胞藏大招!摇身变 “免疫激活器”,外泌体介导抗原呈递,重塑肾脏免疫圈
63 人阅读发布时间:2026-01-23 14:53
微小病变肾病(MCD)是肾病综合征的常见病理类型,以大量蛋白尿、低白蛋白血症为主要特征,足细胞损伤是其蛋白尿产生的直接原因,而异常T细胞活化是驱动足细胞损伤的关键因素。然而,部分MCD患者肾活检中未发现T细胞浸润,且免疫抑制治疗效果不佳,提示其免疫发病机制仍有未被阐明的关键环节。足细胞作为肾小球滤过屏障的重要组成部分,不仅具有结构功能,还表达主要组织相容性复合体(MHC)分子和共刺激分子,具备免疫调节潜能。外泌体作为细胞间通讯的重要媒介,可携带蛋白质、核酸等生物活性物质,在免疫调控中发挥关键作用。但足细胞来源外泌体(Pdo-Exos)是否通过抗原呈递介导足细胞与T细胞的交叉对话,进而驱动MCD进展,目前尚未明确。

今天分享的是发表在【J Adv Res】(IF:13)上题为“Podocyte-derived exosomes instruct dendritic cell-dependent CD8+ T cell activation and proliferation in renal inflammation”的研究。该研究通过体外共培养系统、嘌呤霉素氨基核苷(PAN)诱导的MCD小鼠模型及临床样本,探究Pdo-Exos在MCD中通过抗原呈递激活T细胞的作用及机制,为MCD的免疫治疗提供新视角。
研究结果
1、足细胞来源外泌体通过MHC-I依赖的抗原呈递激活CD8⁺T细胞
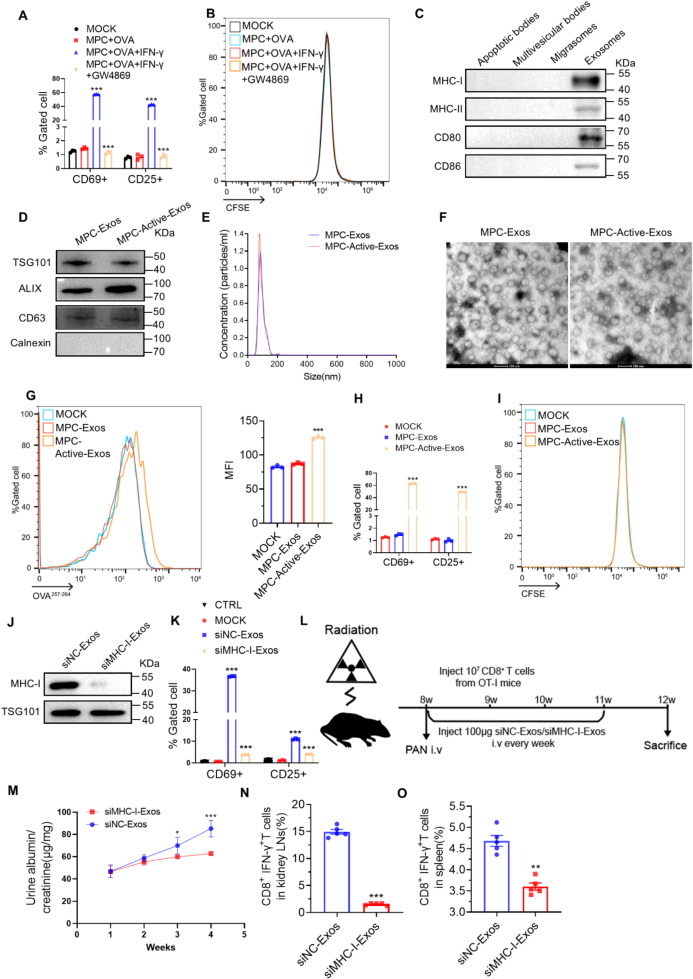
图1A:流式细胞术显示,IFN-γ和OVA处理的小鼠足细胞(MPC)与OT-I小鼠naiveT细胞共培养后,T细胞活化标志物CD69和CD25表达显著升高;加入外泌体分泌抑制剂GW4869后,T细胞活化被显著抑制。
图1B:流式细胞术显示,IFN-γ和OVA处理的MPC与T细胞共培养后,未诱导T细胞增殖。
图1C:Western blot显示,IFN-γ刺激后,Pdo-Exos中MHC-I、MHC-II及共刺激分子CD80、CD86表达显著升高。
图1D:Western blot显示,Pdo-Exos表达外泌体标志物TSG101、ALIX、CD63,不表达内质网标志物Calnexin。
图1E:纳米颗粒追踪分析(NTA)显示,MPC-Exos和MPC-Active-Exos粒径分布在50-150nm之间。
图1F:透射电镜(TEM)显示,Pdo-Exos呈典型杯状形态(比例尺100nm)。
图1G:流式细胞术显示,IFN-γ处理后,Pdo-Exos上OVA抗原表达比例显著升高。
图1H:流式细胞术显示,MPC-Active-Exos处理后,OT-I小鼠T细胞CD69和CD25表达显著升高,MPC-Exos无明显作用。
图1I:流式细胞术显示,MPC-Active-Exos处理后,未促进T细胞增殖。
图1J:Western blot显示,慢病毒介导MHC-I敲低的MPC分泌的外泌体(siMHC-I-Exos)中MHC-I表达缺失。
图1K:流式细胞术显示,siMHC-I-Exos处理后,无法激活OT-I小鼠T细胞。
图1L:动物实验流程示意图,全身照射耗尽专职抗原呈递细胞后,静脉注射OT-I小鼠CD8⁺T细胞和siMHC-I-Exos或siNC-Exos,同时尾静脉注射PAN诱导MCD。
图1M:ELISA显示,siMHC-I-Exos处理组小鼠尿白蛋白/肌酐比值(UACR)显著低于siNC-Exos组。
图1N:流式细胞术显示,siMHC-I-Exos处理组小鼠肾淋巴结中CD8⁺IFN-γ⁺T细胞数量显著减少。
图1O:流式细胞术显示,siMHC-I-Exos处理组小鼠脾脏中CD8⁺IFN-γ⁺T细胞数量显著减少。
这些结果表明,IFN-γ激活的足细胞分泌的外泌体可通过MHC-I依赖的抗原呈递直接激活CD8⁺T细胞,但不促进其增殖,且MHC-I是该过程的关键分子。
2、树突状细胞(DC)是足细胞来源外泌体驱动CD8⁺T细胞增殖的关键
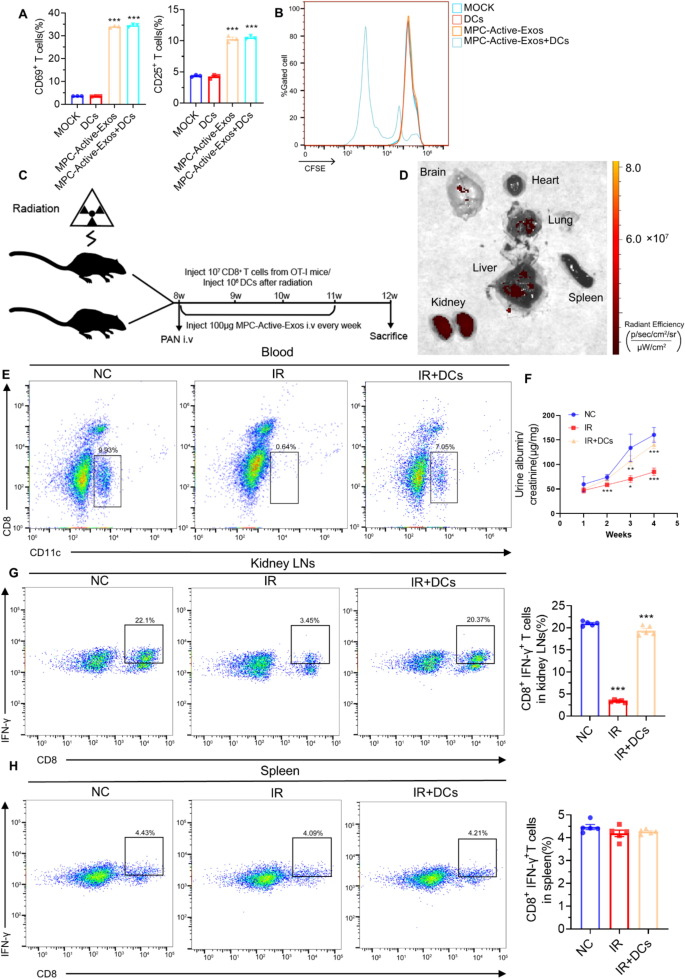
图2A:流式细胞术显示,MPC-Active-Exos与OT-I小鼠naive T细胞共培养时,加入或不加入DC,T细胞CD69和CD25表达无显著差异。
图2B:流式细胞术显示,仅在MPC-Active-Exos和DC共同存在时,OT-I小鼠T细胞增殖显著增强。
图2C:动物实验流程示意图,C57BL/6J小鼠全身照射耗尽DC后,静脉注射OT-I小鼠CD8⁺T细胞和MPC-Active-Exos,部分小鼠补充骨髓来源DC(BMDCs),随后尾静脉注射PAN诱导MCD。
图2D:活体成像显示,DiD标记的MPC-Active-Exos静脉注射后48h,主要在肾脏富集。
图2E:流式细胞术显示,照射组(IR)小鼠循环CD11c⁺DC数量显著减少,DC重建组(IR+DCs)CD11c⁺DC数量恢复至对照组(NC)的75%左右。
图2F:ELISA显示,IR组小鼠UACR显著低于NC组,IR+DCs组UACR恢复至NC组水平。
图2G:流式细胞术显示,IR组小鼠肾淋巴结中CD8⁺IFN-γ⁺T细胞数量显著低于NC组,IR+DCs组呈中间水平。
图2H:流式细胞术显示,各组小鼠脾脏中CD8⁺IFN-γ⁺T细胞数量无显著差异。
这些结果表明,足细胞来源外泌体诱导的CD8⁺T细胞增殖严格依赖DC,而T细胞活化无需DC参与,DC在足细胞外泌体介导的系统性免疫应答中起关键作用。
3、足细胞来源外泌体加重PAN诱导的肾脏损伤
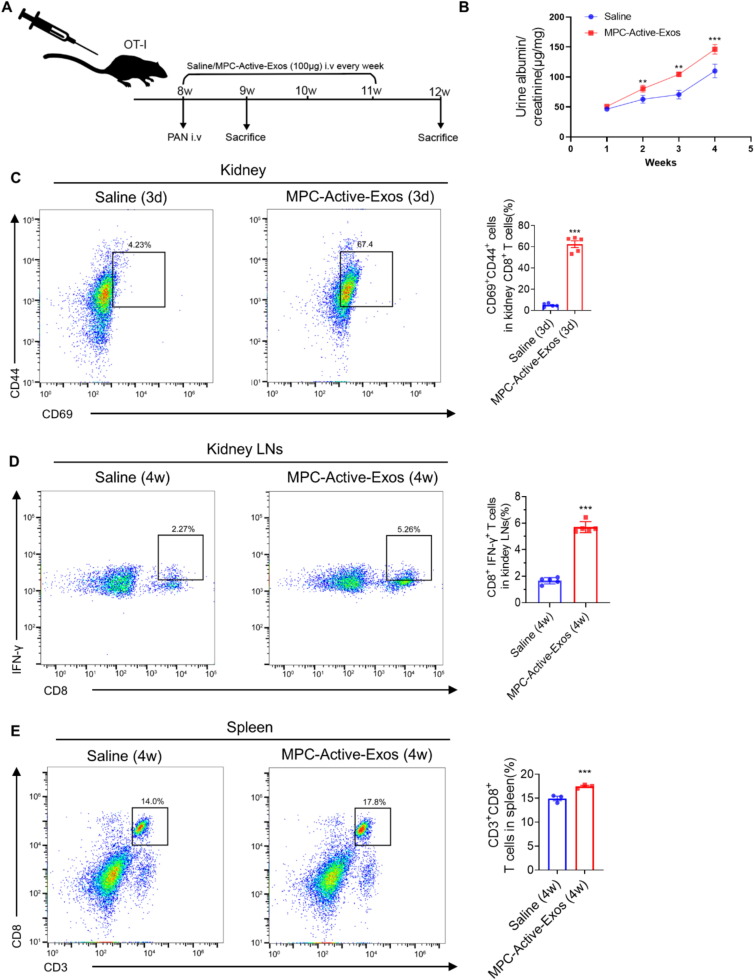
图3A:动物实验流程示意图,OT-I小鼠尾静脉注射PAN诱导MCD,每周注射MPC-Active-Exos或生理盐水,动态监测疾病进展。
图3B:ELISA显示,MPC-Active-Exos处理组小鼠UACR随时间显著升高,高于生理盐水组。
图3C:流式细胞术显示,MPC-Active-Exos注射3天后,小鼠肾脏中CD8⁺CD44⁺CD69⁺组织驻留记忆T(T_RM)细胞比例显著升高。
图3D:流式细胞术显示,MPC-Active-Exos注射4周后,小鼠肾淋巴结中CD8⁺IFN-γ⁺T细胞数量显著增加。
图3E:流式细胞术显示,MPC-Active-Exos注射4周后,小鼠脾脏中CD3⁺CD8⁺T细胞数量显著增多。
这些结果表明,足细胞来源外泌体通过早期激活肾脏局部T_RM细胞启动炎症,后续促进系统性T细胞扩张,加速MCD进展。
4、MCD患者足细胞来源外泌体可激活CD8⁺T细胞
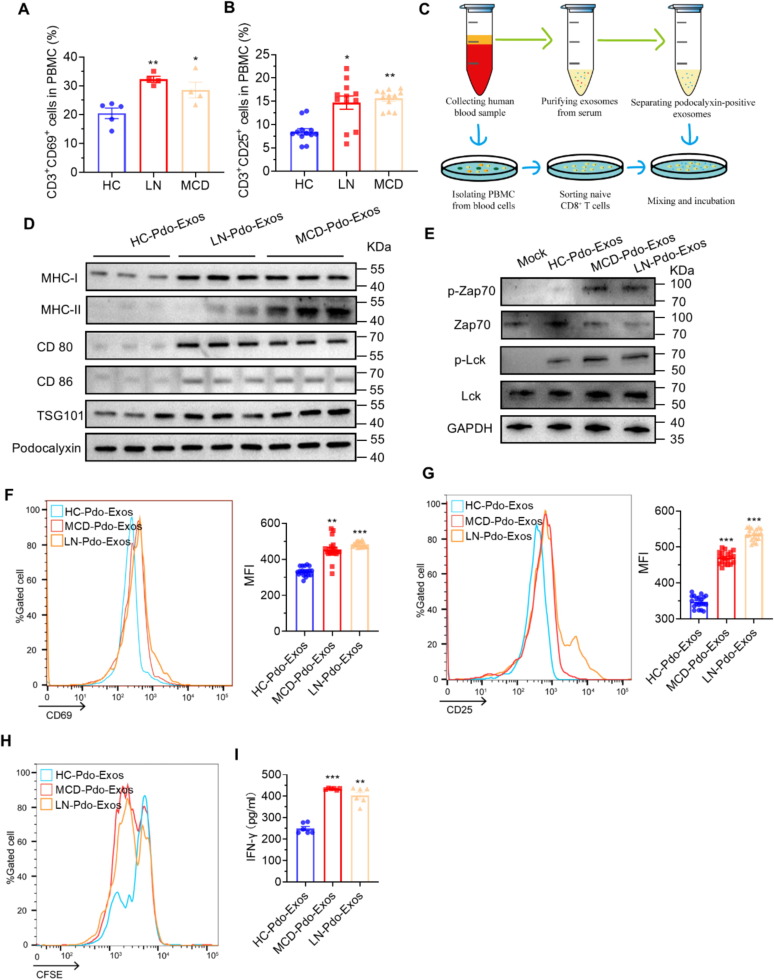
图4A:流式细胞术显示,MCD和狼疮性肾炎(LN)患者外周血中CD3⁺CD69⁺T细胞比例显著高于健康对照(HC)。
图4B:流式细胞术显示,MCD和LN患者外周血中CD3⁺CD25⁺T细胞比例显著高于HC。
图4C:自体配对实验流程示意图,分离患者血浆中足细胞来源外泌体(Podocalyxin阳性)和外周血naiveCD8⁺T细胞,进行共培养。
图4D:Western blot显示,MCD和LN患者Pdo-Exos中MHC-I、MHC-II、CD80、CD86表达水平显著高于HC。
图4E:Western blot显示,患者Pdo-Exos处理后,自体CD8⁺T细胞中ZAP-70(Tyr319)和Lck(Tyr394)磷酸化水平显著升高。
图4F:流式细胞术显示,MCD和LN患者Pdo-Exos处理后,自体CD8⁺T细胞CD69表达显著升高。
图4G:流式细胞术显示,MCD和LN患者Pdo-Exos处理后,自体CD8⁺T细胞CD25表达显著升高。
图4H:流式细胞术显示,MCD和LN患者Pdo-Exos处理72h后,自体CD8⁺T细胞增殖显著增强。
图4I:ELISA显示,患者Pdo-Exos与自体T细胞共培养后,上清中IFN-γ水平显著升高。
这些结果表明,MCD患者循环Pdo-Exos高表达抗原呈递相关分子,可激活自体CD8⁺T细胞,且与疾病严重程度相关。
5、GW4869抑制外泌体分泌延缓PAN诱导的肾脏损伤
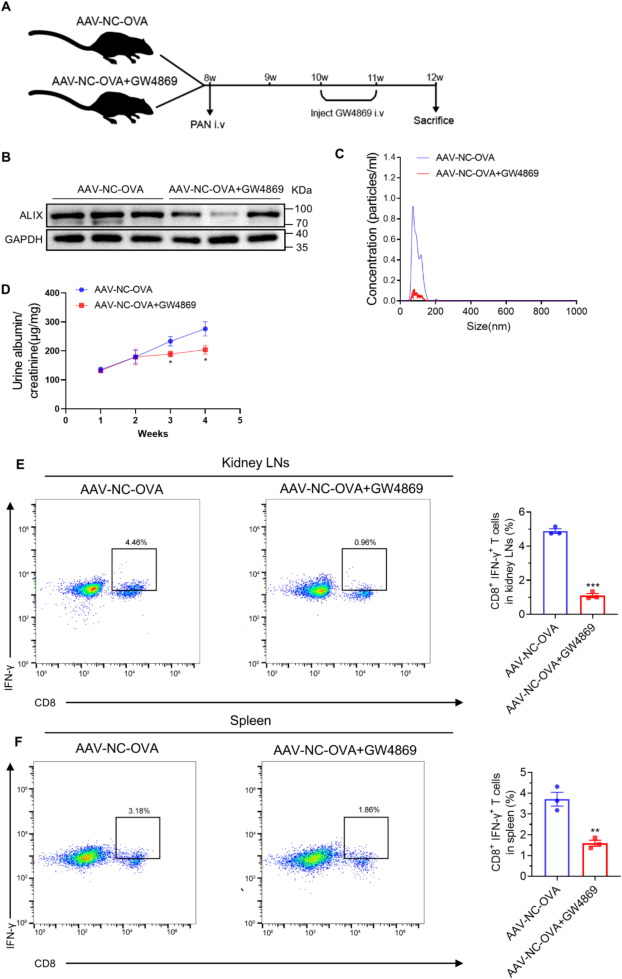
图5A:动物实验流程示意图,OT-I小鼠通过AAV2/9载体介导足细胞特异性表达OVA(AAV-NC-OVA),尾静脉注射PAN诱导MCD,随后注射GW4869或生理盐水。
图5B:Western blot显示,GW4869处理组小鼠肾脏组织中外泌体标志物ALIX表达显著降低。
图5C:NTA显示,GW4869处理组小鼠肾皮质分离的外泌体颗粒浓度显著减少。
图5D:ELISA显示,GW4869处理组小鼠UACR显著低于对照组。
图5E:流式细胞术显示,GW4869处理组小鼠肾淋巴结中CD8⁺IFN-γ⁺T细胞数量显著减少。
图5F:流式细胞术显示,GW4869处理组小鼠脾脏中CD8⁺IFN-γ⁺T细胞数量显著减少。
这些结果表明,GW4869通过抑制外泌体分泌,减少致病性T细胞应答,延缓MCD进展。
6、足细胞特异性Rab27a敲低减轻PAN诱导的肾脏损伤
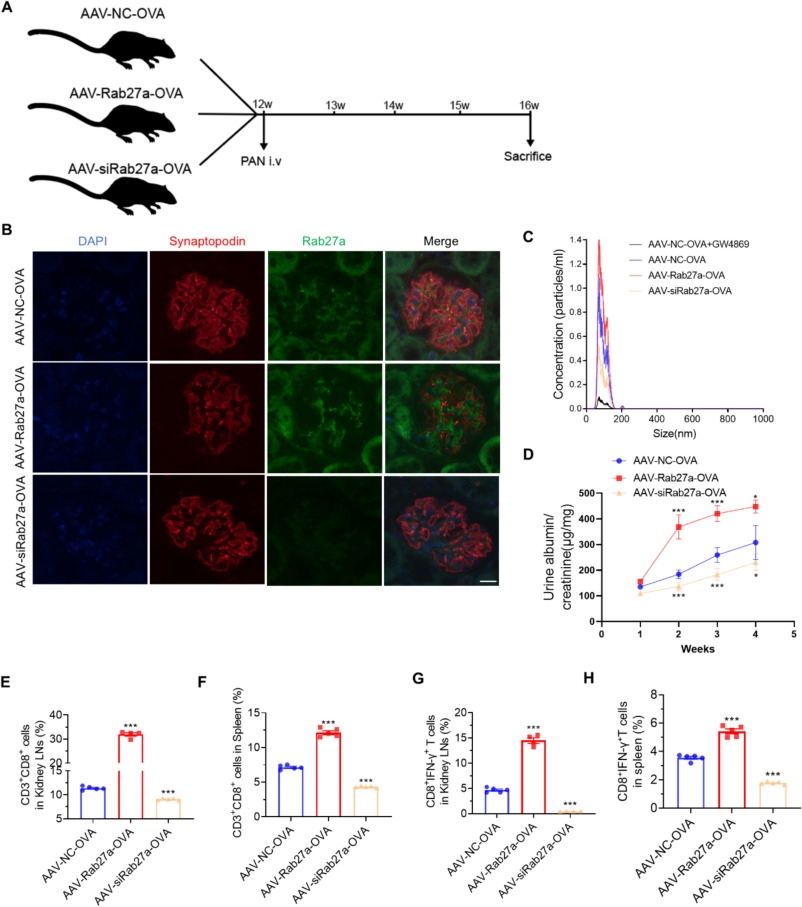
图6A:动物实验流程示意图,OT-I小鼠通过AAV2/9载体介导足细胞特异性表达OVA及Rab27a过表达(AAV-Rab27a-OVA)或敲低(AAV-siRab27a-OVA),尾静脉注射PAN诱导MCD。
图6B:免疫荧光显示,AAV-Rab27a-OVA组小鼠肾小球Rab27a表达升高,AAV-siRab27a-OVA组表达降低。
图6C:NTA显示,AAV-Rab27a-OVA组小鼠肾皮质外泌体分泌增加,AAV-siRab27a-OVA组分泌减少,且效果优于GW4869处理。
图6D:ELISA显示,AAV-Rab27a-OVA组小鼠UACR显著升高,AAV-siRab27a-OVA组显著降低。
图6E:流式细胞术显示,AAV-Rab27a-OVA组小鼠肾淋巴结中CD3⁺CD8⁺T细胞数量显著增多,AAV-siRab27a-OVA组显著减少。
图6F:流式细胞术显示,AAV-Rab27a-OVA组小鼠脾脏中CD3⁺CD8⁺T细胞数量显著增多,AAV-siRab27a-OVA组显著减少。
图6G:流式细胞术显示,AAV-Rab27a-OVA组小鼠肾淋巴结中CD8⁺IFN-γ⁺T细胞数量显著增多,AAV-siRab27a-OVA组显著减少。
图6H:流式细胞术显示,AAV-Rab27a-OVA组小鼠脾脏中CD8⁺IFN-γ⁺T细胞数量显著增多,AAV-siRab27a-OVA组显著减少。
这些结果表明,Rab27a介导的足细胞外泌体分泌促进MCD进展,靶向抑制足细胞Rab27a可阻断致病性T细胞活化,减轻肾脏损伤。
结论
本研究证实,足细胞来源外泌体可通过MHC-I依赖的抗原呈递直接激活CD8⁺T细胞,而T细胞的克隆增殖需树突状细胞参与,形成“局部激活-全身扩增”的双相调控机制驱动微小病变肾病进展。MCD患者循环足细胞外泌体高表达抗原呈递相关分子,可激活自体CD8⁺T细胞,且其表达水平与疾病严重程度相关。Rab27a作为外泌体分泌的关键调控分子,靶向抑制足细胞Rab27a或使用外泌体分泌抑制剂GW4869,可有效阻断T细胞炎症级联反应,减轻蛋白尿和肾脏损伤。该研究重新定义了足细胞作为“非经典抗原呈递细胞”的免疫调节功能,揭示了足细胞外泌体-Rab27a-T细胞轴在MCD发病中的关键作用,为MCD的精准免疫治疗提供了新靶点和策略。






