研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
乳腺癌外泌体有助于转移前的生态位形成并促进肿瘤细胞的骨转移
1331 人阅读发布时间:2021-07-06 11:27
乳腺癌是妇女中与癌症相关的死亡率的第二大主要原因,在疾病进展过程中,乳腺癌患者经常观察到骨转移。乳腺癌患者的传统治疗包括放疗、化疗和辅助化疗,甚至近期批准的几种骨特异性药物只能缓解骨骼相关并发症,但由于获得治疗耐药性,死亡率保持在较高水平。乳腺癌骨转移仍然是乳腺癌患者常见的威胁因素,因此需要进一步研究乳腺癌骨转移的详细机制,并发现新的潜在的临床诊断和治疗的生物标志物。
外泌体是外泌体作为蛋白质、mRNA和miRNA的载体,被人们广泛熟知。肿瘤衍生的外泌体有助于为转移性肿瘤细胞的定植创造合适的微环境。有研究表明,乳腺癌分泌的外泌体可以破坏远处器官的血管内皮障碍,增加脑和肺转移的发生率。然而,乳腺癌分泌的外泌体是否通过转移前微环境的形成影响溶骨性骨转移尚不清楚。这些机制的鉴定可能揭示开发新的乳腺癌治疗靶标的新途径。
乳腺癌来源的miRNAs通过外泌体转移在肿瘤的发展和进展中发挥关键作用,包括调节乳腺肿瘤的生长和转移以及转移部位的微环境。miR-21是一种高度保守的肿瘤小RNA,在肝细胞癌、肺癌、乳腺癌等多种癌症患者的血清中均有表达,其表达水平明显高于健康对照组。此外,之前的研究也表明miR-21参与肿瘤的进展和破骨细胞的分化。但是乳腺癌来源的外泌体miR-21是否对应破骨细胞驱动的乳腺癌转移灶前转移位尚不清楚。
因此,本研究探究了乳腺癌分泌的外泌体是否通过促进破骨细胞分化和增强骨转移来促进转移前生态位的产生,以及乳腺癌外泌体的miR-21在骨转移中的作用,为临床诊断和治疗乳腺癌提供了新的见解。该研究发表于Theranostics杂志上。
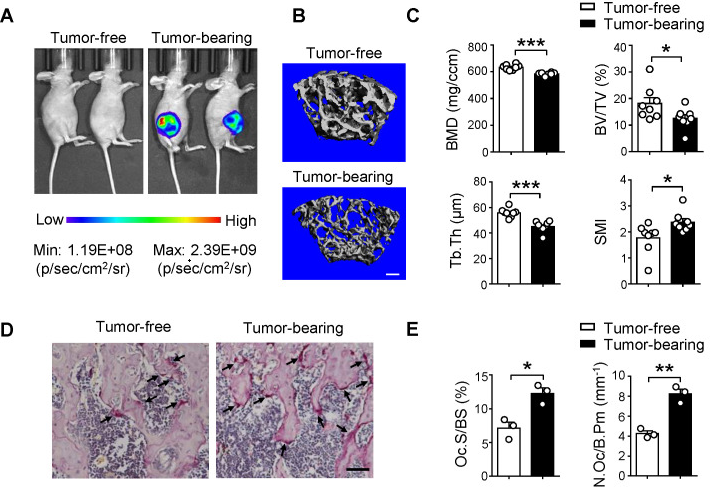
首先,本研究利用带荧光标记的SCP28乳腺癌细胞注射入裸鼠中,构建乳腺癌模型。通过X-射线、骨组织形态和micro-CT分析成瘤小鼠的骨转移情况,结果发现原发性乳腺肿瘤的植入会降低骨密度,导致小鼠骨质疏松,并且发现骨病变发生在乳腺癌细胞的骨转移之前。
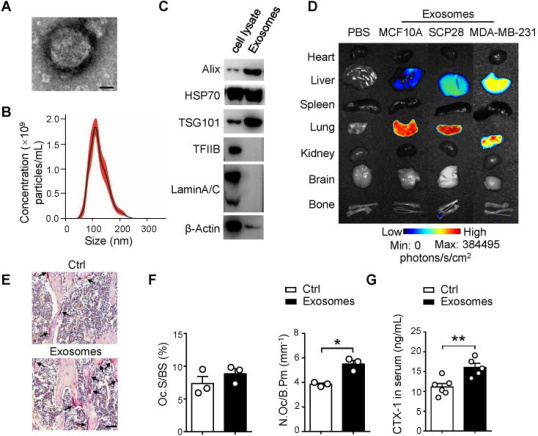
之后,我们分离了SCP28细胞分泌的外泌体,并通过透射电镜、粒径和western blot鉴定了该外泌体,并且分析了来自不同细胞系的外泌体在受体小鼠多个器官中的分布情况,结果表明还有SCP28细胞来源的外泌体才具有达到骨骼的倾向。进一步的实验表明SCP28细胞来源的外泌体在体外促进破骨细胞的分化和活性。
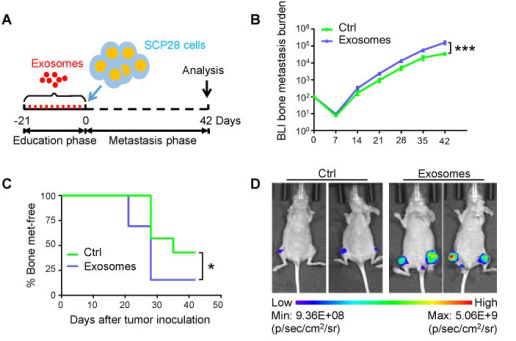
接下来,利用SCP28细胞作为骨转移的供体,接受或不接受SCP28细胞分泌外泌体处理,建立了完善的异种移植模型。并且,进一步用双磷酸盐(破骨细胞抑制剂)处理的外泌体培养小鼠进行了一系列的实验。这些实验结果发现:破骨细胞是在骨骼中转移前生态位建立过程中SCP20细胞分泌的外泌体的直接下游靶标,并且证明了SCP28乳腺癌细胞衍生的外泌体通过促进骨骼微环境中破骨细胞的形成而促进乳腺癌细胞的骨转移。
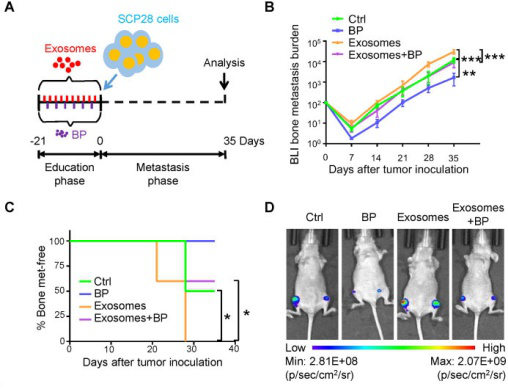
最后,探究了SCP28细胞来源的外泌体在调节破骨细胞形成和功能中的机制,分析了源自SCP28细胞外泌体的miRNA谱。miRNA测序结果表明,许多miRNA被包裹在外泌体中,并且与对照相比,miR-21显著上调,而pre-miR-21的水平未改变,表明破骨细胞中增加的miR-21是从外泌体转运的,而不是内在诱导的表达。因此,我们进一步探讨了miR-21水平与SCP28细胞转移能力的关系。实验研究表明SCP28细胞来源的miR-21可以从外泌体传递到破骨细胞中,并且miR-21在破骨细胞驱动的转移前生态位形成中起着至关重要的作用。
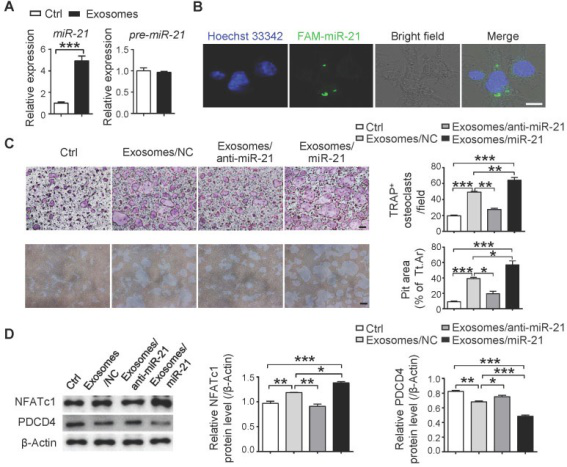
综上,研究证明了乳腺癌分泌的外泌体是建立转移前的生态位以加速肿瘤细胞的骨转移的关键介质。在此过程中,源自癌细胞的外泌体miR-21充当破骨细胞分化和功能的细胞间信使,并通过调节PDCD4表达发挥作用。此外,来着患者样品的数据进一步反映了miR-21可以作为乳腺癌骨转移的临床诊断和治疗的潜在靶标。因此,我们的研究不仅揭示了乳腺癌骨转移的潜在机制,而且为破骨细胞中的miR-21对转化药物的治疗抑制提供了临床见解。
参考文献:Breast cancer exosomes contribute to pre-metastatic niche formation and promote bone metastasis of tumor cells. Theranostics. 2021 Jan 1, 11(3): 1429-1445.
外泌体是外泌体作为蛋白质、mRNA和miRNA的载体,被人们广泛熟知。肿瘤衍生的外泌体有助于为转移性肿瘤细胞的定植创造合适的微环境。有研究表明,乳腺癌分泌的外泌体可以破坏远处器官的血管内皮障碍,增加脑和肺转移的发生率。然而,乳腺癌分泌的外泌体是否通过转移前微环境的形成影响溶骨性骨转移尚不清楚。这些机制的鉴定可能揭示开发新的乳腺癌治疗靶标的新途径。
乳腺癌来源的miRNAs通过外泌体转移在肿瘤的发展和进展中发挥关键作用,包括调节乳腺肿瘤的生长和转移以及转移部位的微环境。miR-21是一种高度保守的肿瘤小RNA,在肝细胞癌、肺癌、乳腺癌等多种癌症患者的血清中均有表达,其表达水平明显高于健康对照组。此外,之前的研究也表明miR-21参与肿瘤的进展和破骨细胞的分化。但是乳腺癌来源的外泌体miR-21是否对应破骨细胞驱动的乳腺癌转移灶前转移位尚不清楚。
因此,本研究探究了乳腺癌分泌的外泌体是否通过促进破骨细胞分化和增强骨转移来促进转移前生态位的产生,以及乳腺癌外泌体的miR-21在骨转移中的作用,为临床诊断和治疗乳腺癌提供了新的见解。该研究发表于Theranostics杂志上。
首先,本研究利用带荧光标记的SCP28乳腺癌细胞注射入裸鼠中,构建乳腺癌模型。通过X-射线、骨组织形态和micro-CT分析成瘤小鼠的骨转移情况,结果发现原发性乳腺肿瘤的植入会降低骨密度,导致小鼠骨质疏松,并且发现骨病变发生在乳腺癌细胞的骨转移之前。

之后,我们分离了SCP28细胞分泌的外泌体,并通过透射电镜、粒径和western blot鉴定了该外泌体,并且分析了来自不同细胞系的外泌体在受体小鼠多个器官中的分布情况,结果表明还有SCP28细胞来源的外泌体才具有达到骨骼的倾向。进一步的实验表明SCP28细胞来源的外泌体在体外促进破骨细胞的分化和活性。

接下来,利用SCP28细胞作为骨转移的供体,接受或不接受SCP28细胞分泌外泌体处理,建立了完善的异种移植模型。并且,进一步用双磷酸盐(破骨细胞抑制剂)处理的外泌体培养小鼠进行了一系列的实验。这些实验结果发现:破骨细胞是在骨骼中转移前生态位建立过程中SCP20细胞分泌的外泌体的直接下游靶标,并且证明了SCP28乳腺癌细胞衍生的外泌体通过促进骨骼微环境中破骨细胞的形成而促进乳腺癌细胞的骨转移。


最后,探究了SCP28细胞来源的外泌体在调节破骨细胞形成和功能中的机制,分析了源自SCP28细胞外泌体的miRNA谱。miRNA测序结果表明,许多miRNA被包裹在外泌体中,并且与对照相比,miR-21显著上调,而pre-miR-21的水平未改变,表明破骨细胞中增加的miR-21是从外泌体转运的,而不是内在诱导的表达。因此,我们进一步探讨了miR-21水平与SCP28细胞转移能力的关系。实验研究表明SCP28细胞来源的miR-21可以从外泌体传递到破骨细胞中,并且miR-21在破骨细胞驱动的转移前生态位形成中起着至关重要的作用。

综上,研究证明了乳腺癌分泌的外泌体是建立转移前的生态位以加速肿瘤细胞的骨转移的关键介质。在此过程中,源自癌细胞的外泌体miR-21充当破骨细胞分化和功能的细胞间信使,并通过调节PDCD4表达发挥作用。此外,来着患者样品的数据进一步反映了miR-21可以作为乳腺癌骨转移的临床诊断和治疗的潜在靶标。因此,我们的研究不仅揭示了乳腺癌骨转移的潜在机制,而且为破骨细胞中的miR-21对转化药物的治疗抑制提供了临床见解。
参考文献:Breast cancer exosomes contribute to pre-metastatic niche formation and promote bone metastasis of tumor cells. Theranostics. 2021 Jan 1, 11(3): 1429-1445.






