研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
缺血性卒中小鼠M2小胶质细胞来源细胞外囊泡通过miR124/STAT3减少胶质瘢痕形成
656 人阅读发布时间:2021-06-23 10:28
【关键词】星形胶质细胞、胶质瘢痕、缺血性卒中、小胶质细胞、小细胞外囊泡

【摘要】胶质瘢痕是卒中患者神经再生的一个阻碍,小胶质细胞与星形胶质细胞之间的交互作用影响瘢痕形成,但是具体的机制仍有待研究。卒中小鼠术后1-7天尾静脉注射M2小胶质细胞来源的sEVs后检测胶质瘢痕、缺血灶大小、神经功能评分。M2小胶质细胞来源的sEVs通过miR124调节STAT3减少星形胶质细胞增殖,降低星形胶质细胞Notch1、增加Sox2表达。结果表明,M2星形胶质细胞来源的sEVs可调节胶质瘢痕形成,可作为卒中的治疗靶点。
【摘要】胶质瘢痕是卒中患者神经再生的一个阻碍,小胶质细胞与星形胶质细胞之间的交互作用影响瘢痕形成,但是具体的机制仍有待研究。卒中小鼠术后1-7天尾静脉注射M2小胶质细胞来源的sEVs后检测胶质瘢痕、缺血灶大小、神经功能评分。M2小胶质细胞来源的sEVs通过miR124调节STAT3减少星形胶质细胞增殖,降低星形胶质细胞Notch1、增加Sox2表达。结果表明,M2星形胶质细胞来源的sEVs可调节胶质瘢痕形成,可作为卒中的治疗靶点。
【前言】胶质瘢痕是阻碍轴突再生和功能恢复的主要障碍,胶质瘢痕主要是小胶质细胞增殖伴随活化的星形胶质细胞,STAT3在脑损伤后可调节星形胶质增生。小胶质细胞和星形胶质细胞共同参与胶质瘢痕的形成,小胶质细胞作为中枢神经系统中的免疫细胞,在应对不同的免疫微环境会呈现出不同的极化状态:促炎型M1和抗炎型M2,其中M2小胶质细胞可促进组织损伤恢复,目前小胶质细胞如何调节瘢痕形成的机制仍然不清楚,而且M2小胶细胞在其中的作用也是未知的。
小细胞外囊泡(sEVs)目前是细胞间交互作用的重要媒介,通过递送miRNAs、脂质、蛋白质等参与细胞间通讯。M2小胶质细胞来源的EVs对损伤修复又促进作用,基于之前的筛选结果,M2小胶质细胞来源的sEVs富含miR124,而STAT3也是miR124的主要靶标,STAT3负责星形胶质细胞的增生,参与胶质瘢痕的形成,因此提出假设,M2小胶质细胞来源的sEVs通过miR124调控STAT3从而调节胶质瘢痕形成。
【结果】
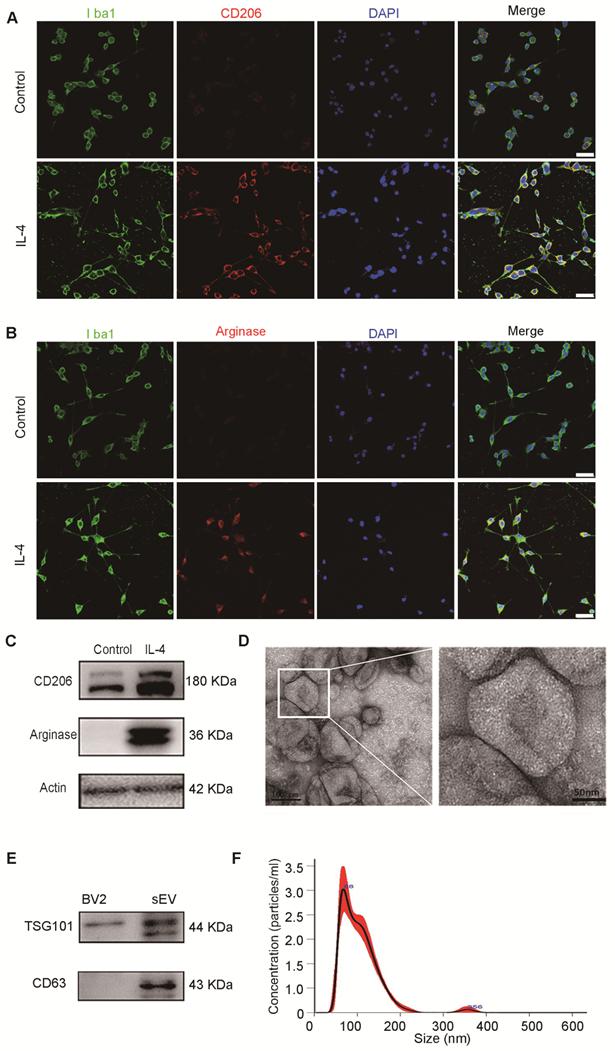
首先诱导小胶质细胞的M2极化,免疫荧光和WB进行验证。分离M2小胶质细胞来源的sEVs并进行TEM和NTA的表征。
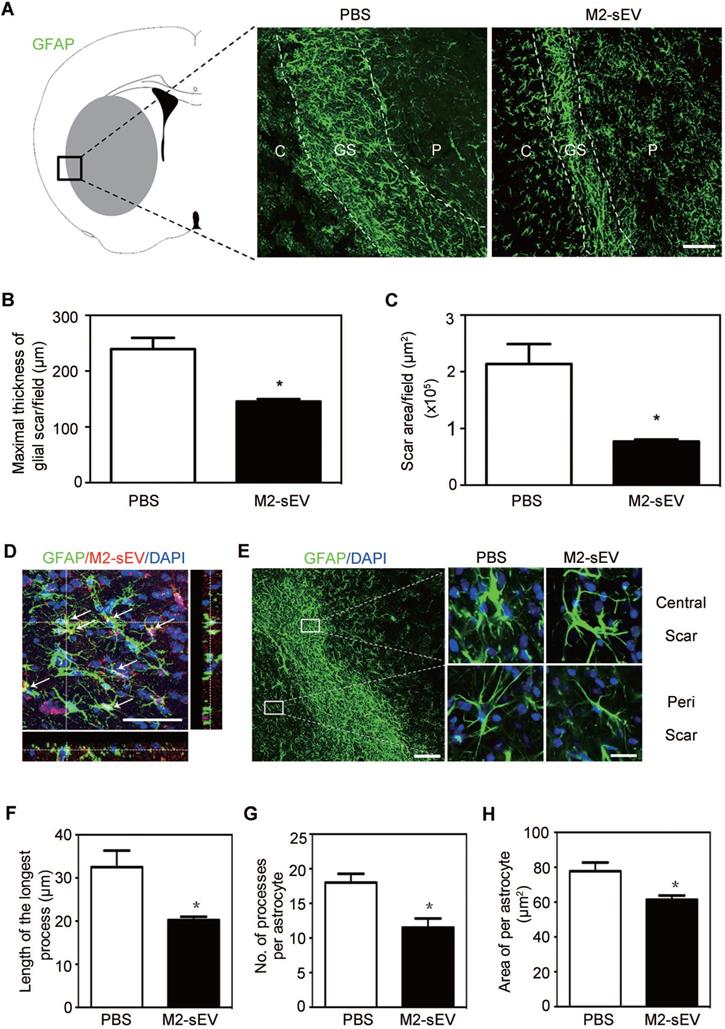
 IF蛋白表达是星形胶质增生的特征性蛋白,检测M2-sEVs对IF蛋白表达影响来反应胶质瘢痕的影响。PKH26标记M2-sEVs后,验证星形胶质细胞对sEVs的摄取。结果表明:星形胶质细胞可摄取M2-sEVs,进而影响胶质瘢痕形成。
IF蛋白表达是星形胶质增生的特征性蛋白,检测M2-sEVs对IF蛋白表达影响来反应胶质瘢痕的影响。PKH26标记M2-sEVs后,验证星形胶质细胞对sEVs的摄取。结果表明:星形胶质细胞可摄取M2-sEVs,进而影响胶质瘢痕形成。
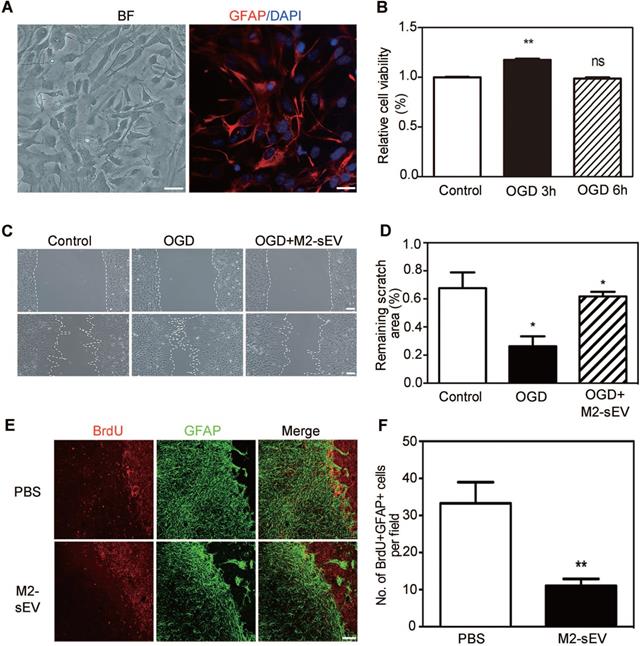
 星形胶质细胞的迁移和增殖是胶质瘢痕形成的主要方式,因此检测M2-sEVs对星形胶质细胞迁移、增殖的影响。
星形胶质细胞的迁移和增殖是胶质瘢痕形成的主要方式,因此检测M2-sEVs对星形胶质细胞迁移、增殖的影响。
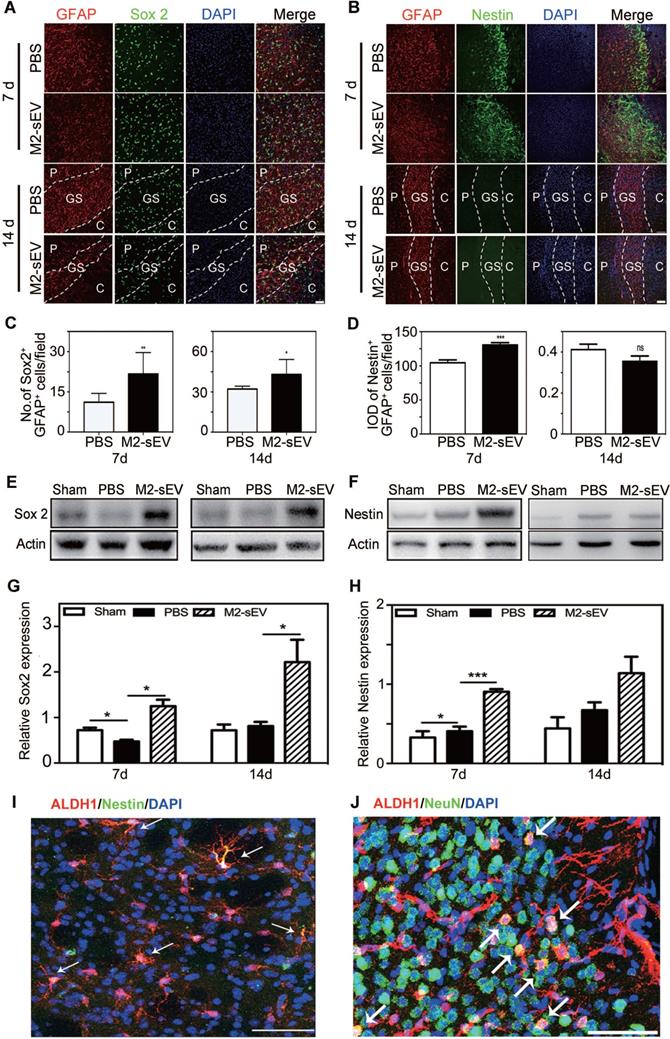
 M2-sEVs处理后的小鼠,免疫荧光显示活化的星形胶质细胞Sox2和nestin表达增加,表明星形胶质细胞被重塑为母细胞,进一步做WB验证Sox2和nestin表达,构建转基因小鼠验证活化的星形胶质细胞转分化为神经祖细胞。
M2-sEVs处理后的小鼠,免疫荧光显示活化的星形胶质细胞Sox2和nestin表达增加,表明星形胶质细胞被重塑为母细胞,进一步做WB验证Sox2和nestin表达,构建转基因小鼠验证活化的星形胶质细胞转分化为神经祖细胞。
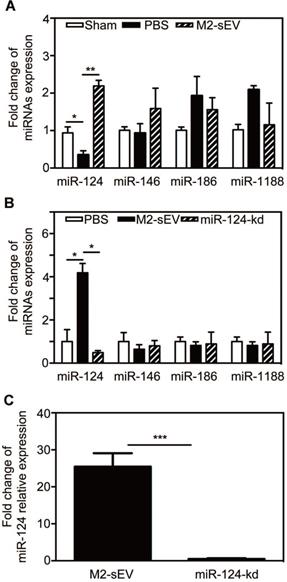
 sEVs通常通过递送miRNA发挥作用,因此筛选M2-sEVs中发挥作用的miRNA,miR124在脑损伤后下调,M2-sEVs处理后上调。慢病毒干扰M2-sEVs中miR124表达,结果显示M2-sEVs处理脑损伤小鼠后,只有miR124表达下调,表明miR124是主要发挥作用的miRNA。
sEVs通常通过递送miRNA发挥作用,因此筛选M2-sEVs中发挥作用的miRNA,miR124在脑损伤后下调,M2-sEVs处理后上调。慢病毒干扰M2-sEVs中miR124表达,结果显示M2-sEVs处理脑损伤小鼠后,只有miR124表达下调,表明miR124是主要发挥作用的miRNA。
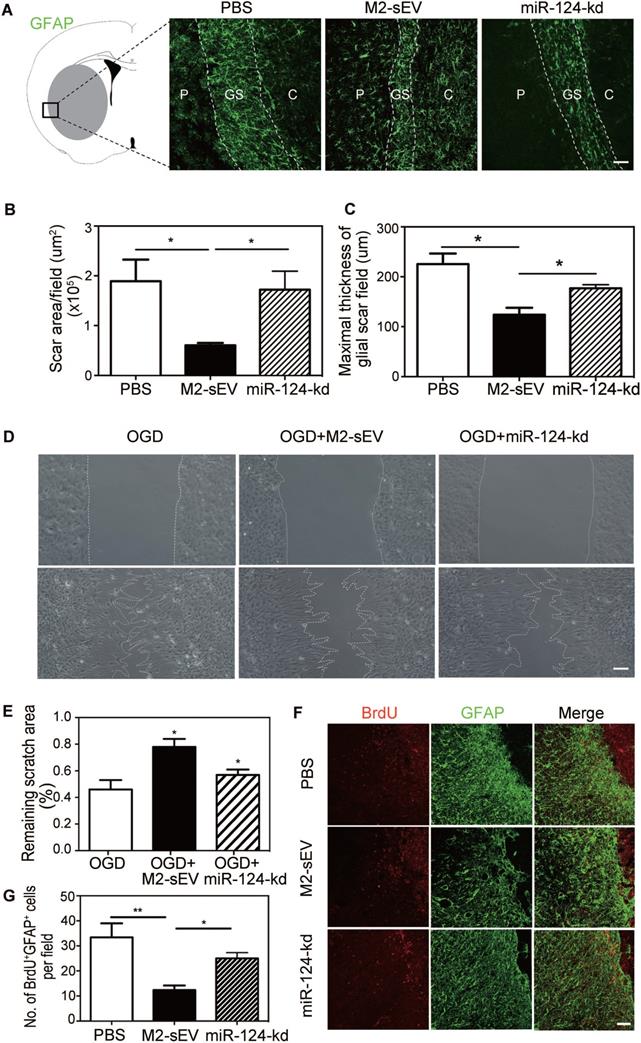
 探究M2-sEVs中miR124在胶质瘢痕形成过程中的作用,干扰M2-sEVs中miR124后回输至脑损伤小鼠,GFAP染色检测胶质瘢痕形成,体外检测星形胶质细胞的增殖和迁移。
探究M2-sEVs中miR124在胶质瘢痕形成过程中的作用,干扰M2-sEVs中miR124后回输至脑损伤小鼠,GFAP染色检测胶质瘢痕形成,体外检测星形胶质细胞的增殖和迁移。
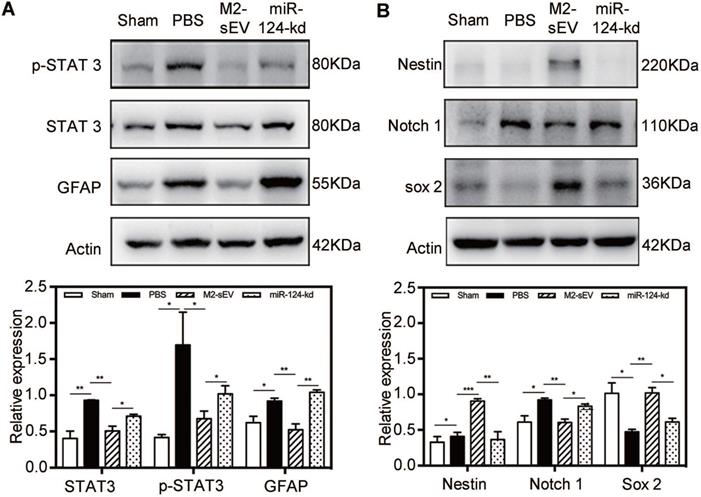
 通过数据库筛选miR124下游的靶标,其中STAT3是miR124作用的蛋白。WB验证STAT3和p-STAT3表达,将M2-sEVs中miR124干扰后回输至小鼠,随后检测STAT3和p-STAT3表达,nestin、Sox2、Notch1表达验证之前的实验结果。
通过数据库筛选miR124下游的靶标,其中STAT3是miR124作用的蛋白。WB验证STAT3和p-STAT3表达,将M2-sEVs中miR124干扰后回输至小鼠,随后检测STAT3和p-STAT3表达,nestin、Sox2、Notch1表达验证之前的实验结果。
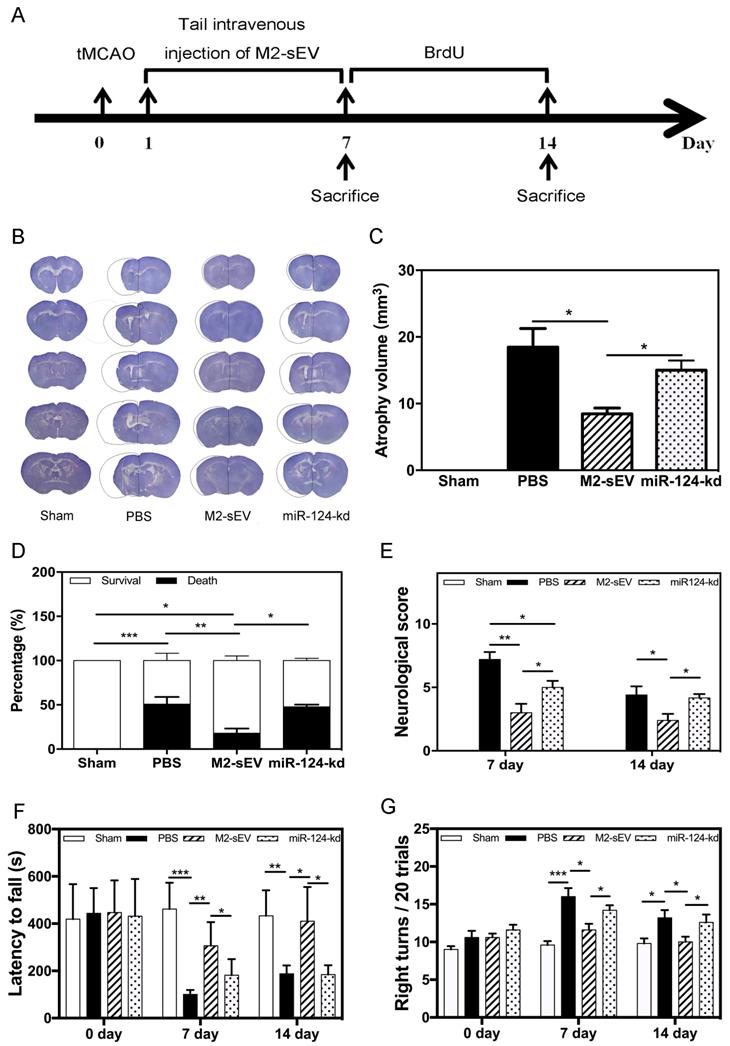
 验证M2-sEVs主要通过miR124发挥作用,按sham、PBS、M2-sEV和miR-124-kd分组,评估回输后小鼠的存活情况、神经功能恢复情况、肌肉的协调性等。zui终结果表明:M2-sEVs是通过miR124发挥作用的。
验证M2-sEVs主要通过miR124发挥作用,按sham、PBS、M2-sEV和miR-124-kd分组,评估回输后小鼠的存活情况、神经功能恢复情况、肌肉的协调性等。zui终结果表明:M2-sEVs是通过miR124发挥作用的。


【前言】胶质瘢痕是阻碍轴突再生和功能恢复的主要障碍,胶质瘢痕主要是小胶质细胞增殖伴随活化的星形胶质细胞,STAT3在脑损伤后可调节星形胶质增生。小胶质细胞和星形胶质细胞共同参与胶质瘢痕的形成,小胶质细胞作为中枢神经系统中的免疫细胞,在应对不同的免疫微环境会呈现出不同的极化状态:促炎型M1和抗炎型M2,其中M2小胶质细胞可促进组织损伤恢复,目前小胶质细胞如何调节瘢痕形成的机制仍然不清楚,而且M2小胶细胞在其中的作用也是未知的。
小细胞外囊泡(sEVs)目前是细胞间交互作用的重要媒介,通过递送miRNAs、脂质、蛋白质等参与细胞间通讯。M2小胶质细胞来源的EVs对损伤修复又促进作用,基于之前的筛选结果,M2小胶质细胞来源的sEVs富含miR124,而STAT3也是miR124的主要靶标,STAT3负责星形胶质细胞的增生,参与胶质瘢痕的形成,因此提出假设,M2小胶质细胞来源的sEVs通过miR124调控STAT3从而调节胶质瘢痕形成。
【结果】
首先诱导小胶质细胞的M2极化,免疫荧光和WB进行验证。分离M2小胶质细胞来源的sEVs并进行TEM和NTA的表征。














