研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
淀粉样斑块相关的小胶质细胞超量分泌细胞外囊泡,并在人源化APP小鼠模型中加速tau病理
1085 人阅读发布时间:2021-07-20 18:07

【摘要】
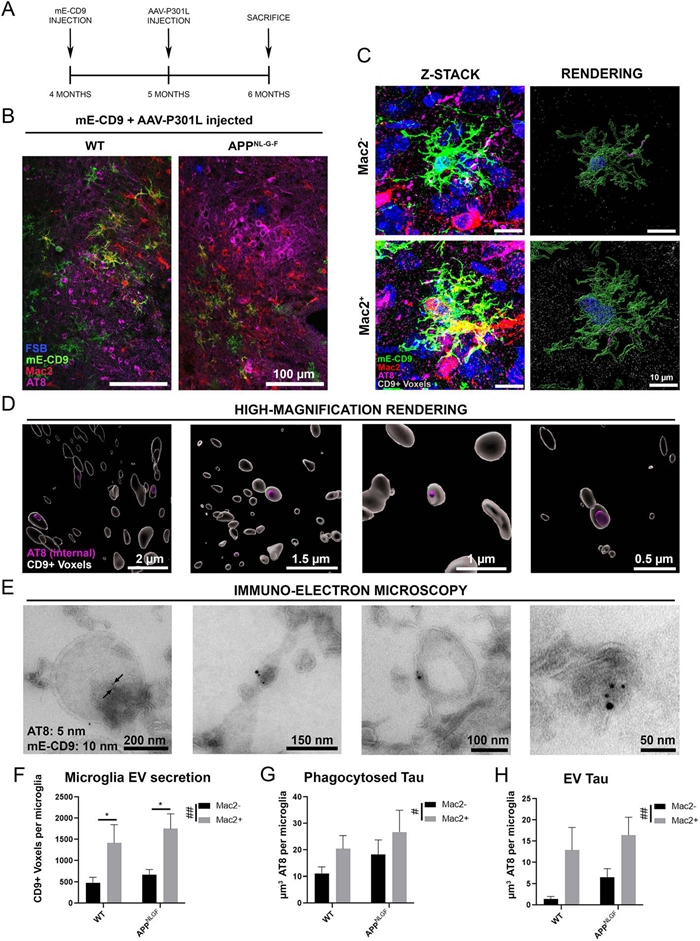
小胶质细胞有助于阿尔茨海默氏病的tau病理学进展,淀粉样斑块的积累将小胶质细胞转变为神经变性小胶质细胞(MGnD),这些小胶质细胞具有增强的吞噬功能,可吞噬含有聚集和磷酸化的tau的斑块、凋亡神经元和营养不良性神经突,但目前尚不清楚小胶质细胞如何主动吞噬病理蛋白,进而改善病理状态的同时促进疾病进展。因此作者在C57BL / 6小鼠5个月时,将表达P301L tau突变体的腺相关病毒(AAV-P301L-tau)立体定位注射于WT和人源化APP突变敲入纯合子(AppNL-GF)小鼠的内嗅皮层(MEC)中,6个月后检测小胶质细胞。为体内监测小胶质细胞外囊泡(EVs)分泌,设计了新型的慢病毒EV报告基因系统mEmerald-CD9,专门在小胶质细胞中表达,注入MEC的同一区域。最终结果表明,MGnD小胶质细胞超分泌p-tau+的EVs,压实Aβ斑块并清除NP tau蛋白。

【前言】
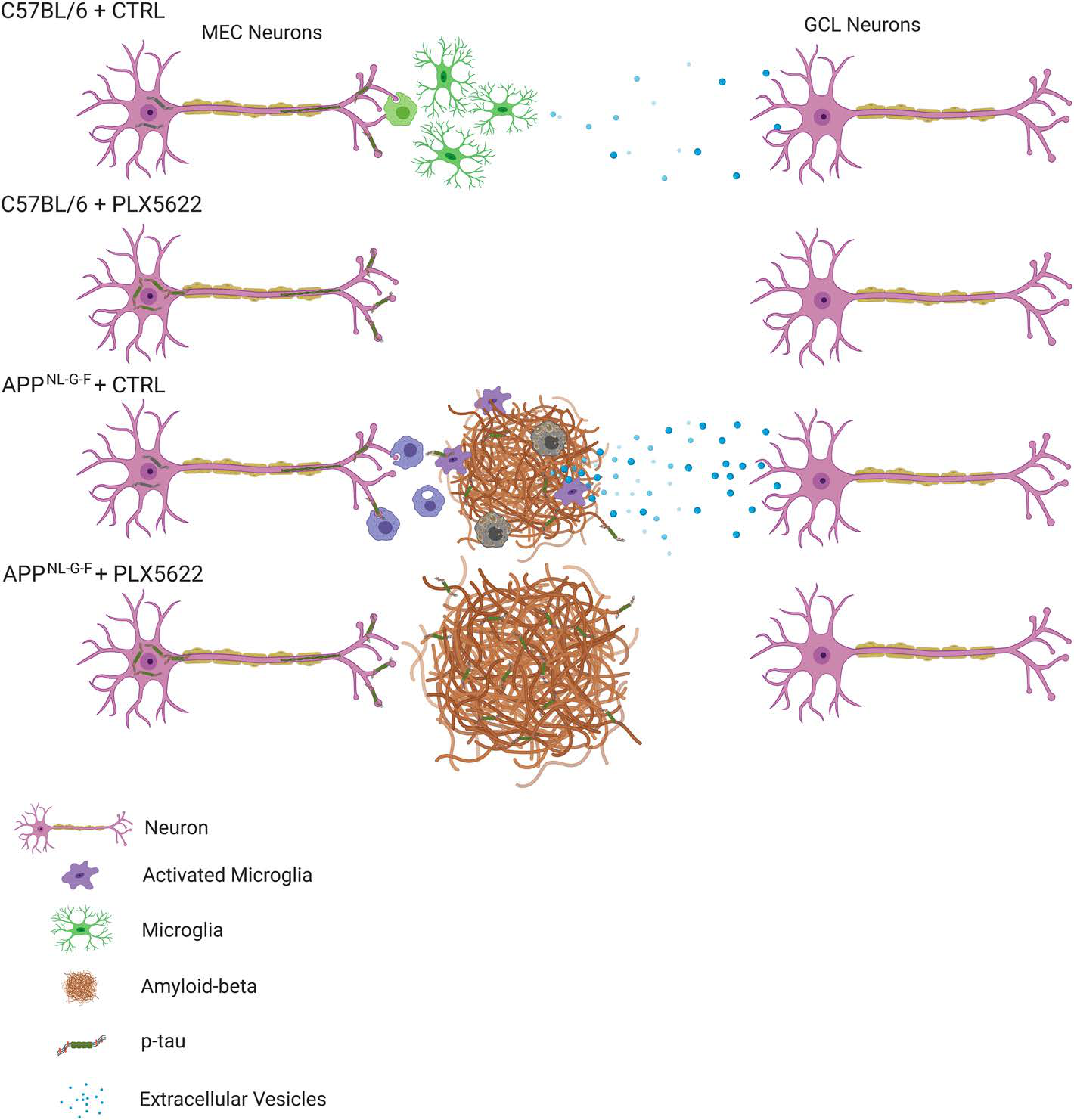
小胶质细胞是中枢神经系统的免疫细胞,最近有研究发现一类疾病激活的小胶细胞(MGnD),这种细胞受TREM2和ApoE调节,破坏CNS的稳态。但是目前对于MGnD小胶细胞对神经退行性疾病的作用仍然存在争议,且尚不确定在存在Aβ淀粉样斑块沉积的情况下,小胶质细胞是否加速对tau的传播。因此作者选择性清除小胶细胞后验证小胶细胞在tau病理发展过程中的作用。
【结果】
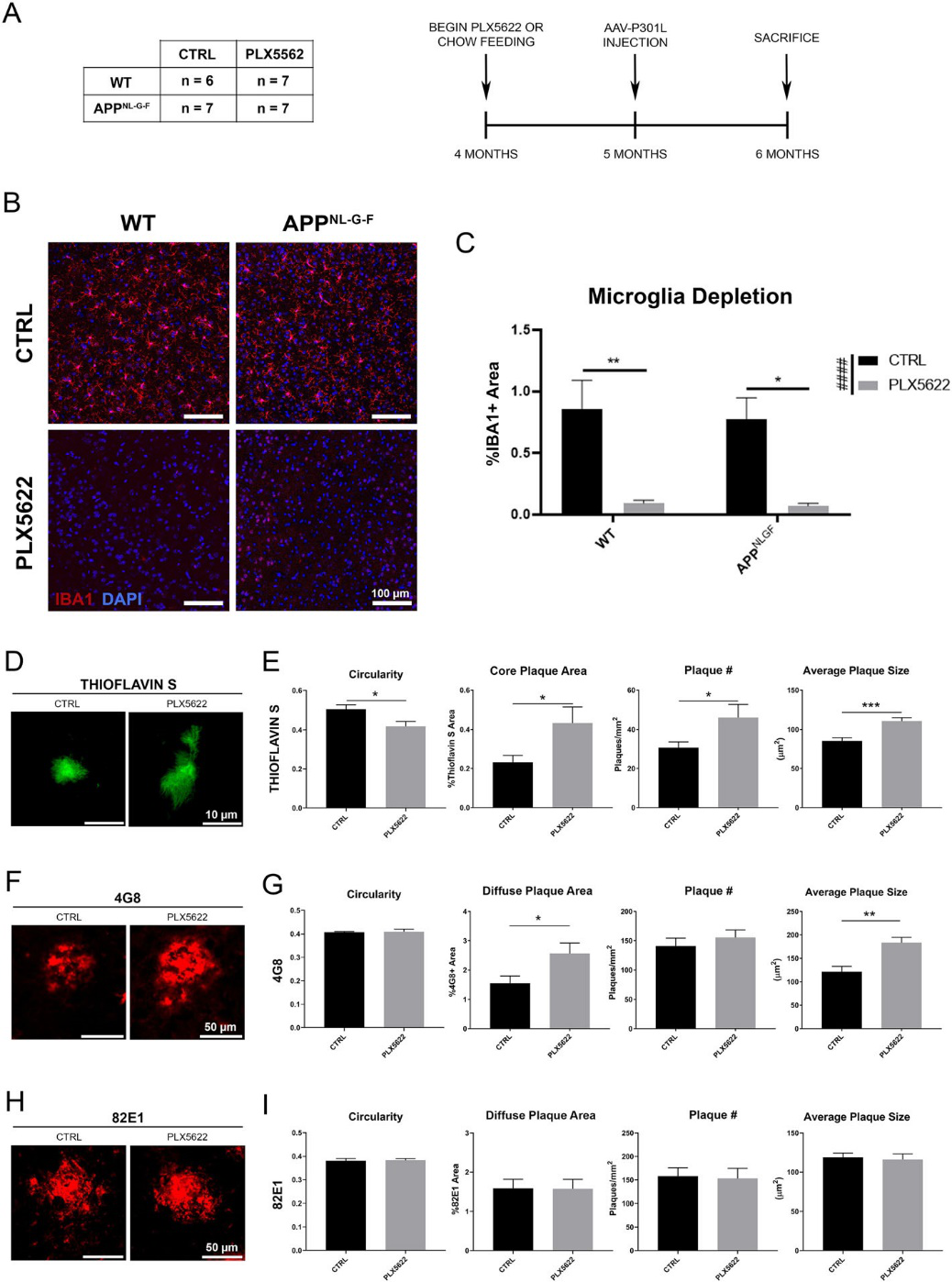
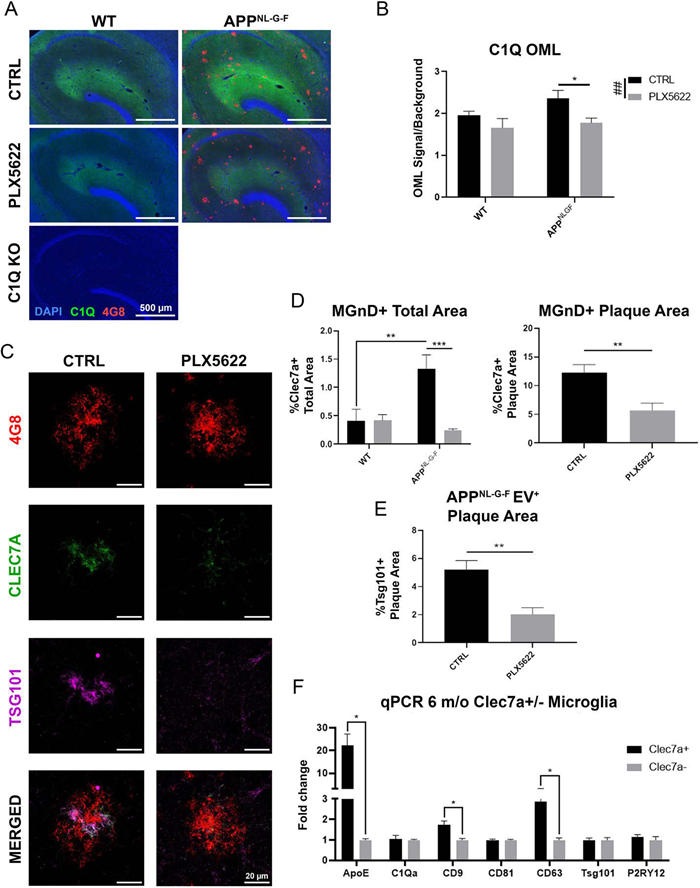
PLX5622给药2个月后能消耗93%以上的小胶质细胞(标志蛋白IBA1),同时小胶质的消耗会引起Aβ 斑块紧密性降低,但增加了其大小、数量和面积。但并不影响AppNL-G-F 小鼠脑中Aβ 斑块周围星形胶质细胞的增加。表明AppNL-G-F 小鼠脑中小胶质细胞影响着Aβ 斑块的形成及紧密性。
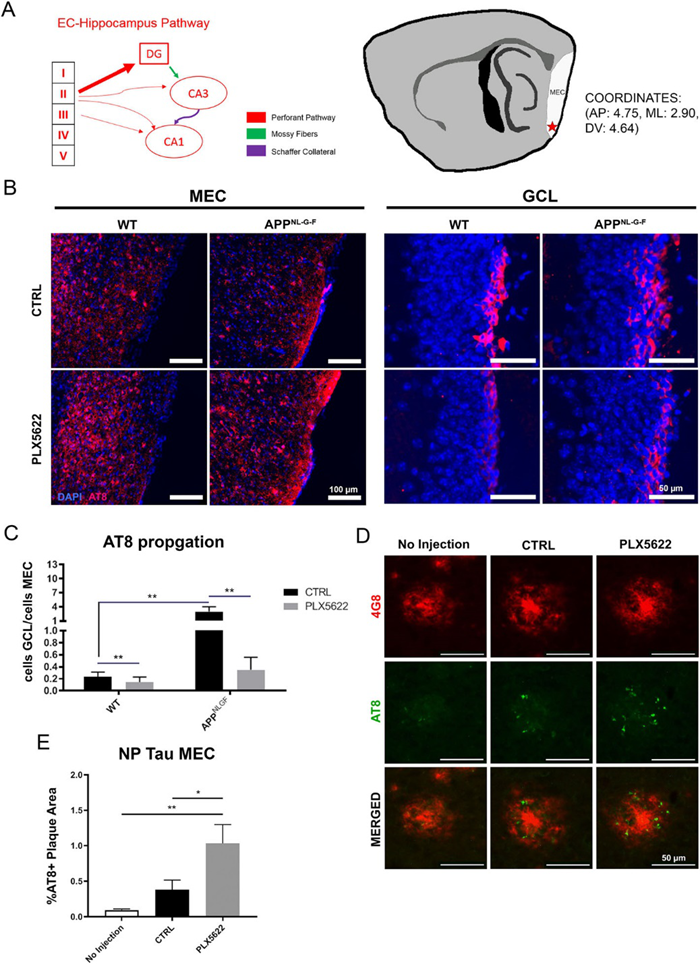
但在AppNL-G-F小鼠脑中清除小胶细胞后,小胶质细胞来源的C1q表达水平显著降低,表明小胶质细胞衍生的蛋白质不参与上述过程。通过IF分析荧光标记MGnD的Clec7A和EVs的TSG101,发现它们共定位于MGnD中,且随PLX5622的处理均减少。另外Clec7A+的MGnD显著表达EV的标志蛋白如CD9和CD63,意味着MGnD能大量分泌EVs。表明MGnD小胶细胞吞噬NP tau,过度分泌EVs,增加tau的传播。
进一步验证MGnD小胶细胞比正常小胶细胞释放更多的EVs,作者开发了表达mE-CD9融合蛋白的特异性慢病毒。体内定量分析了MGnD小胶细胞和稳态小胶细胞释放VEs的数量,结果表明:Aβ斑块诱发的MGnD小胶细胞释放更多的EVs。
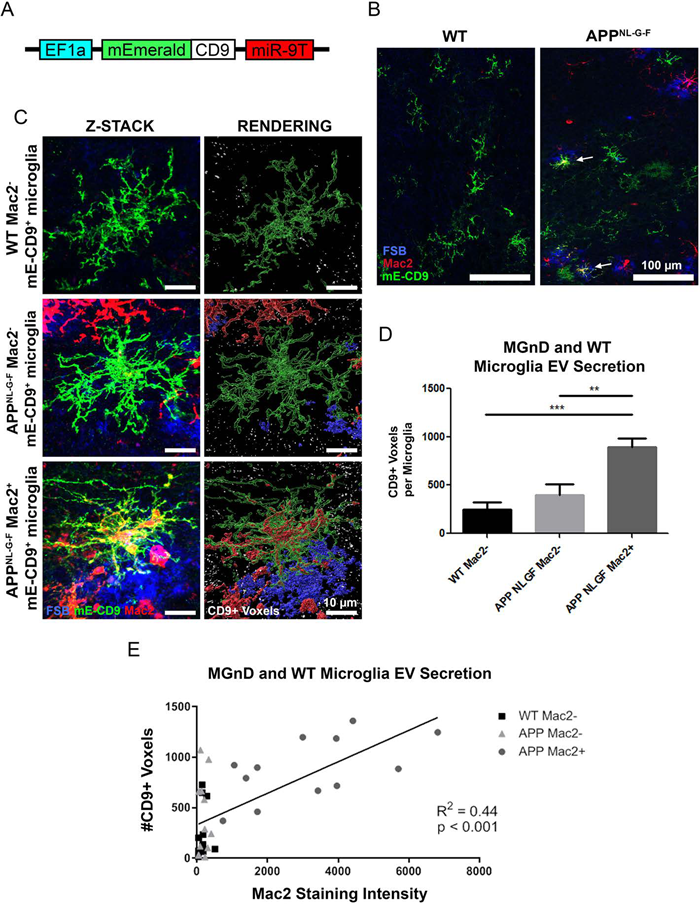
MGnD小胶细胞释放更多的EVs,那么EVs可能包裹p-tau蛋白。作者在联合使用mE-CD9和 AAV-P301L-tau,借助IF实验证明MGnD小胶细胞来源的EVs包裹更多的p-tau蛋白。从分离出EVs进行进一步验证,MGnD小胶细胞来源的EVs数量是稳态小胶细胞的三倍,而且包裹更多的p-tau蛋白。表明小胶质细胞分泌的EV携带tau种子,且这种现象因小胶质细胞转变为MGnD而增强。