研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
小胶细胞来源的细胞外囊泡激活自噬,介导多个信号通路维持细胞稳态
903 人阅读发布时间:2021-07-19 16:10

【关键词】RNA-seq、自噬、细胞稳态、小胶质细胞、细胞外囊泡、免疫、炎症基因
【摘要】小胶质细胞是中枢神经系统中的免疫细胞,在维持细胞稳态中有重要作用,小胶细胞可分泌纳米囊泡在内的免疫调节因子,发挥吞噬和自噬功能清除细胞碎片。sEVs参与细胞间交流,但是小胶细胞来源的细胞外囊泡(M-EVs)对于小胶细胞稳态以及对其他小胶细胞的的表型和基因功能尚不清楚。
体外分析有/无TNF-α刺激的小胶细胞来源的M-EVs的作用,检测自噬变化。利用RNA-seq分析了M-EVs刺激小胶细胞后下游的基因谱变化、上游调节因子、富集的通路,结果表明神经炎症、炎症小体、凋亡相关通路发生变化,不仅如此EVs还可通过调节自噬维持细胞稳态。

【前言】中枢神经系统(CNS)中细胞间交流对于维持稳态非常重要。胶质细胞可维持CNS的神经发育和修复,其中小胶质细胞是中枢神经系统中的免疫细胞,可分泌因子调节神经免疫,同时也可为神经元提供营养支持,清除髓鞘碎片等。细胞外囊泡(EVs)介导胶质-神经元之间的交互作用,有研究表明小胶细胞来源的细胞外囊泡(M-EVs)在髓鞘病变区既有保护作用,也会发挥损害作用,提示M-EVs可调节不同细胞的生物学过程。
EVs可通过递送蛋白、脂质、核酸等物质至受体细胞发挥作用。神经元来源的EVs可调节小胶细胞的自噬过程,而自噬过程是维持中枢神经稳态的重要环节。EVs可用于治疗免疫相关疾病和神经退行性疾病,但是促炎小胶细胞是如何通过影响其他小胶细胞的表型和基因功能的机制尚不清楚,因此本文分离了两种M-EVs(nEVs和aEVs),分别来源于未激活的小胶细胞和TNF-α激活的小胶细胞,检测这两种M-EVs对小鼠BV2、人CD20、原代小胶细胞等的影响,同时分析自噬、细胞存活、炎症和免疫转录谱在其中的作用。
【结果】
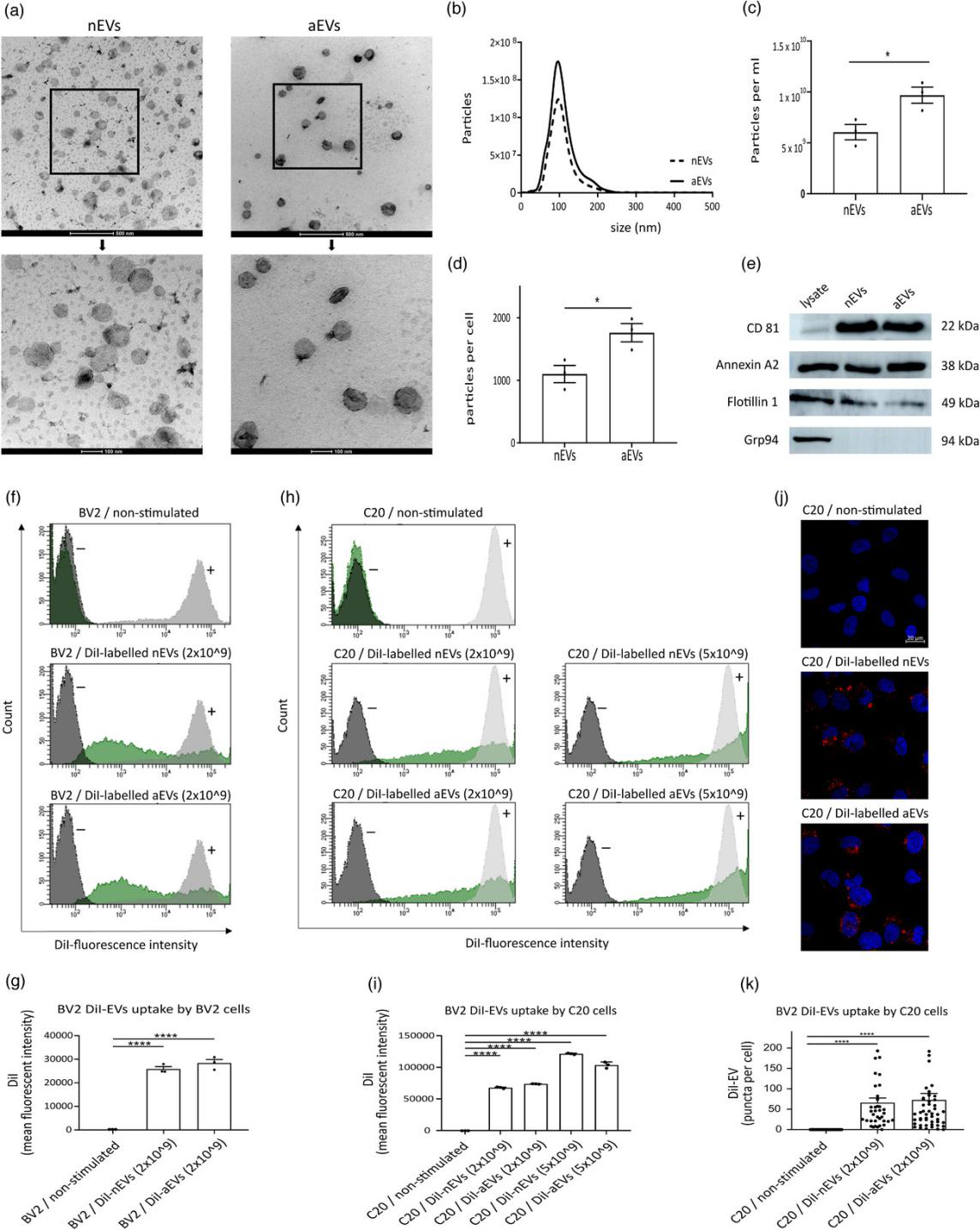
首先表征胶质细胞来源的小细胞外囊泡(nEVs和aEVs)。电镜、纳米追踪分析检测大小和形态,WB检测EV相关marker(CD81、Annexin A2、Flotillin1阳性,Grp94阴性)。检测M-EVs被细胞的摄取情况,用DiI标记EVs,利用流式和共聚焦显微镜观察不同小胶质细胞系对EVs的摄取。结果显示:M-EVs均可被小胶细胞摄取。
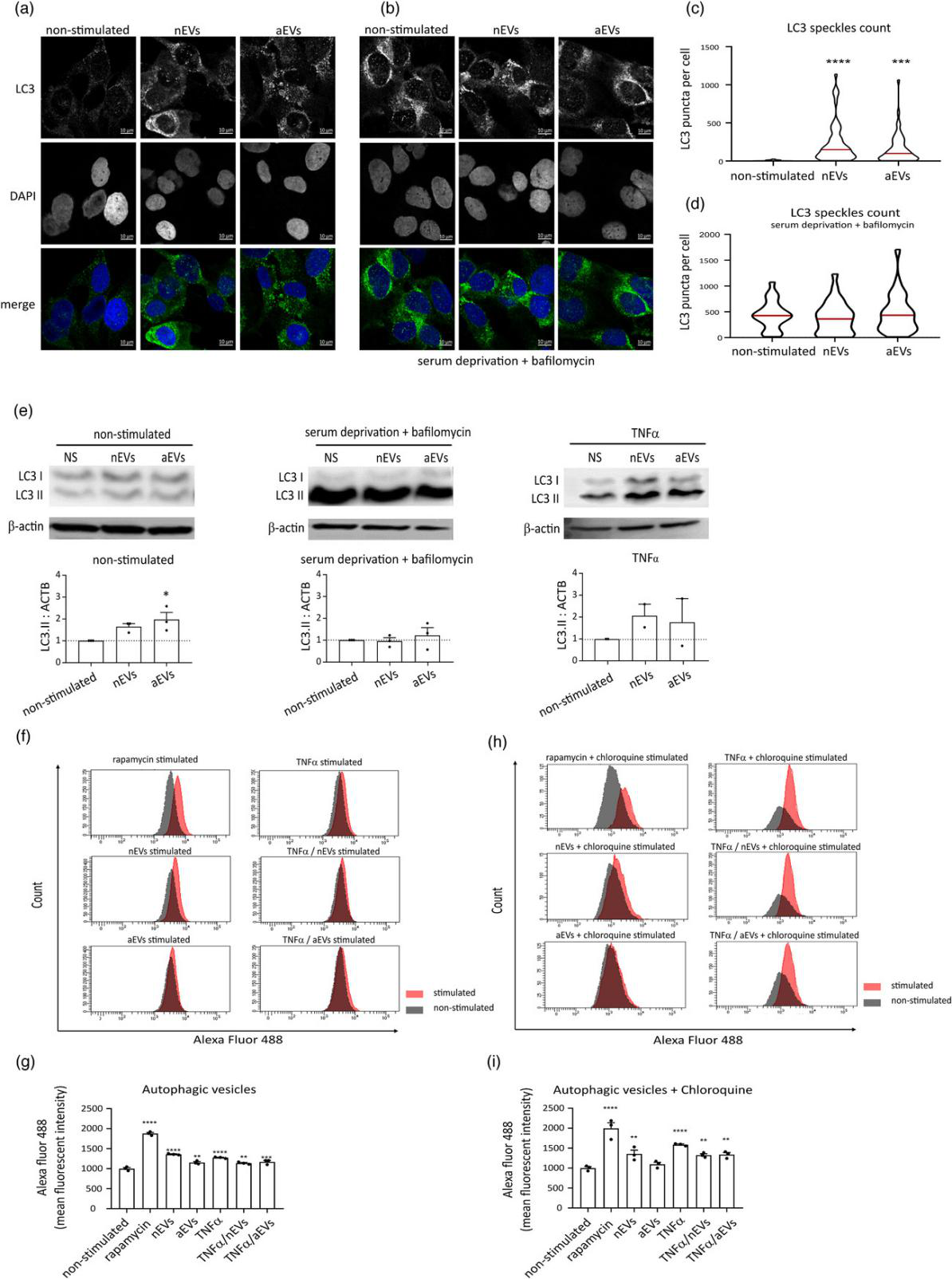
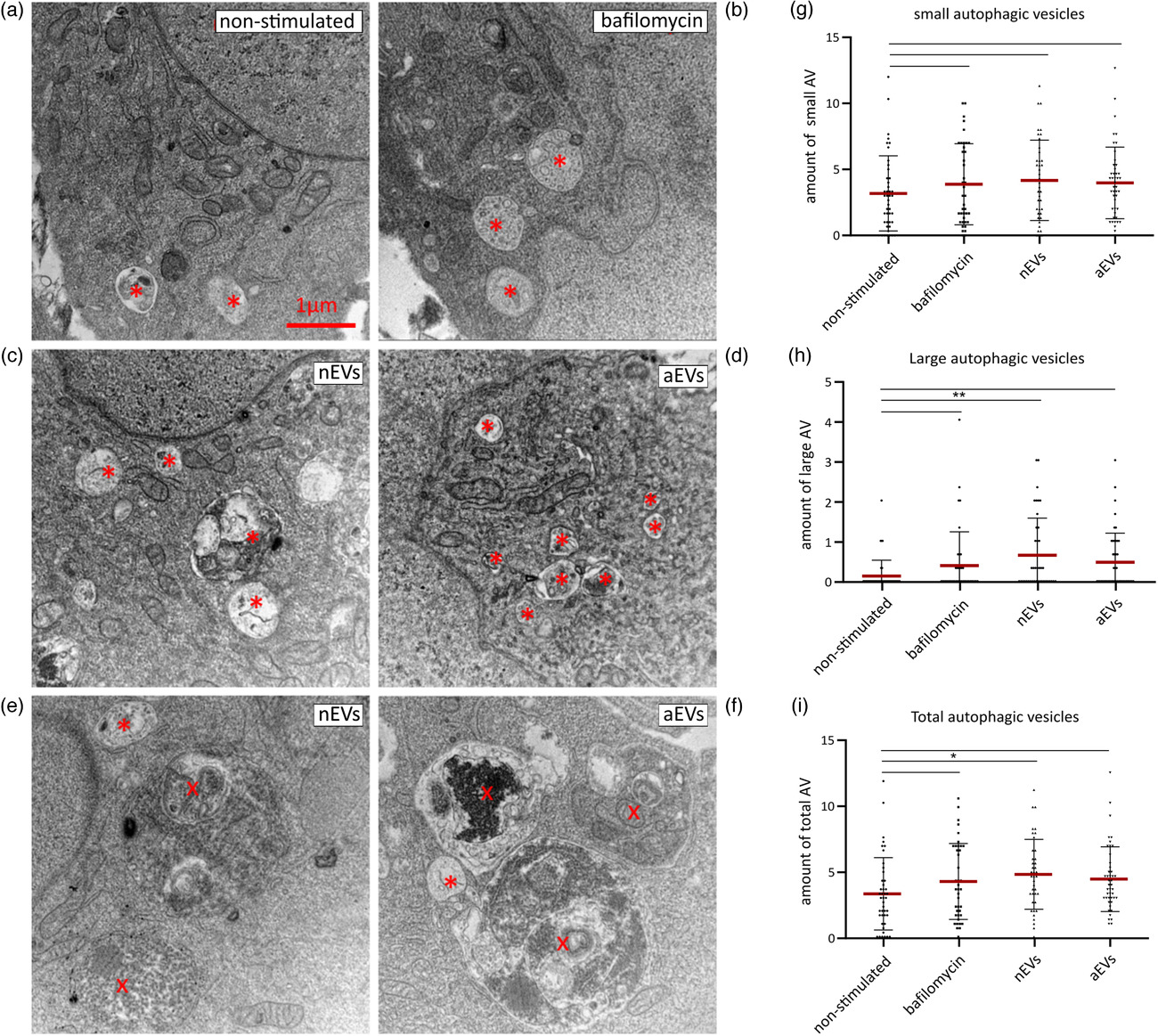
在BV2小胶细胞和原代小胶细胞中检测M-EVs对自噬的调节。将M-EVs与不同的小胶细胞共培养后进行免疫荧光检测自噬marker(MAP1LC3/LC3),将缺血培养、自噬诱导剂作为阳性对照,溶酶体阻滞剂作为阴性对照。用试剂盒检测自噬通量改变。结果显示:M-EVs通过在小胶细胞中形成自噬小体来激活自噬过程,维持细胞稳态。
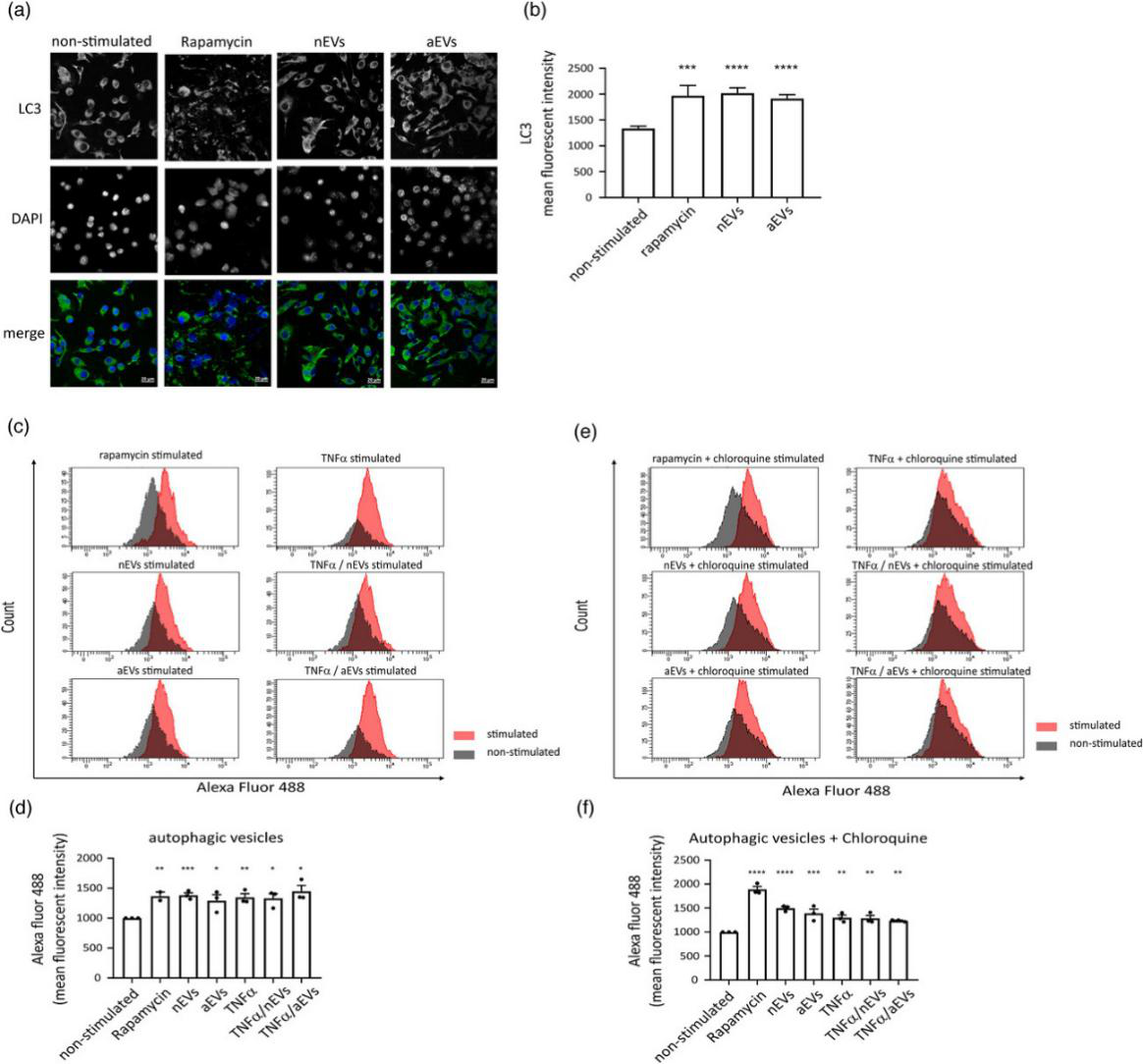
检测M-EVs对自噬囊泡的影响。结果显示:M-EVs在体外可诱导小胶细胞的自噬。
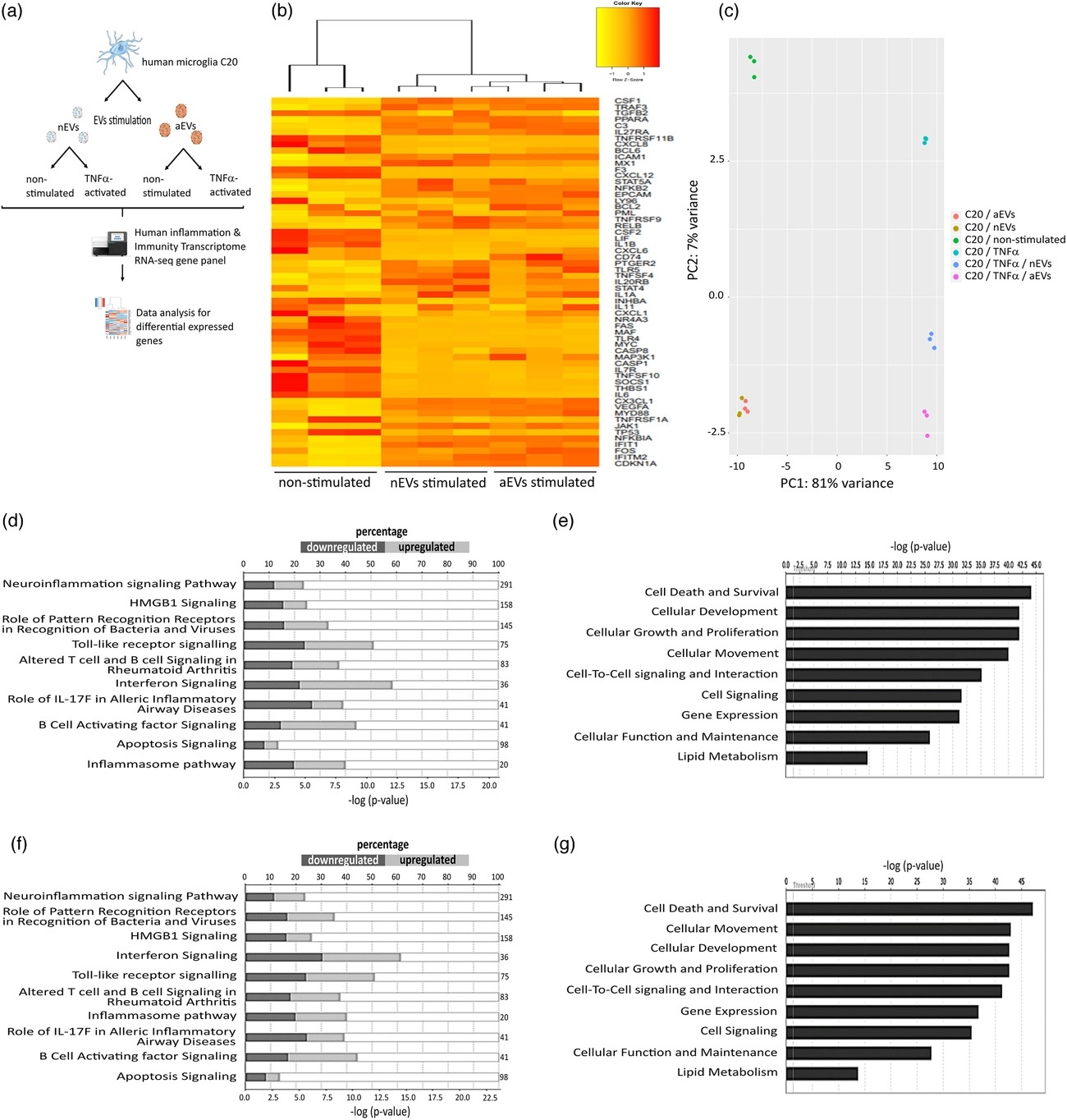
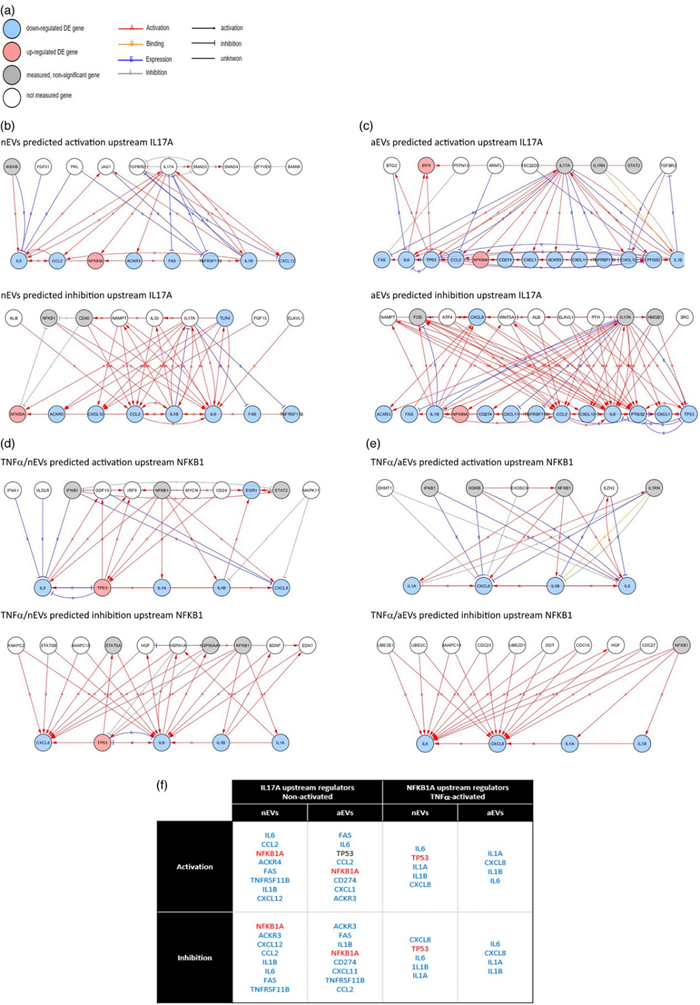
利用RNA-seq检测M-EVs处理后小胶细胞基因变化,主成分分析(PCA)小胶细胞暴露于M-EVs(nEVs和aEVs)后转录水平基因变化,并且对差异基因进行无监督分层聚类分析,利用du chuang性途径分析IPA预测基因下游的信号通路。结果表明:M-EVs可影响小胶细胞多个基因和生物学过程,调节神经炎症、细胞死亡和存活。
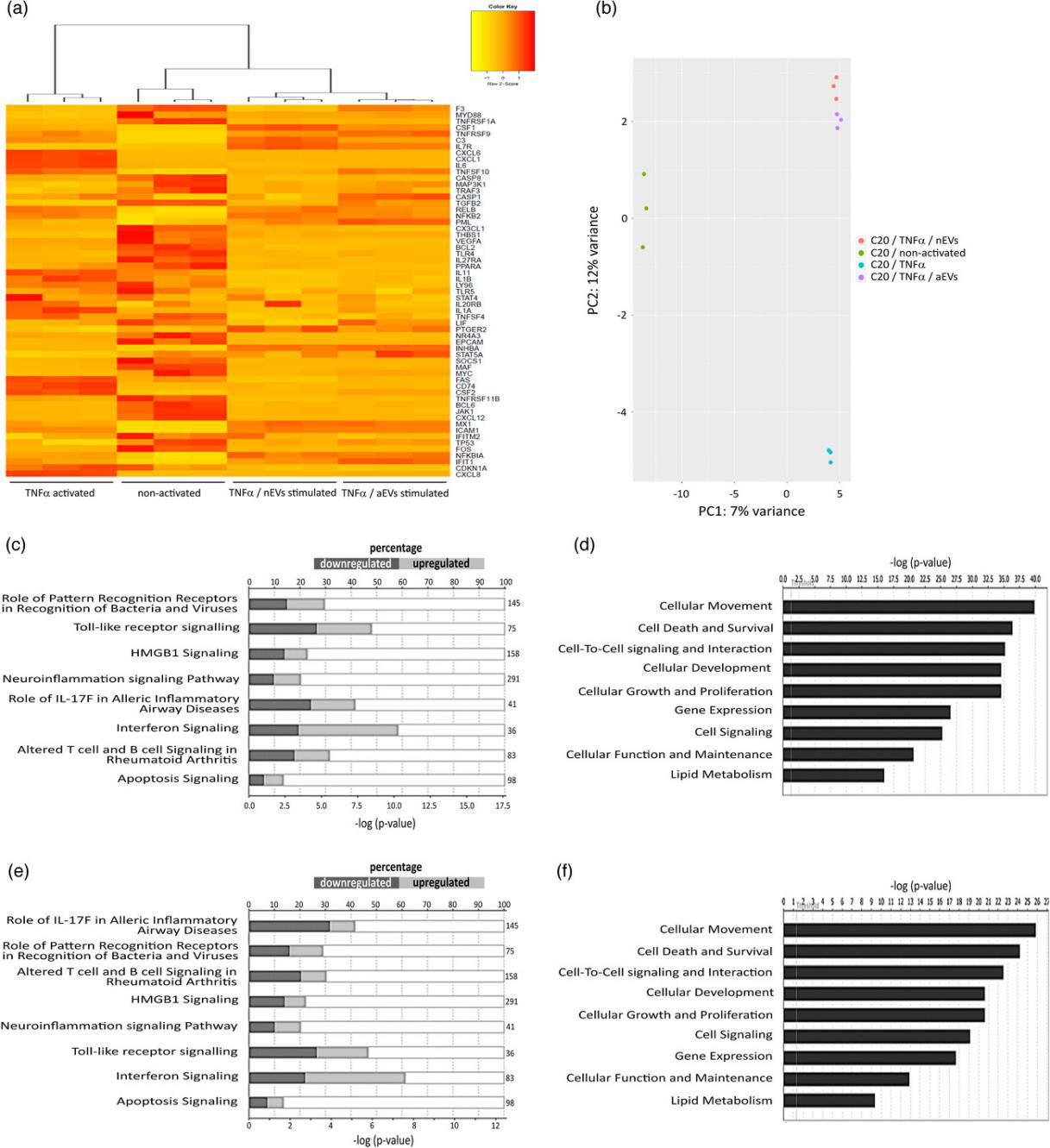
对M-EVs处理的TNFα激活的小胶细胞进行RNA-seq分析,分析差异基因,进行聚类分析和IPA预测上游调控。
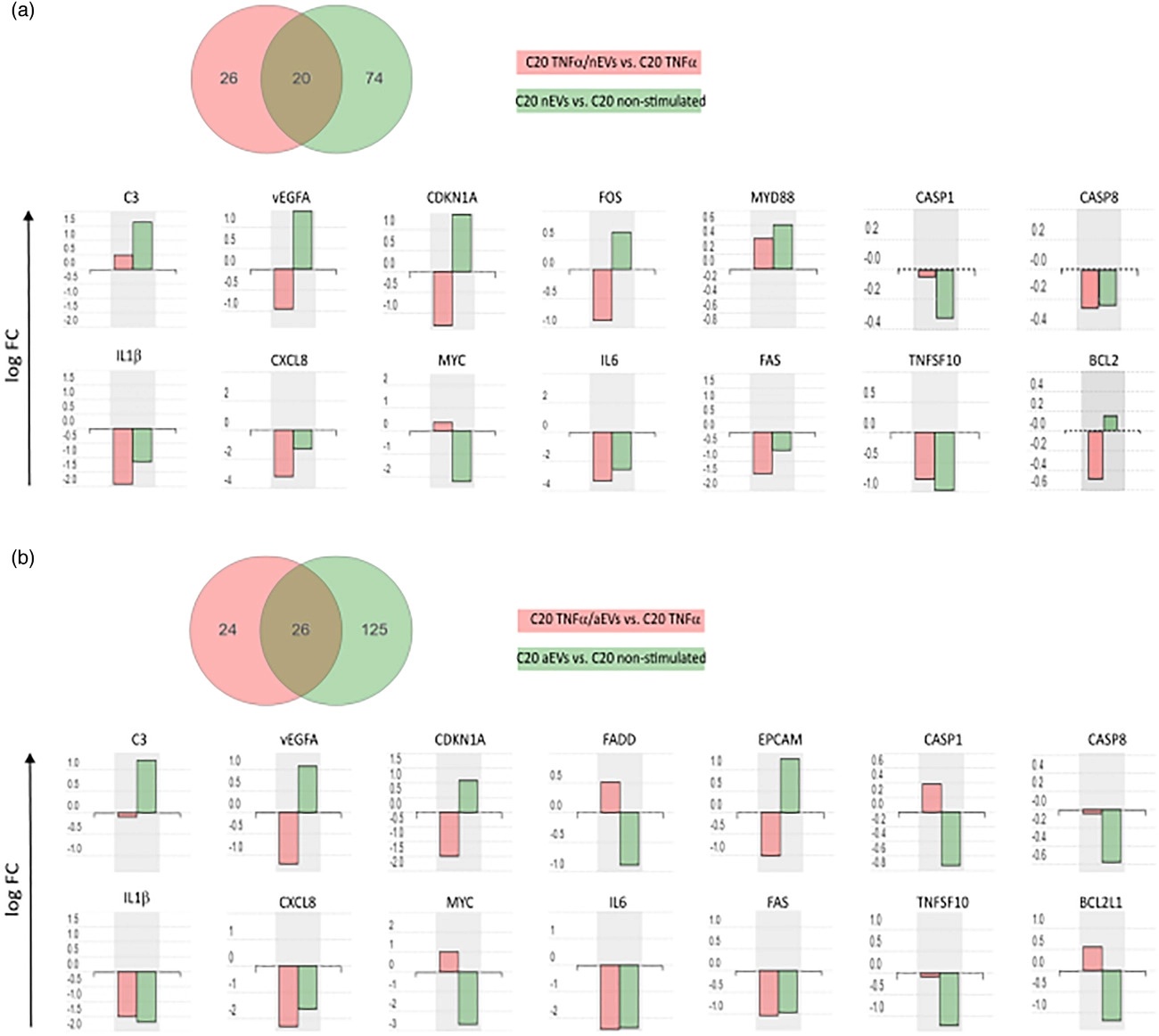
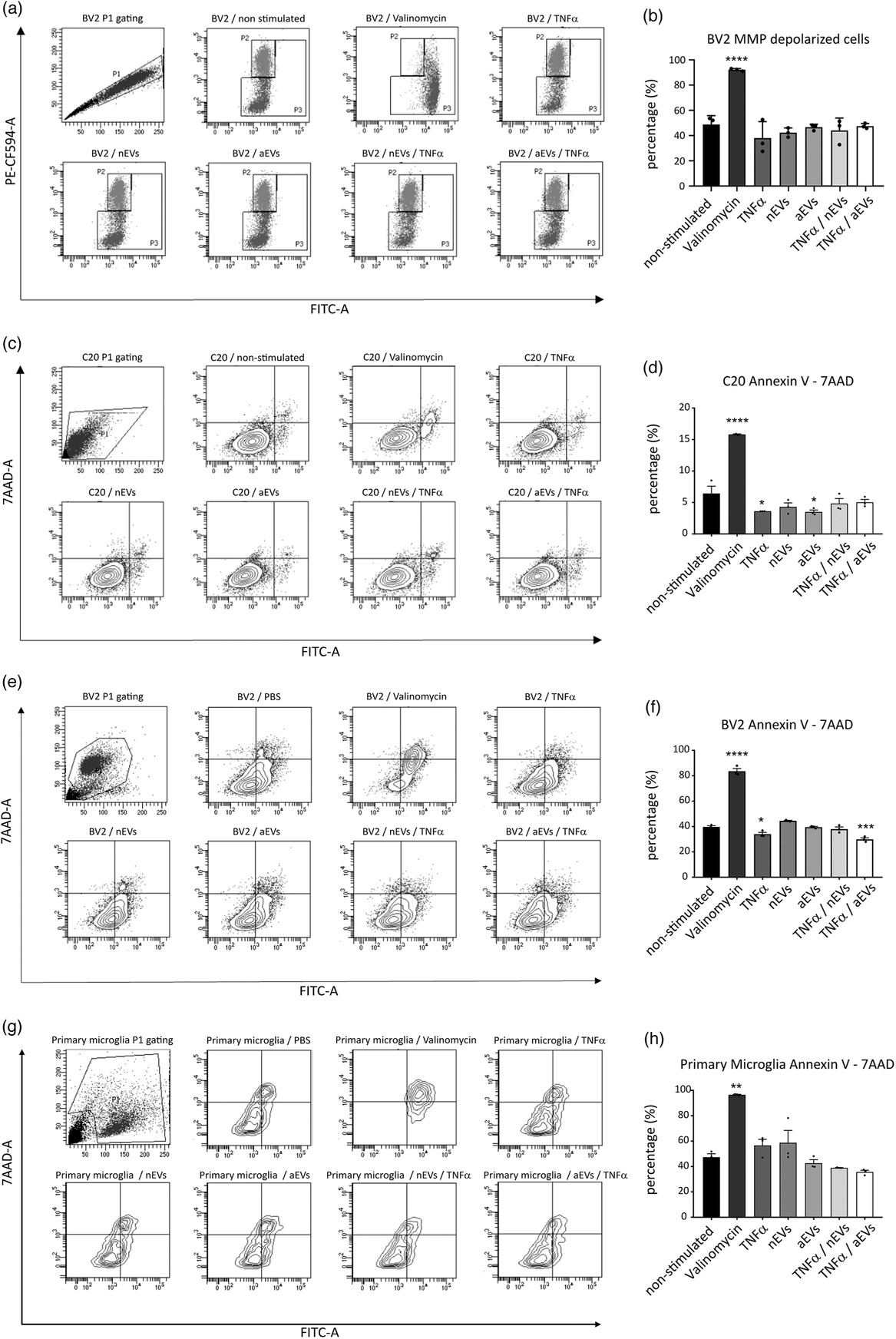
进一步用PCR和ELISA验证参与神经炎症、细胞死亡和存活相关基因和信号通路,WB检测细胞坏死相关指标验证M-EVs不会明显诱导细胞死亡。
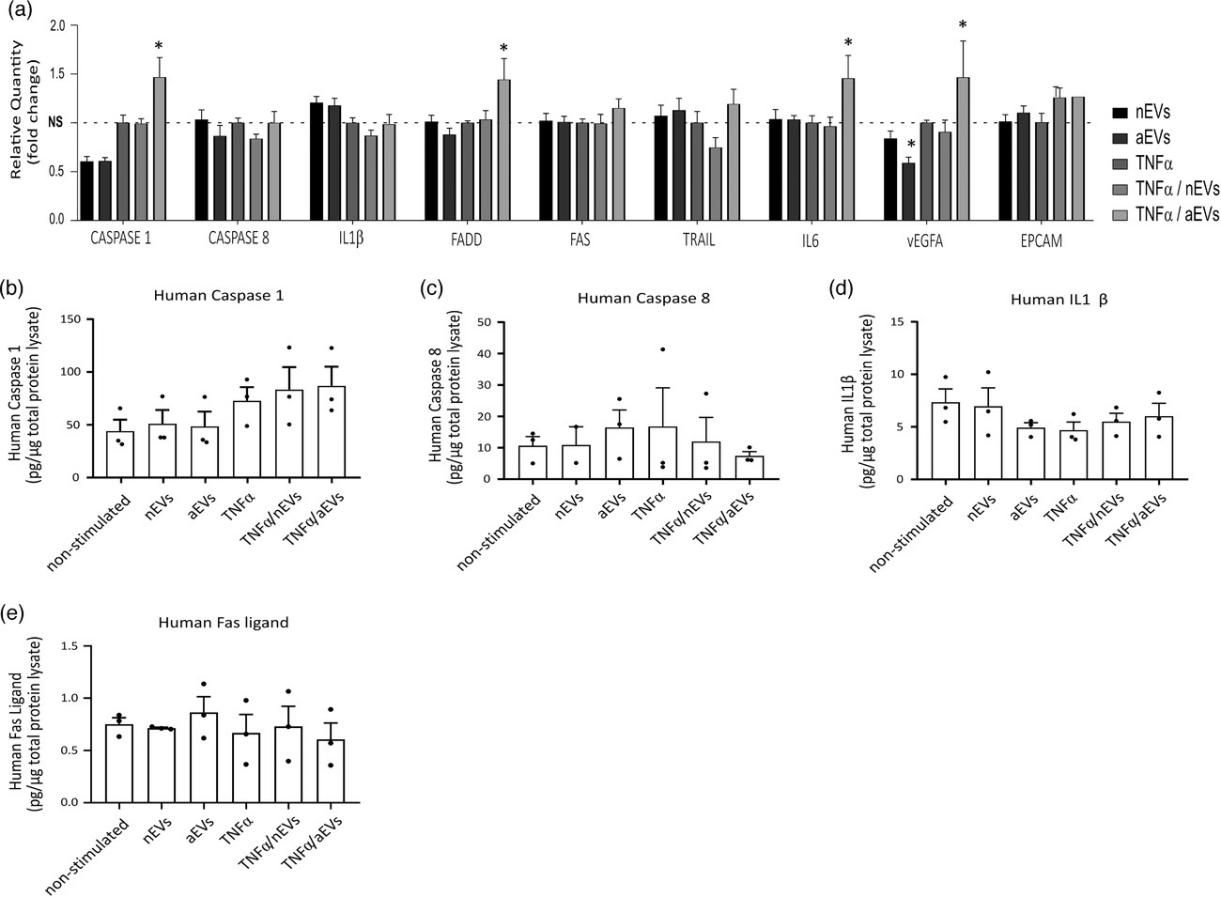
分别检测凋亡相关指标评估M-EVs对凋亡影响。WB检测凋亡相关蛋白,JC1染料检测线粒体功能,流式检测M-EVs处理的细胞凋亡情况,检测线粒体膜电位评估早期凋亡指标。结果表明:M-EVs对不会在体外引起细胞明显凋亡。