研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Panx1-P2X4轴调控HCV感染的肝细胞分泌外泌体
606 人阅读发布时间:2021-08-03 10:07
【关键词】丙肝病毒HCV、外泌体、miRNA、嘌呤受体、Pannexin泛连接蛋白
 【摘要】丙肝病毒感染是导致慢性肝病的主要危险因素,包括纤维化、肝硬化和肝癌。HCV感染肝细胞,调节其外泌体和miRNA的释放,影响实质细胞和非实质细胞间的通讯来促进肝脏疾病的发生。本研究发现肝细胞HCV感染期间通过caspase-3/Panx1/P2X4激活释放外泌体和外泌体miRNA的新途径,为HCV感染的肝病提供潜在的治疗靶点。
【摘要】丙肝病毒感染是导致慢性肝病的主要危险因素,包括纤维化、肝硬化和肝癌。HCV感染肝细胞,调节其外泌体和miRNA的释放,影响实质细胞和非实质细胞间的通讯来促进肝脏疾病的发生。本研究发现肝细胞HCV感染期间通过caspase-3/Panx1/P2X4激活释放外泌体和外泌体miRNA的新途径,为HCV感染的肝病提供潜在的治疗靶点。
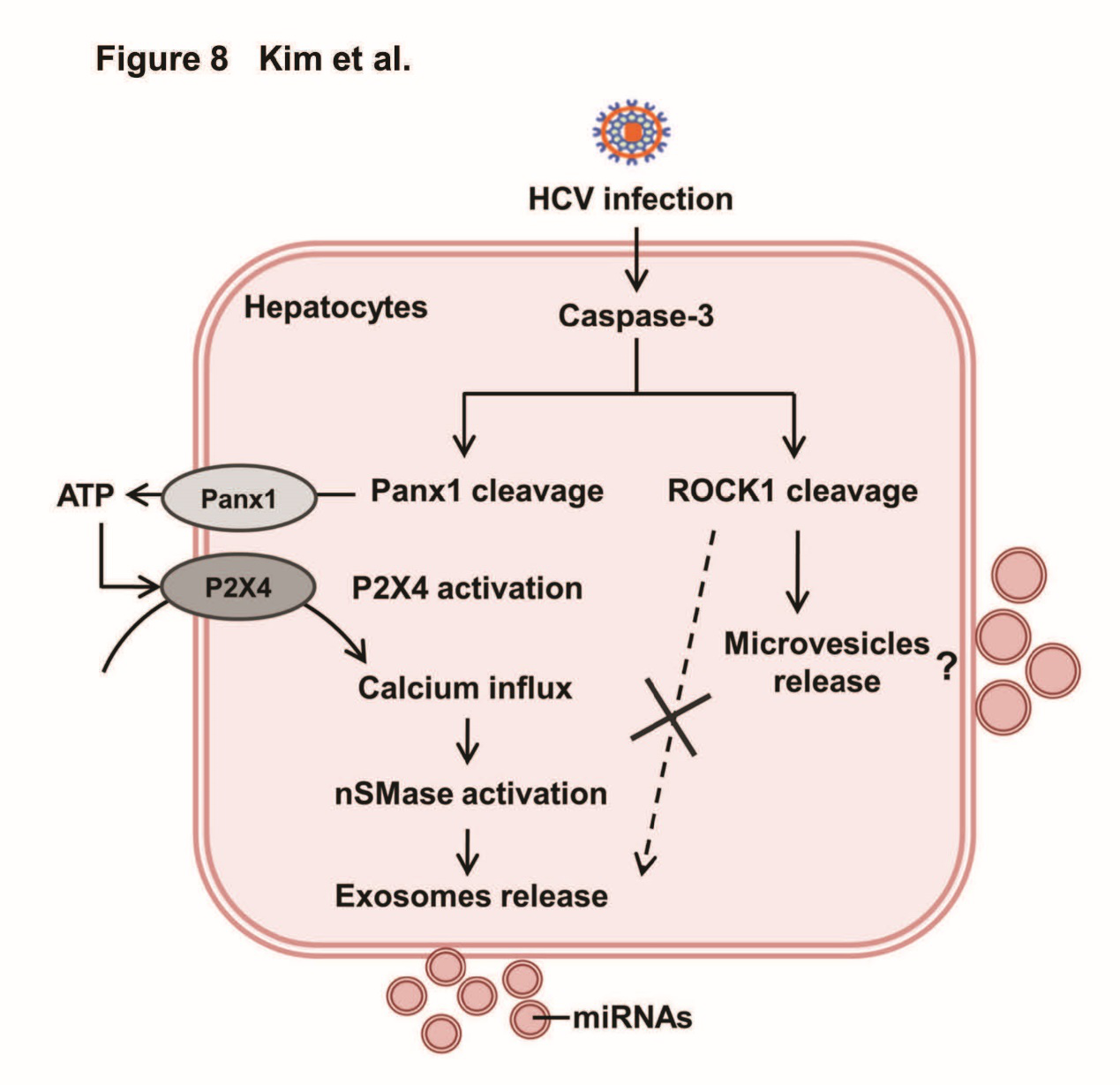 【前言】细胞通过分泌外泌体实现细胞间的通讯,在病毒感染的细胞中也不例外。HCV感染后的肝细胞通过增加外泌体的释放来促进肝脏疾病的发展,其中HCV感染的肝细胞释放的外泌体可导致巨噬细胞的极化和分化、介导星状细胞促纤维化反应、T滤泡调节细胞的扩增。这些充分说明外泌体在肝病发展过程中有着重要作用,但是HCV感染状态下肝细胞产生和释放外泌体的机制仍有待研究。外泌体的释放受应激信号影响,例如DNA损伤、细胞内Ca水平、细胞外ATP水平,Panx1是介导ATP释放的跨膜通道,因此Panx1通路可能与外泌体的释放相关,因此本文着重研究Panx1通路在HCV感染的肝细胞释放外泌体的过程中的作用。
【前言】细胞通过分泌外泌体实现细胞间的通讯,在病毒感染的细胞中也不例外。HCV感染后的肝细胞通过增加外泌体的释放来促进肝脏疾病的发展,其中HCV感染的肝细胞释放的外泌体可导致巨噬细胞的极化和分化、介导星状细胞促纤维化反应、T滤泡调节细胞的扩增。这些充分说明外泌体在肝病发展过程中有着重要作用,但是HCV感染状态下肝细胞产生和释放外泌体的机制仍有待研究。外泌体的释放受应激信号影响,例如DNA损伤、细胞内Ca水平、细胞外ATP水平,Panx1是介导ATP释放的跨膜通道,因此Panx1通路可能与外泌体的释放相关,因此本文着重研究Panx1通路在HCV感染的肝细胞释放外泌体的过程中的作用。
【结果】
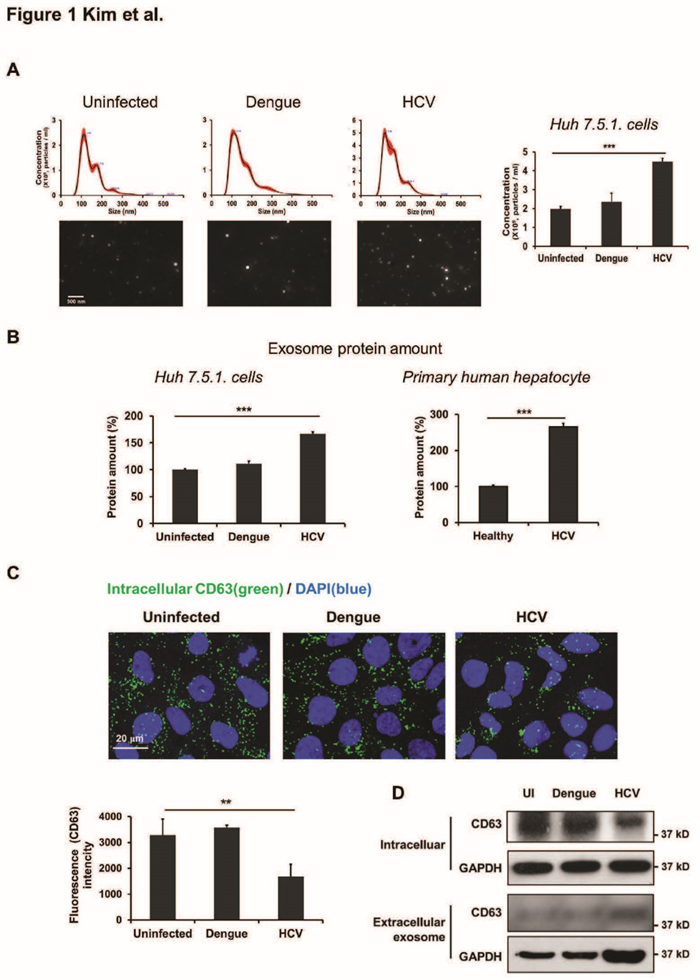
首先检测了外泌体数量和蛋白含量,细胞内外泌体的标志物CD63蛋白表达,验证HCV感染下肝细胞释放外泌体量增加,将登革热病毒感染作为对照。
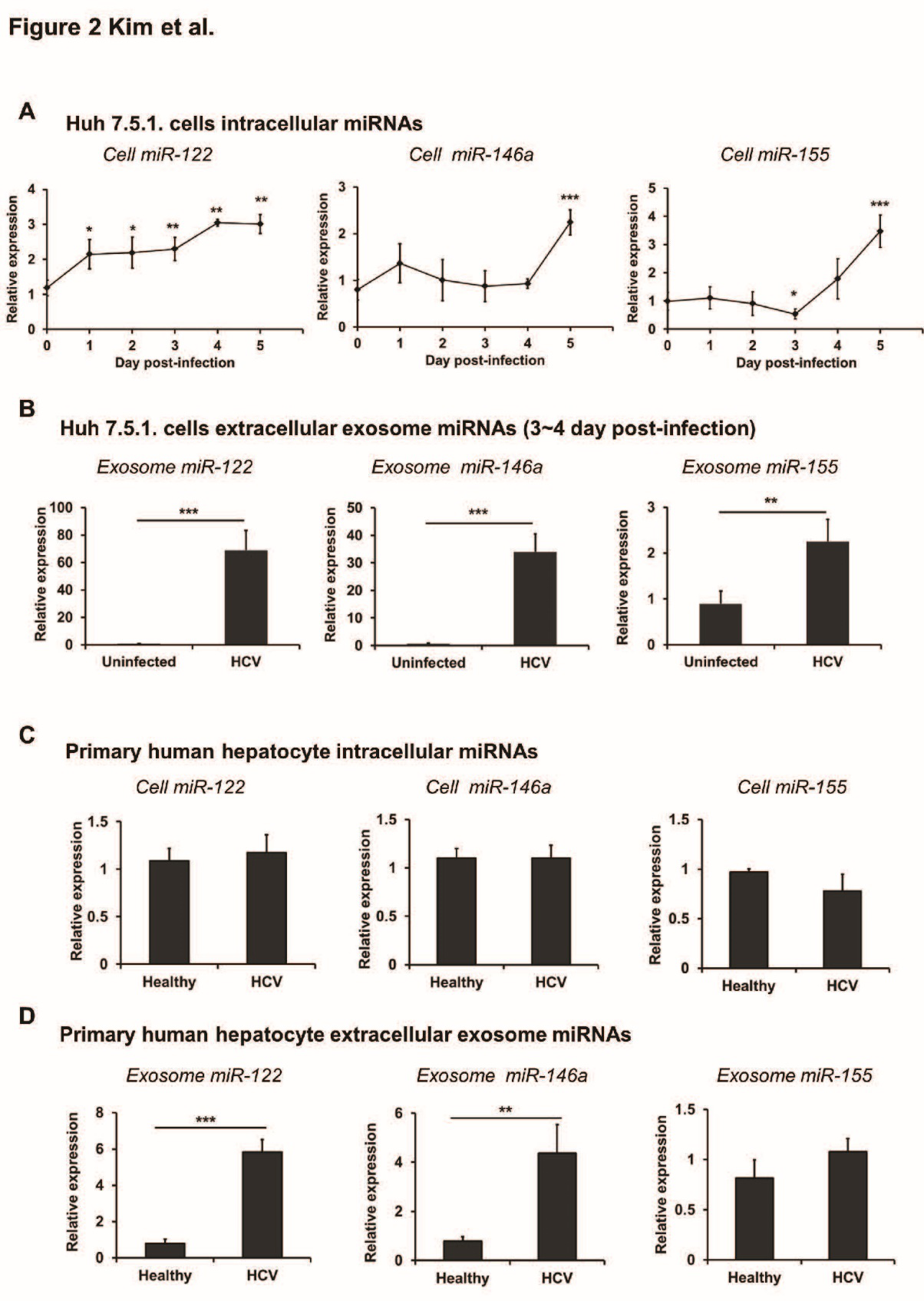
 外泌体通过递送miRNA介导细胞间通讯,因此检测HCV感染下miRNA的释放,结果表明:HCV感染的肝细胞释放的外泌体中miR122、miR146a增加。
外泌体通过递送miRNA介导细胞间通讯,因此检测HCV感染下miRNA的释放,结果表明:HCV感染的肝细胞释放的外泌体中miR122、miR146a增加。
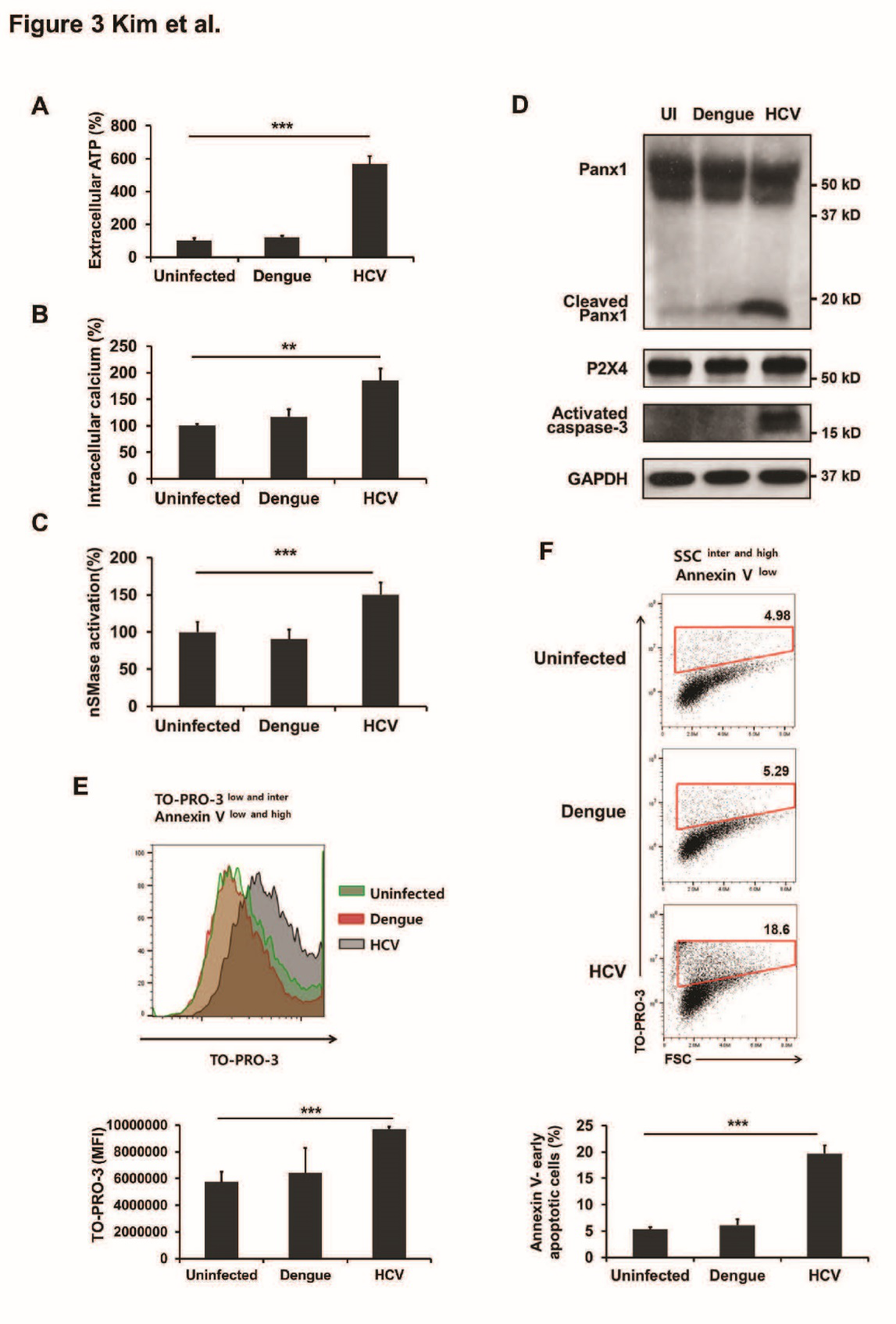
 探究HCV感染下肝细胞中外泌体形成和释放的分子机制。通常MVB的形成有ESCRT和Rab蛋白通路,但实验结果证实HCV感染下的肝细胞对上述两条通路影响不大。ATP和Ca通量的水平影响MVB的形成和释放,因此检测感染HCV的肝细胞中ATP释放和Ca通量变化,Panx1和P2X受体的表达变化。结果表明HCV感染与Panx1和P2X4通路正相关。通常Panx1在细胞凋亡的早期阶段会影响caspase3来改变ATP的释放,因此检测HCV感染的肝细胞Panx1和caspase3蛋白变化,结果表明:HCV感染肝细胞后在早期凋亡阶段会导致caspase3介导的Panx1裂解和P2X4的激活。
探究HCV感染下肝细胞中外泌体形成和释放的分子机制。通常MVB的形成有ESCRT和Rab蛋白通路,但实验结果证实HCV感染下的肝细胞对上述两条通路影响不大。ATP和Ca通量的水平影响MVB的形成和释放,因此检测感染HCV的肝细胞中ATP释放和Ca通量变化,Panx1和P2X受体的表达变化。结果表明HCV感染与Panx1和P2X4通路正相关。通常Panx1在细胞凋亡的早期阶段会影响caspase3来改变ATP的释放,因此检测HCV感染的肝细胞Panx1和caspase3蛋白变化,结果表明:HCV感染肝细胞后在早期凋亡阶段会导致caspase3介导的Panx1裂解和P2X4的激活。
 Loss of function从逻辑上验证HCV感染的肝细胞释放外泌体依赖于caspase3。用caspase3抑制剂处理病毒感染后的肝细胞,分别检测外泌体的释放量、特定miRNA的表达量、ATP的释放、细胞内Ca的水平以及Panx1的表达。结果表明:HCV感染的肝细胞释放外泌体和相应miRNA依赖于caspase3。
Loss of function从逻辑上验证HCV感染的肝细胞释放外泌体依赖于caspase3。用caspase3抑制剂处理病毒感染后的肝细胞,分别检测外泌体的释放量、特定miRNA的表达量、ATP的释放、细胞内Ca的水平以及Panx1的表达。结果表明:HCV感染的肝细胞释放外泌体和相应miRNA依赖于caspase3。
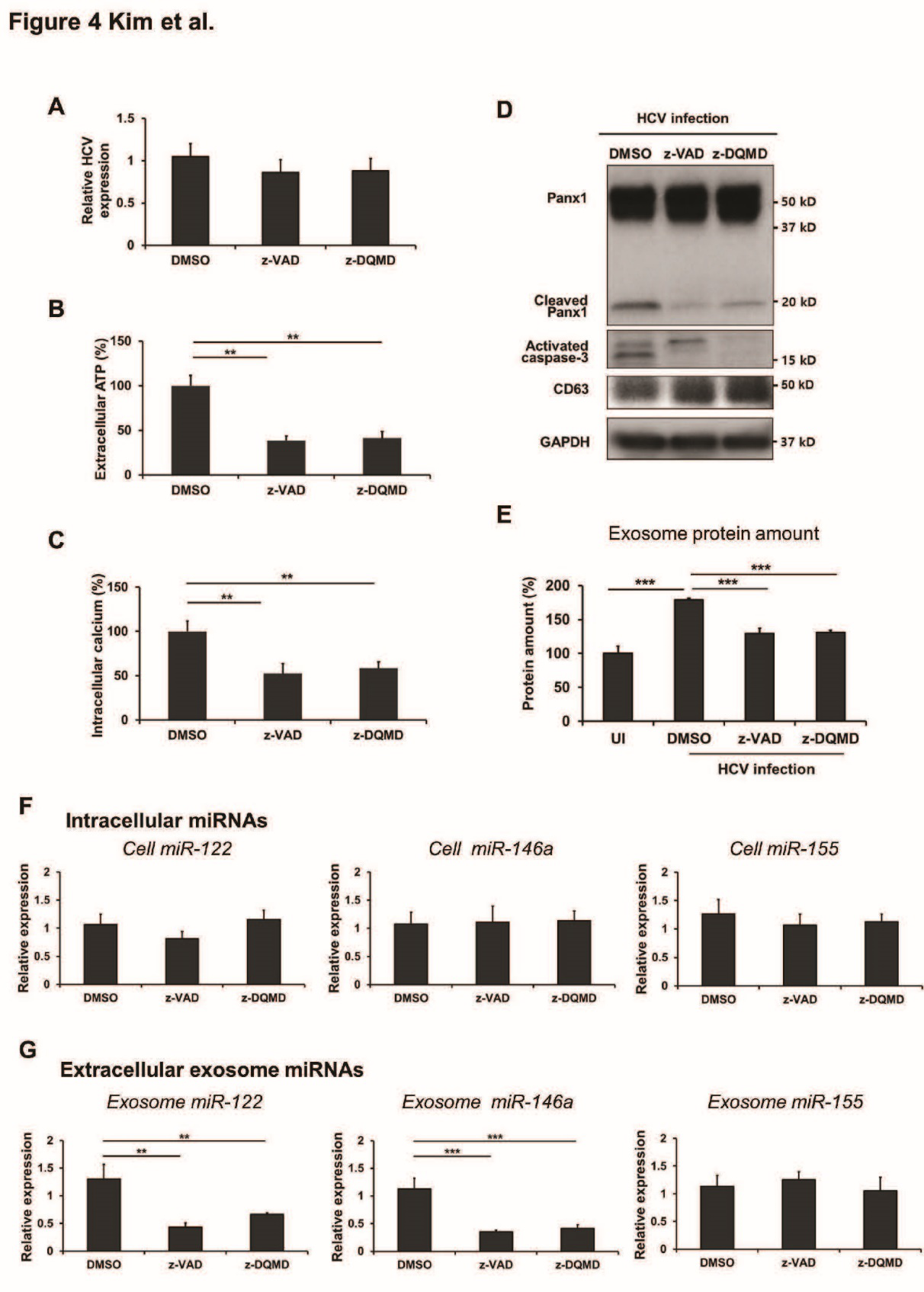 Loss of function从逻辑上验证Panx1和P2X4在HCV感染的肝细胞外泌体释放中的作用。通过药理学方法利用抑制剂、转基因方法利用siRNA分别抑制Panx1和P2X4来验证二者在外泌体释放中的作用。
Loss of function从逻辑上验证Panx1和P2X4在HCV感染的肝细胞外泌体释放中的作用。通过药理学方法利用抑制剂、转基因方法利用siRNA分别抑制Panx1和P2X4来验证二者在外泌体释放中的作用。
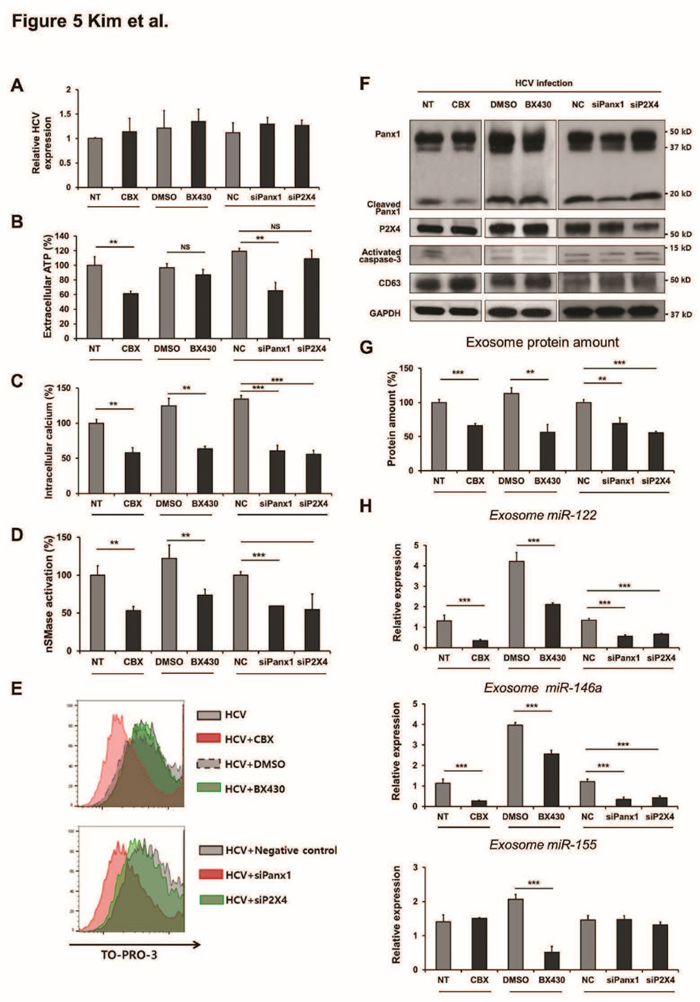 不同浓度的ATP处理肝细胞,验证ATP介导的外泌体释放通过P2X4的激活来实现。
不同浓度的ATP处理肝细胞,验证ATP介导的外泌体释放通过P2X4的激活来实现。
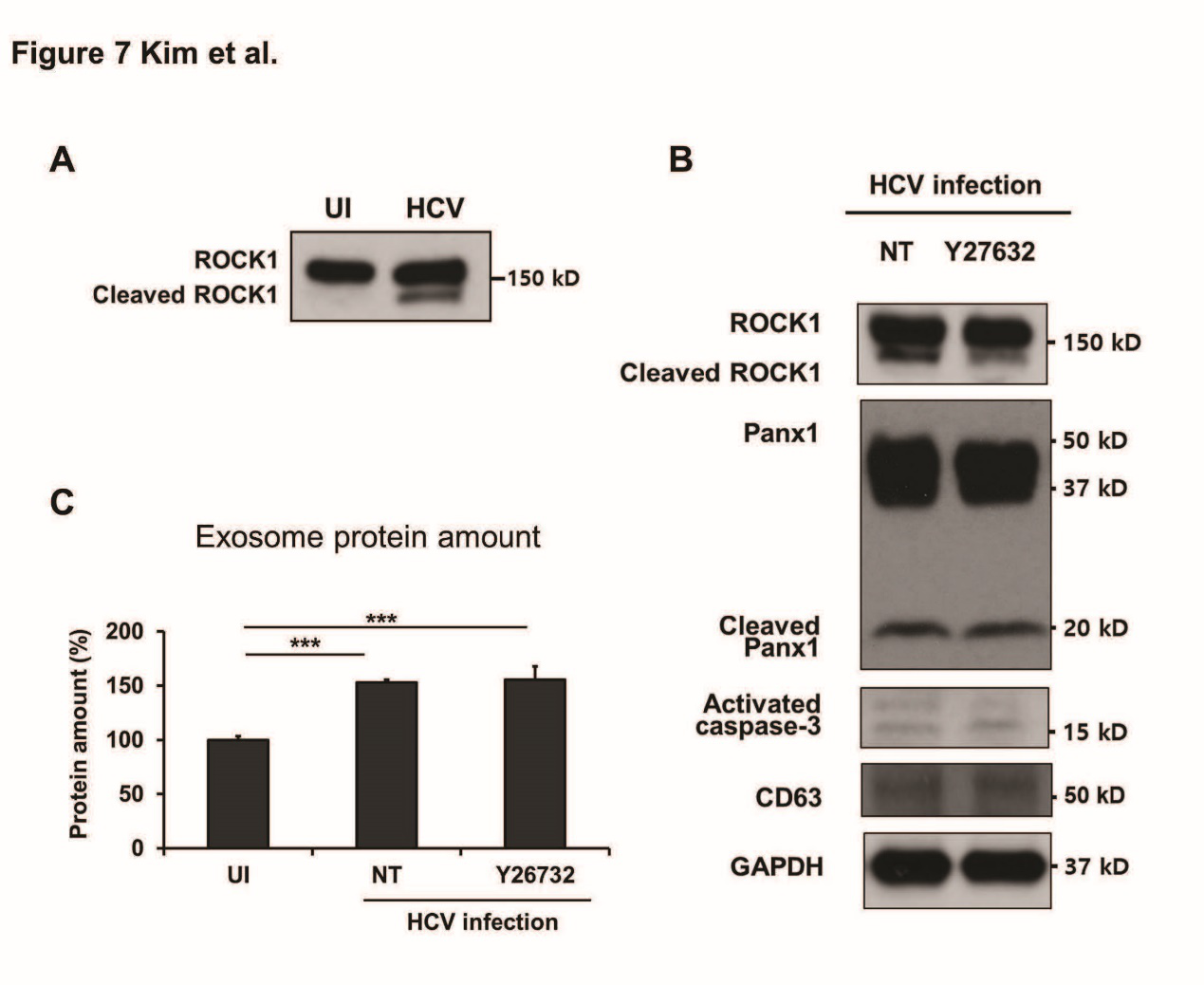
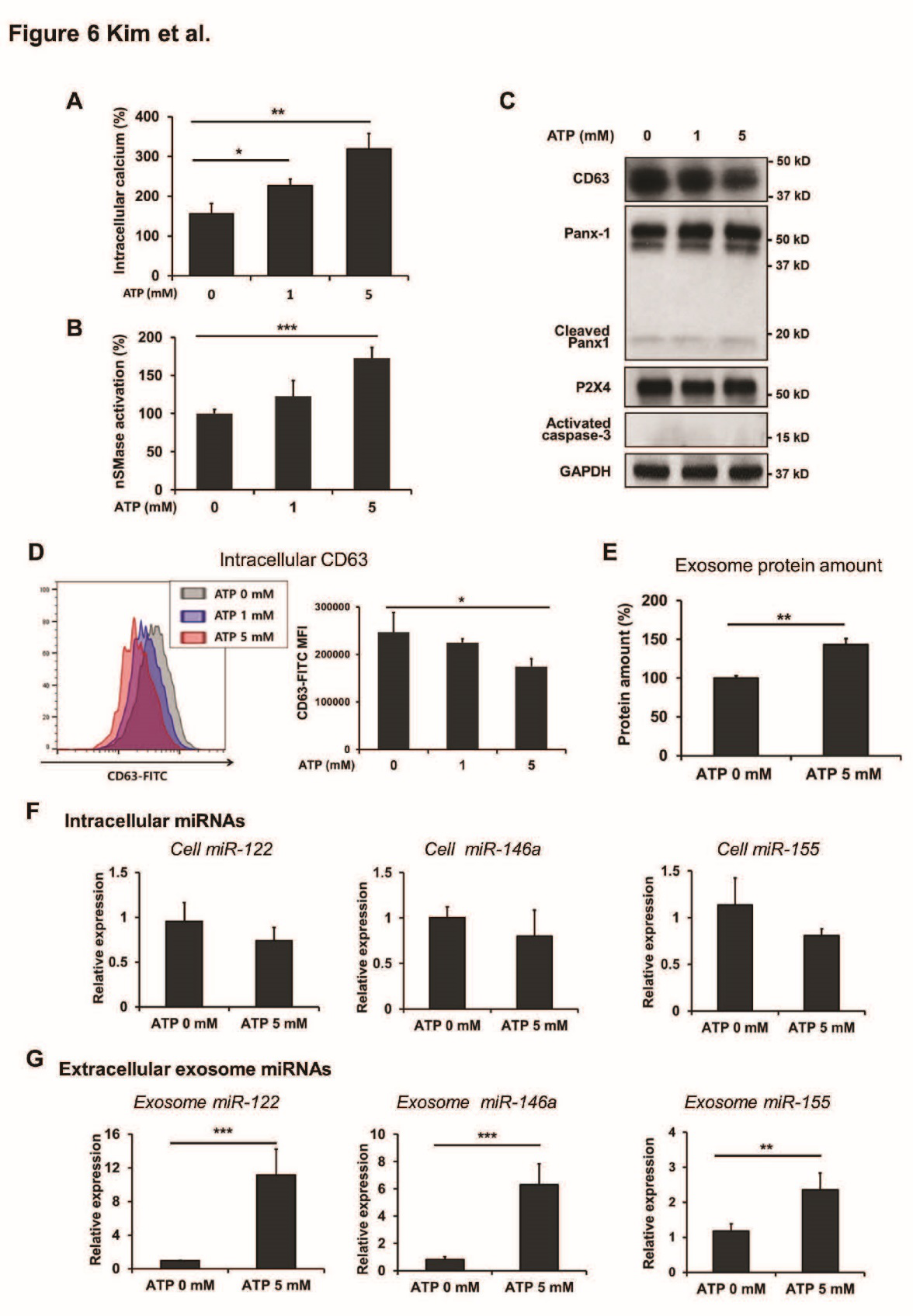 Caspase3和ATP释放均会影响ROCK1,因此检测ROCK1是否参与HCV感染的肝细胞外泌体的释放。结果显示:HCV感染的肝细胞外泌体释放不依赖于ROCK1。
Caspase3和ATP释放均会影响ROCK1,因此检测ROCK1是否参与HCV感染的肝细胞外泌体的释放。结果显示:HCV感染的肝细胞外泌体释放不依赖于ROCK1。


【结果】
首先检测了外泌体数量和蛋白含量,细胞内外泌体的标志物CD63蛋白表达,验证HCV感染下肝细胞释放外泌体量增加,将登革热病毒感染作为对照。













