研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
神经干细胞衍生的外泌体通过CREB-BDNF信号恢复高脂饮食诱导的记忆障碍
1717 人阅读发布时间:2021-11-01 11:39
中枢神经系统在整个成年期都会响应生理刺激和环境条件从而发生结构和功能的变化。神经可塑性设计成年神经干细胞的增殖和分化,以及分化神经元的形态和活性变化。环境刺激通过表观遗传修饰调节大量特定基因组的表达,从而影响脑细胞的生理机能。营养过剩会改变大脑中的正常细胞信号,可能干扰突触功能和成年神经发生,从而导致认知功能受损。因此,流行病学证据表明代谢紊乱,如胰岛素抵抗和2型糖尿病,会加速大脑衰老并增加神经退行性疾病的风险。然而,营养过剩对突触可塑性和记忆的长期影响的分子机制尚不清楚。
BDNF在大脑内起着关键作用,在响应神经元活动时上调,并通过激活cAMP-PKA-CREB通路增强突触和结构可塑性。CREB-BDNF通路已被明确证明是维持神经元存活、突触可塑性和记忆的基础。据报道,CREB还可以作为一种代谢传感器,根据营养物质的可用性调整脑细胞的转录活性。最近,几项研究表明,在脑部疾病的动物模型中,使用干细胞衍生的外泌体可以减轻神经损伤并刺激功能恢复。外泌体是内体来源的细胞外囊泡,在细胞通讯间发挥作用,携带包括激素、肽和miRNA在内的信息。有趣的是,BDNF可能作为游离蛋白或通过外泌体囊泡分泌到细胞外,这增加了利用外泌体开发基于BDNF的治疗策略的可能性。
然而,在代谢性疾病依赖性认知障碍的成熟小鼠模型中,如小鼠喂食高脂饮食(HFD),没有证据表明干细胞衍生的外泌体对神经元基因表达和大脑功能的影响。为此,本研究构建了HFD诱导的小鼠模型,研究神经干细胞(NSC)来源的外泌体在HFD诱导的记忆损伤中的作用,并解释了相关的分子机制(CREB-BDNF通路)。该研究发表于International Journal of Molecular Sciences (IF: 5.923)杂志上。
营养依赖信号可能通过改变蛋白质的翻译后修饰和改变基因表达来影响细胞生理功能。我们最近报道了高脂饮食(HFD)通过 AMPA 受体 GluA1的过度棕榈酰化抑制长时程增强作用(LTP)的早期阶段,从而影响海马突触的可塑性和记忆力。然而,蛋白质合成依赖的后期LTP和长期记忆需要特定基因的选择性激活或抑制。为了深入了解高热量饮食导致记忆缺陷的潜在机制,我们分析了喂食 HFD 六周的小鼠海马提取物中大量可塑性相关基因的表达。RT-PCR揭示了在HFD小鼠海马体中的几个上下调基因,包括Mmp9、Ntf5、Bdnf、Dlg4、Egr3、Grip1、Grm4、Grm8、nNos、Pim1、RelA、Sirt1。总的来说,基因表达的无偏性分析数据表明,HFD干扰了不同的分子级联反应,这些分子级联反应可能参与了突触可塑性和记忆的调节。
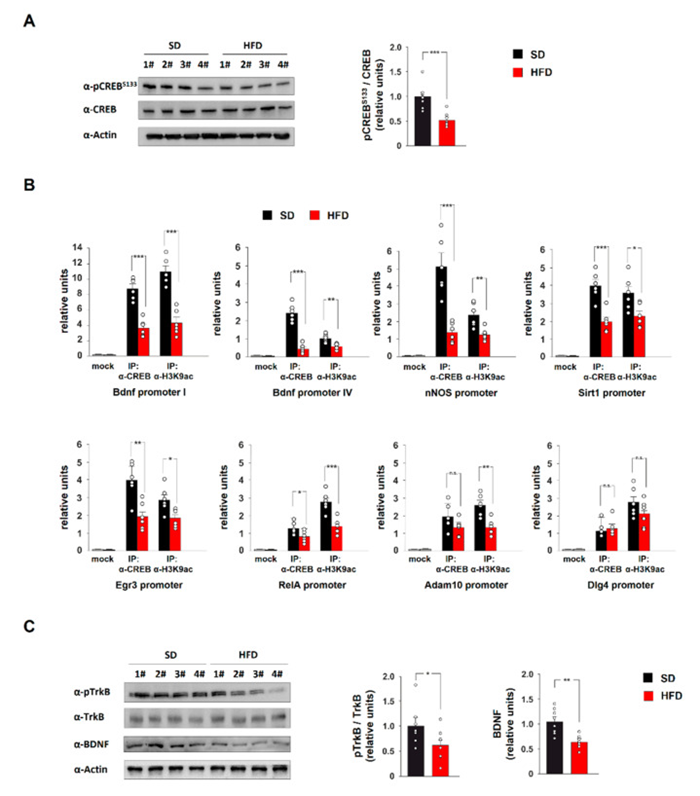
RT-PCR阵列结果的生物信息学分析确定了一组潜在的CREB靶基因,这些基因在HFD喂养小鼠的海马体中差异表达(即Bdnf、nNOS、Sirt1、Egr3、Adam10、Dlg4 和 RelA)。转录因子CREB 的活性已被证明受神经元细胞中营养物质的可利用性调节。因此,我们分析了HFD小鼠海马中丝氨酸133处CREB(pCREBSer133)的激活磷酸化水平。免疫印迹分析显示,与对照相比,HFD小鼠中pCREBSer133的水平降低。
由于磷酸化调节靶基因启动子上CREB的募集,我们分析了该转录因子与 Bdnf、nNOS、Sirt1、Egr3、Adam10、Dlg4 和 RelA 调控序列的结合。ChIP分析显示 Bdnf、nNOS、Sirt1、Egr3 和 RelA 启动子上的CREB蛋白减少,而在Adam10和Dlg4基因的调控序列上没有观察到显着变化。相应地,H3K9ac的乙酰化(转录活性的表观遗传标记)在相同基因座上也显着降低。
Bdnf 是一个关键的CREB靶基因,为了研究CREB失活在HFD小鼠海马体中的分子效应,进一步研究了BDNF蛋白水平和TrkB的激活磷酸化。与对照组相比,HFD喂养的小鼠中BDNF和pTrkBTyr816 的水平降低。总之,HFD抑制CREB活性,减少BDNF信号,导致海马CREB介导的关键神经元基因转录降低。
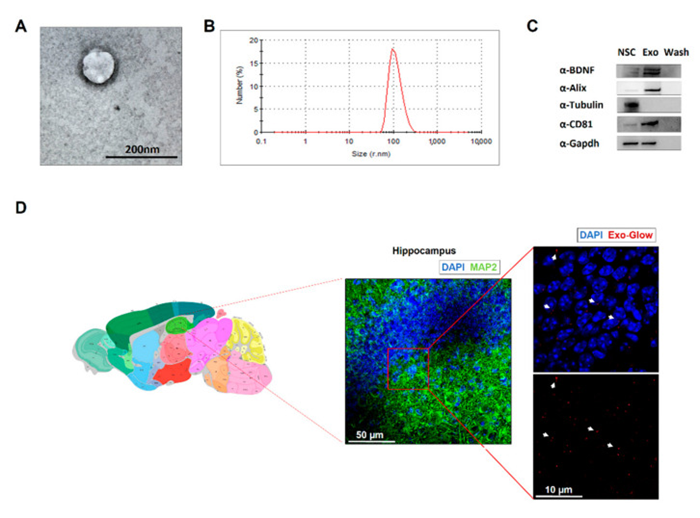
神经元中的突触可塑性是通过激活多个转录因子来协调的。成年NSCs是通过外泌体释放的神经营养因子的一个来源,可能调节成熟神经元的转录。因此,我们检测了NSC来源的外泌体囊泡(exo-NSC)对抗HFD依赖的分子变化的能力。首先我们从NSC中分离外泌体,并用NTA, TEM和western blot鉴定,发现外泌体被成功分离。然后,研究了慢性鼻内给药exo-NSC对HFD小鼠海马体中CREB-BDNF-TrkB信号通路的影响。经鼻内处理的小鼠海马体内可见exo-NSC小泡的定位。
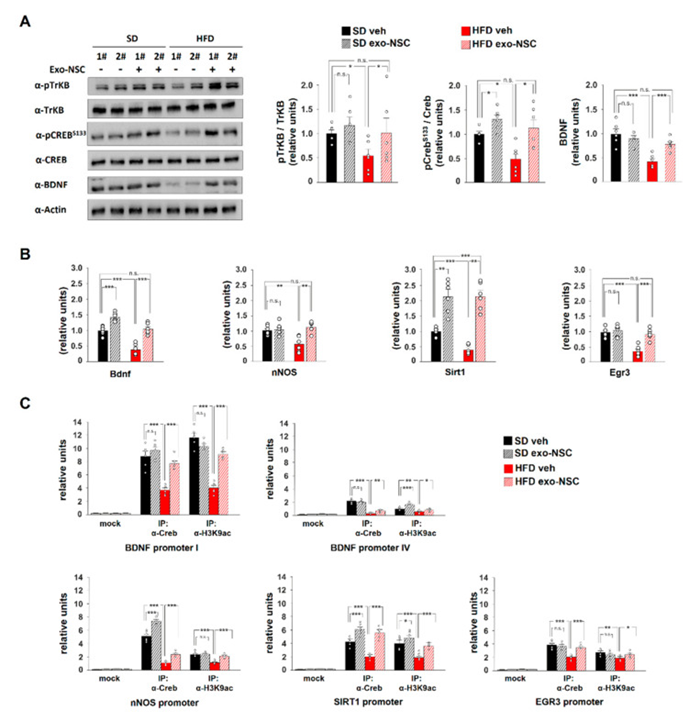
此外,用exo-NSC处理后,pCREBSer13的水平在SD和HFD小鼠海马体中均增加。重要的是,exo-NSC给药本身并不影响动物的热量摄入。在给予exo-NSC后,HFD小鼠中BDNF和pTrkBTyr816的水平也完全恢复。随后,我们评估了在HFD小鼠海马体中下调的CREB靶基因的转录。给予exo-NSC使HFD小鼠中Bdnf、nNOS和Egr3的表达水平与对照组相当。exo-NSC处理也可刺激SD小鼠Bdnf和Sirt1的表达。与此相反,鼻内给予exo-NSC后RelA、Adam10和Dlg4的表达无明显变化。此外,鼻内给药exo-NSC抵消了大脑皮层中nNos、Bdnf和Sirt1的HFD依赖性下调。
为了进一步研究 exo-NSC 对 CREB转录活性的影响,我们分析了转录因子与 exo-NSC 调节的基因启动子的结合。ChIP实验表明,exo-NSC 处理增加了HFD小鼠中Bdnf、nNOS、Sirt1和Egr3启动子上CREB的募集。相应地,在给予exo-NSC后,H3K9ac在相同的调控序列上得到增强。总的来说,我们的研究结果表明,exo-NSC刺激了HFD小鼠海马区CREB-BDNF-TrkB 信号传导,导致突触可塑性相关基因启动子上CREB募集和转录活性的增强。
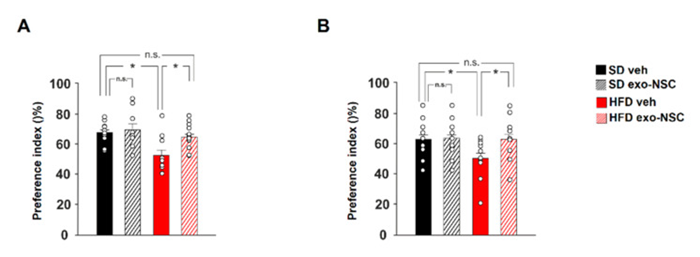
为了寻找上述分子数据的行为相关性,我们研究了NSCs分泌的外泌体是否可以预防HFD引起的认知障碍。为此,我们在HFD喂养的小鼠鼻内给药exo-NSC后进行了认知测试,如新物体识别(NOR)和物体位置识别(OPR)测试。在NOR试验中,HFD小鼠在使用exo-NSC治疗后对新对象表现出明显更高的偏好。此外,使用OPR试验评估后发现exo-NSC治疗完全消除了HFD对空间记忆的不利影响。总之,我们的研究结果表明,NSCs来源的外泌体抵消了CREB转录活性的HFD依赖性下调,并且挽救了与营养过剩相关的记忆缺陷。
综上,本研究证明了HFD抑制小鼠海马体中CREB-BDNF通路并降低一组突触可塑性相关CREB靶基因的表达。此外,经鼻给予 exo-NSC可恢复HFD小鼠海马体内的CREB活性和TrkB信号,从而抵消HFD依赖性基因表达的改变和记忆缺陷。该研究为exo-NSC治疗代谢性疾病相关认知功能下降提供了证据。
参考文献:Neural Stem Cell-Derived Exosomes Revert HFD-Dependent Memory Impairment via CREB-BDNF Signalling. International Journal of Molecular Sciences. 2020 Dec; 21(23): 8994.
BDNF在大脑内起着关键作用,在响应神经元活动时上调,并通过激活cAMP-PKA-CREB通路增强突触和结构可塑性。CREB-BDNF通路已被明确证明是维持神经元存活、突触可塑性和记忆的基础。据报道,CREB还可以作为一种代谢传感器,根据营养物质的可用性调整脑细胞的转录活性。最近,几项研究表明,在脑部疾病的动物模型中,使用干细胞衍生的外泌体可以减轻神经损伤并刺激功能恢复。外泌体是内体来源的细胞外囊泡,在细胞通讯间发挥作用,携带包括激素、肽和miRNA在内的信息。有趣的是,BDNF可能作为游离蛋白或通过外泌体囊泡分泌到细胞外,这增加了利用外泌体开发基于BDNF的治疗策略的可能性。
然而,在代谢性疾病依赖性认知障碍的成熟小鼠模型中,如小鼠喂食高脂饮食(HFD),没有证据表明干细胞衍生的外泌体对神经元基因表达和大脑功能的影响。为此,本研究构建了HFD诱导的小鼠模型,研究神经干细胞(NSC)来源的外泌体在HFD诱导的记忆损伤中的作用,并解释了相关的分子机制(CREB-BDNF通路)。该研究发表于International Journal of Molecular Sciences (IF: 5.923)杂志上。
营养依赖信号可能通过改变蛋白质的翻译后修饰和改变基因表达来影响细胞生理功能。我们最近报道了高脂饮食(HFD)通过 AMPA 受体 GluA1的过度棕榈酰化抑制长时程增强作用(LTP)的早期阶段,从而影响海马突触的可塑性和记忆力。然而,蛋白质合成依赖的后期LTP和长期记忆需要特定基因的选择性激活或抑制。为了深入了解高热量饮食导致记忆缺陷的潜在机制,我们分析了喂食 HFD 六周的小鼠海马提取物中大量可塑性相关基因的表达。RT-PCR揭示了在HFD小鼠海马体中的几个上下调基因,包括Mmp9、Ntf5、Bdnf、Dlg4、Egr3、Grip1、Grm4、Grm8、nNos、Pim1、RelA、Sirt1。总的来说,基因表达的无偏性分析数据表明,HFD干扰了不同的分子级联反应,这些分子级联反应可能参与了突触可塑性和记忆的调节。
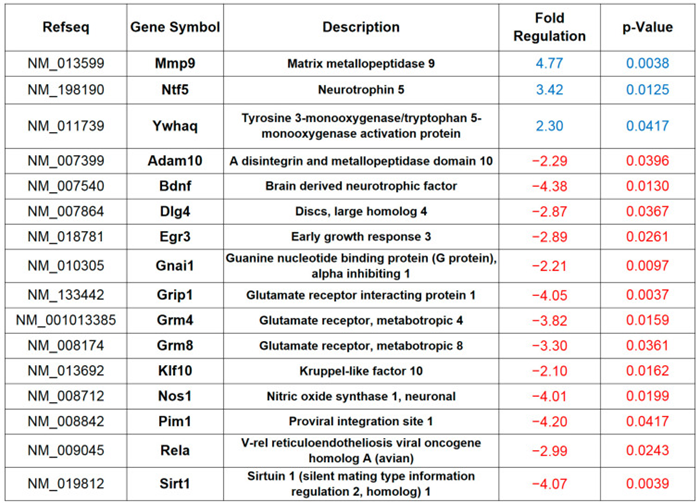

RT-PCR阵列结果的生物信息学分析确定了一组潜在的CREB靶基因,这些基因在HFD喂养小鼠的海马体中差异表达(即Bdnf、nNOS、Sirt1、Egr3、Adam10、Dlg4 和 RelA)。转录因子CREB 的活性已被证明受神经元细胞中营养物质的可利用性调节。因此,我们分析了HFD小鼠海马中丝氨酸133处CREB(pCREBSer133)的激活磷酸化水平。免疫印迹分析显示,与对照相比,HFD小鼠中pCREBSer133的水平降低。
由于磷酸化调节靶基因启动子上CREB的募集,我们分析了该转录因子与 Bdnf、nNOS、Sirt1、Egr3、Adam10、Dlg4 和 RelA 调控序列的结合。ChIP分析显示 Bdnf、nNOS、Sirt1、Egr3 和 RelA 启动子上的CREB蛋白减少,而在Adam10和Dlg4基因的调控序列上没有观察到显着变化。相应地,H3K9ac的乙酰化(转录活性的表观遗传标记)在相同基因座上也显着降低。
Bdnf 是一个关键的CREB靶基因,为了研究CREB失活在HFD小鼠海马体中的分子效应,进一步研究了BDNF蛋白水平和TrkB的激活磷酸化。与对照组相比,HFD喂养的小鼠中BDNF和pTrkBTyr816 的水平降低。总之,HFD抑制CREB活性,减少BDNF信号,导致海马CREB介导的关键神经元基因转录降低。

神经元中的突触可塑性是通过激活多个转录因子来协调的。成年NSCs是通过外泌体释放的神经营养因子的一个来源,可能调节成熟神经元的转录。因此,我们检测了NSC来源的外泌体囊泡(exo-NSC)对抗HFD依赖的分子变化的能力。首先我们从NSC中分离外泌体,并用NTA, TEM和western blot鉴定,发现外泌体被成功分离。然后,研究了慢性鼻内给药exo-NSC对HFD小鼠海马体中CREB-BDNF-TrkB信号通路的影响。经鼻内处理的小鼠海马体内可见exo-NSC小泡的定位。

此外,用exo-NSC处理后,pCREBSer13的水平在SD和HFD小鼠海马体中均增加。重要的是,exo-NSC给药本身并不影响动物的热量摄入。在给予exo-NSC后,HFD小鼠中BDNF和pTrkBTyr816的水平也完全恢复。随后,我们评估了在HFD小鼠海马体中下调的CREB靶基因的转录。给予exo-NSC使HFD小鼠中Bdnf、nNOS和Egr3的表达水平与对照组相当。exo-NSC处理也可刺激SD小鼠Bdnf和Sirt1的表达。与此相反,鼻内给予exo-NSC后RelA、Adam10和Dlg4的表达无明显变化。此外,鼻内给药exo-NSC抵消了大脑皮层中nNos、Bdnf和Sirt1的HFD依赖性下调。
为了进一步研究 exo-NSC 对 CREB转录活性的影响,我们分析了转录因子与 exo-NSC 调节的基因启动子的结合。ChIP实验表明,exo-NSC 处理增加了HFD小鼠中Bdnf、nNOS、Sirt1和Egr3启动子上CREB的募集。相应地,在给予exo-NSC后,H3K9ac在相同的调控序列上得到增强。总的来说,我们的研究结果表明,exo-NSC刺激了HFD小鼠海马区CREB-BDNF-TrkB 信号传导,导致突触可塑性相关基因启动子上CREB募集和转录活性的增强。

为了寻找上述分子数据的行为相关性,我们研究了NSCs分泌的外泌体是否可以预防HFD引起的认知障碍。为此,我们在HFD喂养的小鼠鼻内给药exo-NSC后进行了认知测试,如新物体识别(NOR)和物体位置识别(OPR)测试。在NOR试验中,HFD小鼠在使用exo-NSC治疗后对新对象表现出明显更高的偏好。此外,使用OPR试验评估后发现exo-NSC治疗完全消除了HFD对空间记忆的不利影响。总之,我们的研究结果表明,NSCs来源的外泌体抵消了CREB转录活性的HFD依赖性下调,并且挽救了与营养过剩相关的记忆缺陷。

综上,本研究证明了HFD抑制小鼠海马体中CREB-BDNF通路并降低一组突触可塑性相关CREB靶基因的表达。此外,经鼻给予 exo-NSC可恢复HFD小鼠海马体内的CREB活性和TrkB信号,从而抵消HFD依赖性基因表达的改变和记忆缺陷。该研究为exo-NSC治疗代谢性疾病相关认知功能下降提供了证据。
参考文献:Neural Stem Cell-Derived Exosomes Revert HFD-Dependent Memory Impairment via CREB-BDNF Signalling. International Journal of Molecular Sciences. 2020 Dec; 21(23): 8994.






