研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
干货:外泌体装载紫杉醇
1340 人阅读发布时间:2022-04-12 15:05
细胞外囊泡(EV)如外泌体(EXO)和微囊泡(MV),是细胞分泌到细胞外环境中的脂质膜结合囊泡。EV被认为是天然存在的货物输送剂,也可以用作药物输送的载体,在健康和病理条件下细胞间通讯中发挥着重要的生理作用。研载生物将继续为您解读一篇外泌体装载紫杉醇的文章。
该研究探究了两种不同的EV群体(富含微泡和外泌体)作为紫杉醇(PtX)载体对自体前列腺癌细胞的有效性。用差速离心法从LNCaP‑和PC‑3前列腺癌细胞培养物中分离EV,并通过电子显微镜、纳米粒子跟踪分析和WB进行表征。通过流式细胞术和共聚焦显微镜评估自体前列腺癌细胞对微泡和外泌体的摄取。EV装载了PtX,并通过活力测定评估了EV介导的药物递送的有效性。通过共聚焦显微镜检查EV和EV递送的PtX在细胞中的分布。
研究发现,将紫杉醇加载到自体前列腺癌细胞衍生的EV中会增加其细胞毒性作用。这种能力独立于EV种群和测试的细胞系。尽管没有药物的EV增加了癌细胞的活力,但增强细胞毒性的净效应仍然存在。两个EV群体通过胞吞作用将紫杉醇递送至受体细胞,导致药物从细胞内释放。EV表面蛋白的去除不影响外泌体,而由微泡介导的药物递送被部分抑制。
最终得出结论,癌细胞衍生的EV可作为紫杉醇的有效载体,通过内吞途径将药物带入细胞并增加其细胞毒性。然而,由于细胞活力的提高,在设计任何临床应用之前,必须进一步研究癌细胞衍生EV的使用。
关键词:细胞外囊泡,微泡,外泌体,紫杉醇,药物输送,前列腺癌
研究结果:
1.PCa EV亚群在蛋白质含量和zeta电位方面有所不同
该研究通过使用差速离心法从LNCaP‑和PC‑3两个PCa细胞培养物中分离EV(20K MV 和110K EXO)。TEM观察到110K EXO的直径通常约小于200 nm,显示出人造杯形形态(图1A),而20K MV是异质种群大部分直径为大于200 nm (图1B);通过NTA测量时,两个种群的大小重叠(图1C‑D);当从两种PCa细胞系分析每个颗粒的蛋白质比例时,110K EXO的蛋白质显著多于20K MV(p值≤0.003)(图1E);WB评估常见的EV蛋白标志物CD9、CD81、CD63和TSG101表明,与细胞相比,它们在EV中含量更高。此外,发现α‑微管蛋白和 GAPDH存在于PCa EV中(图1F)。用胰蛋白酶处理EV不会损坏EV (图2A‑B),但几乎完全去除了20K MV和110K EXO的表面蛋白,如跨膜蛋白CD9和CD63(图2C)。EV的ZP受到胰蛋白酶处理的轻微影响。
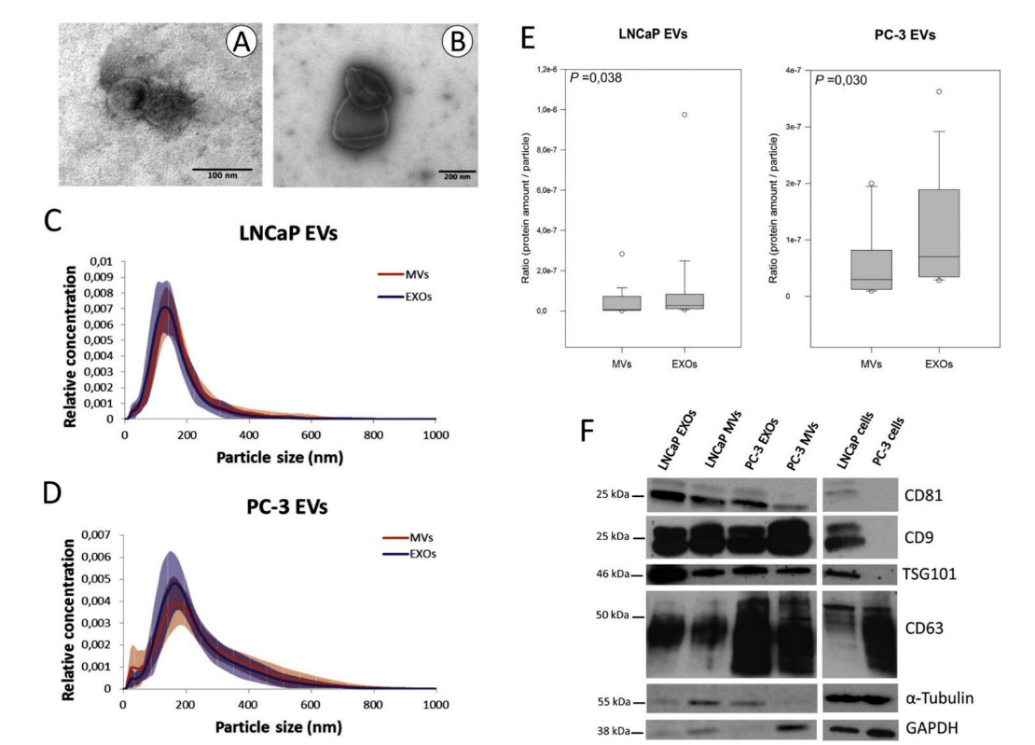
图 1:PCa细胞衍生EV的表征
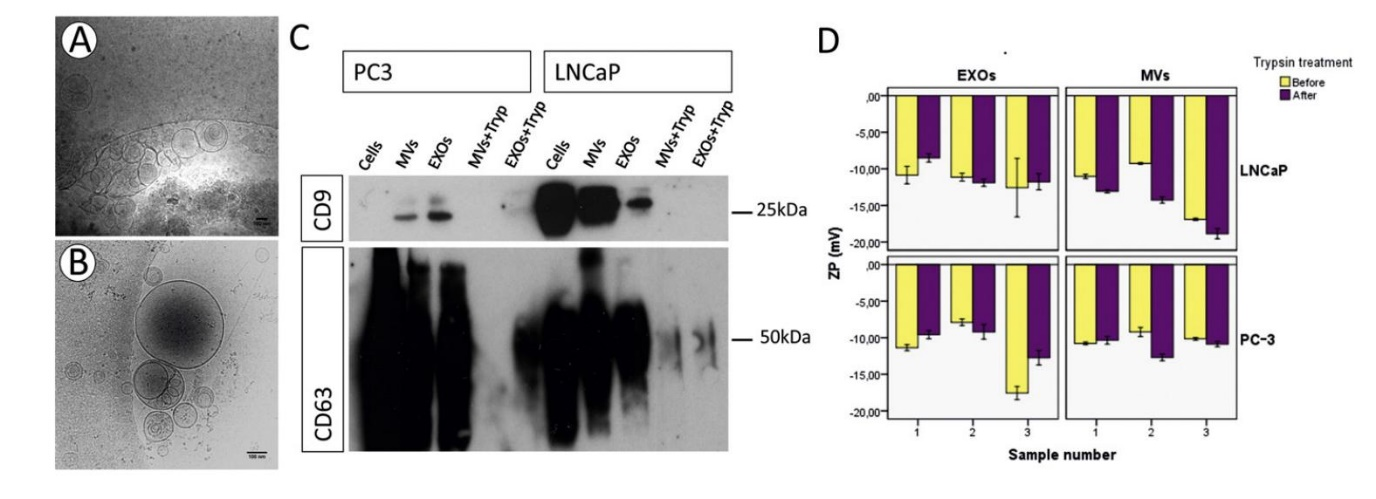
图2:胰蛋白酶处理对EV的影响 2.PCa 细胞有效吸收自体 EV
LNCaP和PC‑3细胞与它们自己的DilC18(5)‑DS标记的囊泡一起孵育不同的时间段(1‑24 小时)。流式细胞术分析,来自两种PCa细胞系的EV都被积极且持续地结合和内化,内化随时间而增加,LNCaP和PC‑3吸收的效率没有差异。PCa细胞可有效吸收自体EV。
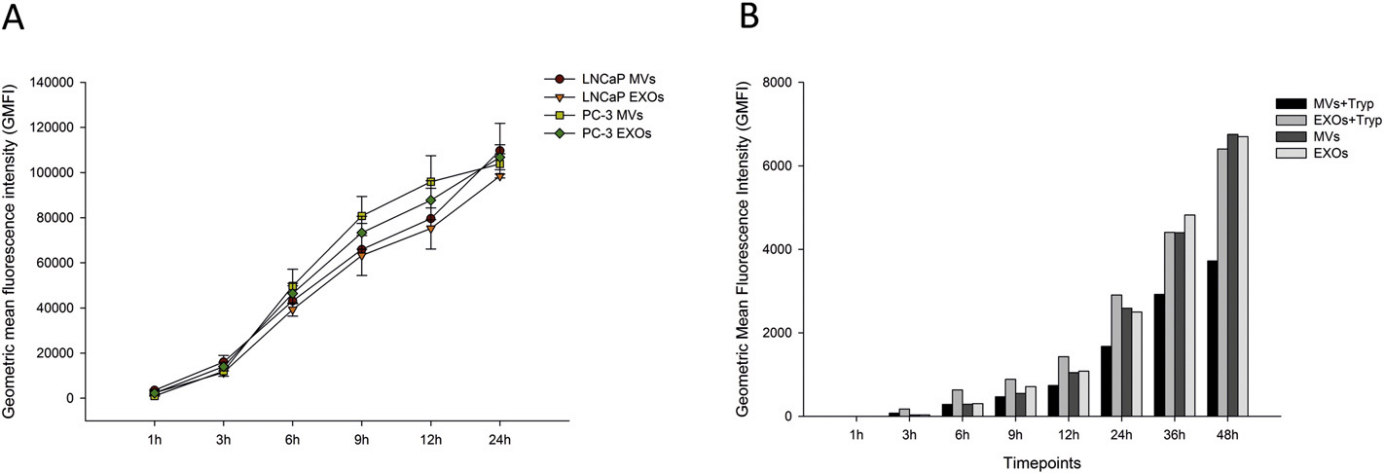
图3:PCa细胞对EV的吸收随时间变化 3.PCa 衍生的EV可提高细胞活力
将PC‑3和LNCaP细胞与不同的EV亚型一起孵育,在24和48h后与无EV对照组测量活力的变化(图4) ,发现20K MV和110K EXO都增加了它们各自细胞系的细胞活力。并且发现EV的效果是剂量依赖性的。
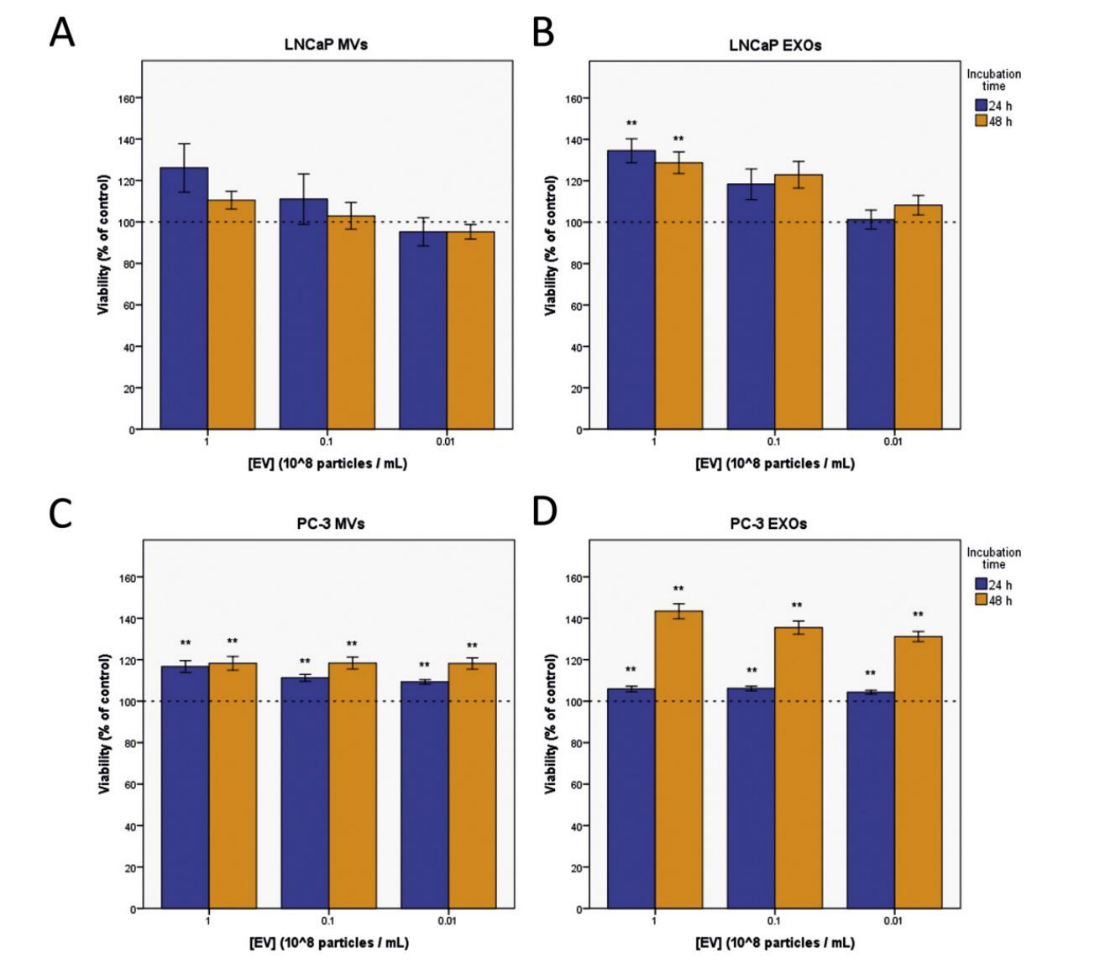
图4:PCa 衍生的EV增加细胞活力 4.EV介导的递送可增强PtX的细胞毒性
通过活力测定将PtX‑EV对自体PCa细胞的细胞毒性作用与游离药物进行了比较,发现与游离PtX相比,由EV递送至PCa细胞的PtX增强了其细胞毒性(图5)。
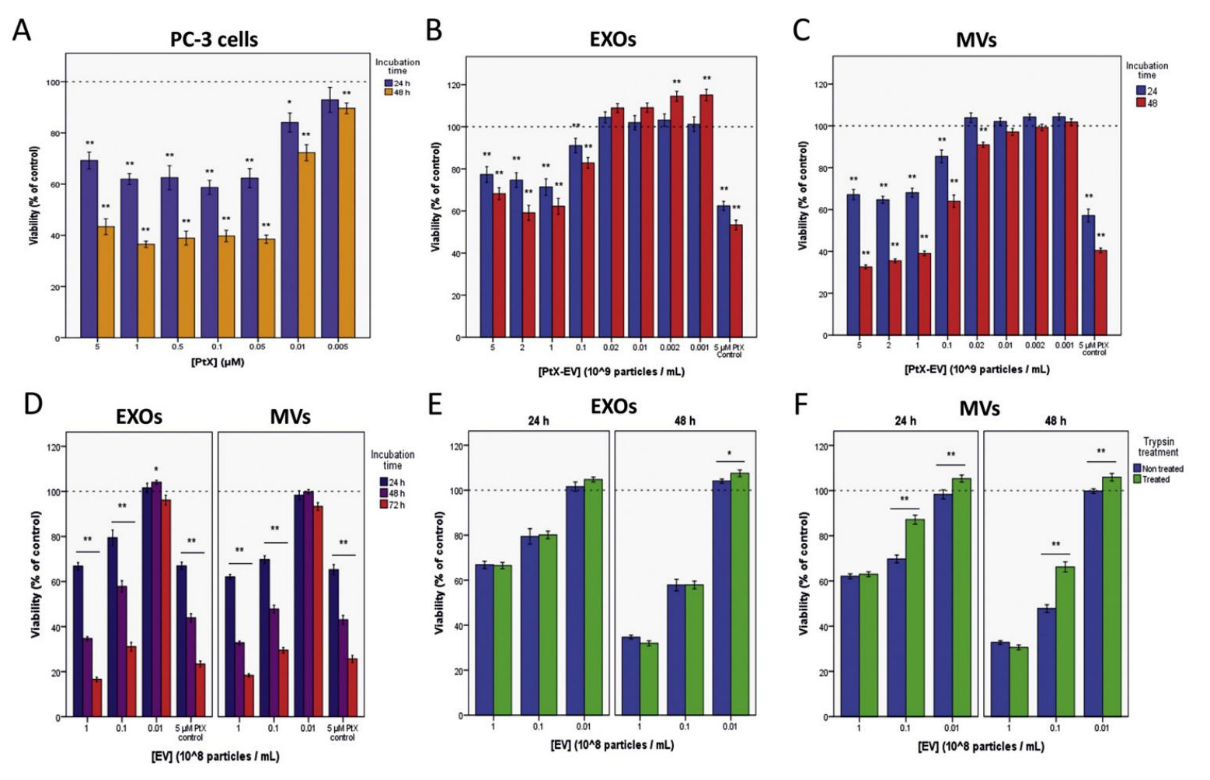
图5:与游离PtX相比,由EV递送至PCa细胞的PtX增强了其细胞毒性。进行细胞活力实验以评估游离和EV加载的PtX。
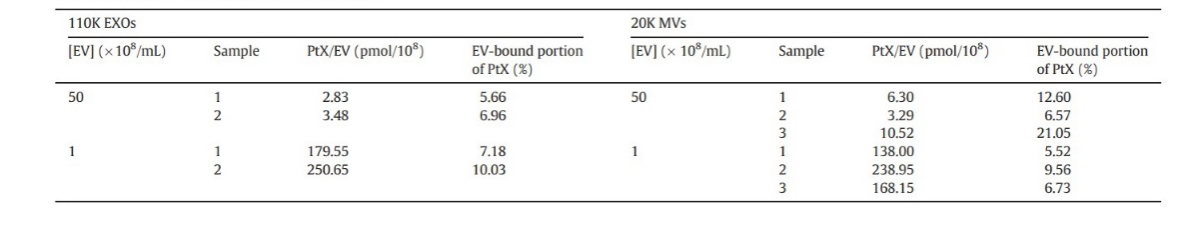 5.EV通过内吞途径递送PtX,在细胞内释放药物
5.EV通过内吞途径递送PtX,在细胞内释放药物
将DiO标记的EV与PC‑3 (图6A)和LNCaP (图6B)细胞孵育24h,然后在添加 LysoTracker® Red后通过荧光显微镜检查细胞。表明内化的EV以及它们携带的PtX通过内吞途径传递到细胞中。接下来,LNCaP和PC‑3细胞用加载OG‑PtX的DiD EV和带有游离 OG‑PtX的DiD‑EV处理。当PCa细胞从培养基中获得游离PtX时,它会扩散到与微管结合的细胞中(图7C‑D)当PtX通过EV递送到细胞中时,无论用作载体的EV亚型如何,PtX都通过内吞途径转运到细胞中,然后在细胞质中释放(图7A‑B)
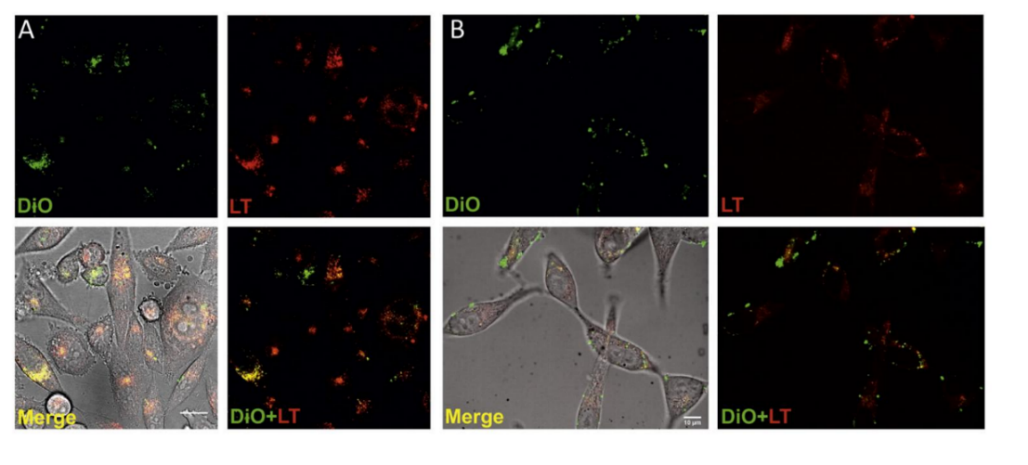
图6:EV与晚期内体/溶酶体共定位
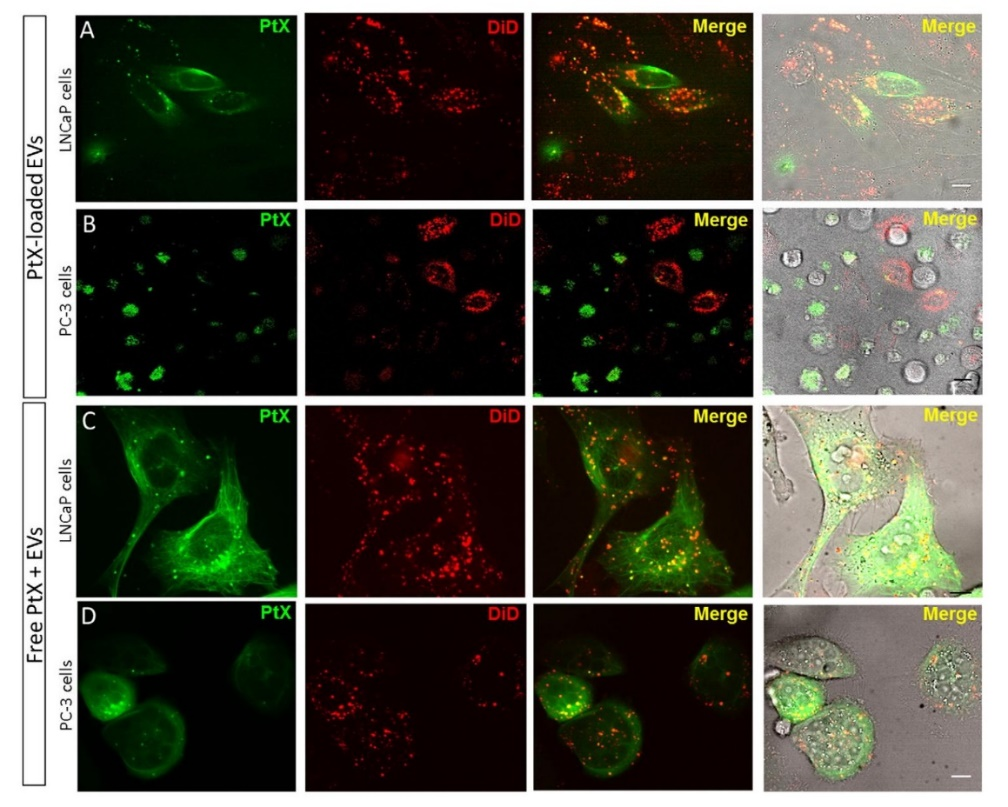
图7:培养24 h,LNCaP和PC‑3细胞中游离PtX、负载PtX的EV、结合游离PtX和EV的细胞内分布。
结论:
自体癌细胞衍生的EV可能是治疗癌症的有用药物递送载体。载有较高量PtX的相对较小浓度的EV在自体细胞中产生最佳的细胞毒性作用。EV通过内吞途径将PtX输送到细胞中,随后药物从细胞内释放出来。这些结果为使用源自患者自身细胞的癌细胞EV在药物递送中的使用提供了支持。
【欢迎来电/邮件咨询】
联系人:刘经理
电话:021-54376058
手机:18516646410/13917998048 (7:00-24:00, 周末节假日不休)
邮箱:yanzaibio@yihaowan.cn, yanzaibio@163.com
地址: 上海市闵行区放鹤路1088号博济科技园6号楼109室
文章链接:https://www.researchgate.net/publication/282128384

摘要:
该研究探究了两种不同的EV群体(富含微泡和外泌体)作为紫杉醇(PtX)载体对自体前列腺癌细胞的有效性。用差速离心法从LNCaP‑和PC‑3前列腺癌细胞培养物中分离EV,并通过电子显微镜、纳米粒子跟踪分析和WB进行表征。通过流式细胞术和共聚焦显微镜评估自体前列腺癌细胞对微泡和外泌体的摄取。EV装载了PtX,并通过活力测定评估了EV介导的药物递送的有效性。通过共聚焦显微镜检查EV和EV递送的PtX在细胞中的分布。
研究发现,将紫杉醇加载到自体前列腺癌细胞衍生的EV中会增加其细胞毒性作用。这种能力独立于EV种群和测试的细胞系。尽管没有药物的EV增加了癌细胞的活力,但增强细胞毒性的净效应仍然存在。两个EV群体通过胞吞作用将紫杉醇递送至受体细胞,导致药物从细胞内释放。EV表面蛋白的去除不影响外泌体,而由微泡介导的药物递送被部分抑制。
最终得出结论,癌细胞衍生的EV可作为紫杉醇的有效载体,通过内吞途径将药物带入细胞并增加其细胞毒性。然而,由于细胞活力的提高,在设计任何临床应用之前,必须进一步研究癌细胞衍生EV的使用。
关键词:细胞外囊泡,微泡,外泌体,紫杉醇,药物输送,前列腺癌
研究结果:
1.PCa EV亚群在蛋白质含量和zeta电位方面有所不同
该研究通过使用差速离心法从LNCaP‑和PC‑3两个PCa细胞培养物中分离EV(20K MV 和110K EXO)。TEM观察到110K EXO的直径通常约小于200 nm,显示出人造杯形形态(图1A),而20K MV是异质种群大部分直径为大于200 nm (图1B);通过NTA测量时,两个种群的大小重叠(图1C‑D);当从两种PCa细胞系分析每个颗粒的蛋白质比例时,110K EXO的蛋白质显著多于20K MV(p值≤0.003)(图1E);WB评估常见的EV蛋白标志物CD9、CD81、CD63和TSG101表明,与细胞相比,它们在EV中含量更高。此外,发现α‑微管蛋白和 GAPDH存在于PCa EV中(图1F)。用胰蛋白酶处理EV不会损坏EV (图2A‑B),但几乎完全去除了20K MV和110K EXO的表面蛋白,如跨膜蛋白CD9和CD63(图2C)。EV的ZP受到胰蛋白酶处理的轻微影响。

图 1:PCa细胞衍生EV的表征

图2:胰蛋白酶处理对EV的影响
LNCaP和PC‑3细胞与它们自己的DilC18(5)‑DS标记的囊泡一起孵育不同的时间段(1‑24 小时)。流式细胞术分析,来自两种PCa细胞系的EV都被积极且持续地结合和内化,内化随时间而增加,LNCaP和PC‑3吸收的效率没有差异。PCa细胞可有效吸收自体EV。

图3:PCa细胞对EV的吸收随时间变化
将PC‑3和LNCaP细胞与不同的EV亚型一起孵育,在24和48h后与无EV对照组测量活力的变化(图4) ,发现20K MV和110K EXO都增加了它们各自细胞系的细胞活力。并且发现EV的效果是剂量依赖性的。

图4:PCa 衍生的EV增加细胞活力
通过活力测定将PtX‑EV对自体PCa细胞的细胞毒性作用与游离药物进行了比较,发现与游离PtX相比,由EV递送至PCa细胞的PtX增强了其细胞毒性(图5)。

图5:与游离PtX相比,由EV递送至PCa细胞的PtX增强了其细胞毒性。进行细胞活力实验以评估游离和EV加载的PtX。

将DiO标记的EV与PC‑3 (图6A)和LNCaP (图6B)细胞孵育24h,然后在添加 LysoTracker® Red后通过荧光显微镜检查细胞。表明内化的EV以及它们携带的PtX通过内吞途径传递到细胞中。接下来,LNCaP和PC‑3细胞用加载OG‑PtX的DiD EV和带有游离 OG‑PtX的DiD‑EV处理。当PCa细胞从培养基中获得游离PtX时,它会扩散到与微管结合的细胞中(图7C‑D)当PtX通过EV递送到细胞中时,无论用作载体的EV亚型如何,PtX都通过内吞途径转运到细胞中,然后在细胞质中释放(图7A‑B)

图6:EV与晚期内体/溶酶体共定位

图7:培养24 h,LNCaP和PC‑3细胞中游离PtX、负载PtX的EV、结合游离PtX和EV的细胞内分布。
自体癌细胞衍生的EV可能是治疗癌症的有用药物递送载体。载有较高量PtX的相对较小浓度的EV在自体细胞中产生最佳的细胞毒性作用。EV通过内吞途径将PtX输送到细胞中,随后药物从细胞内释放出来。这些结果为使用源自患者自身细胞的癌细胞EV在药物递送中的使用提供了支持。
【欢迎来电/邮件咨询】
联系人:刘经理
电话:021-54376058
手机:18516646410/13917998048 (7:00-24:00, 周末节假日不休)
邮箱:yanzaibio@yihaowan.cn, yanzaibio@163.com
地址: 上海市闵行区放鹤路1088号博济科技园6号楼109室






