研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
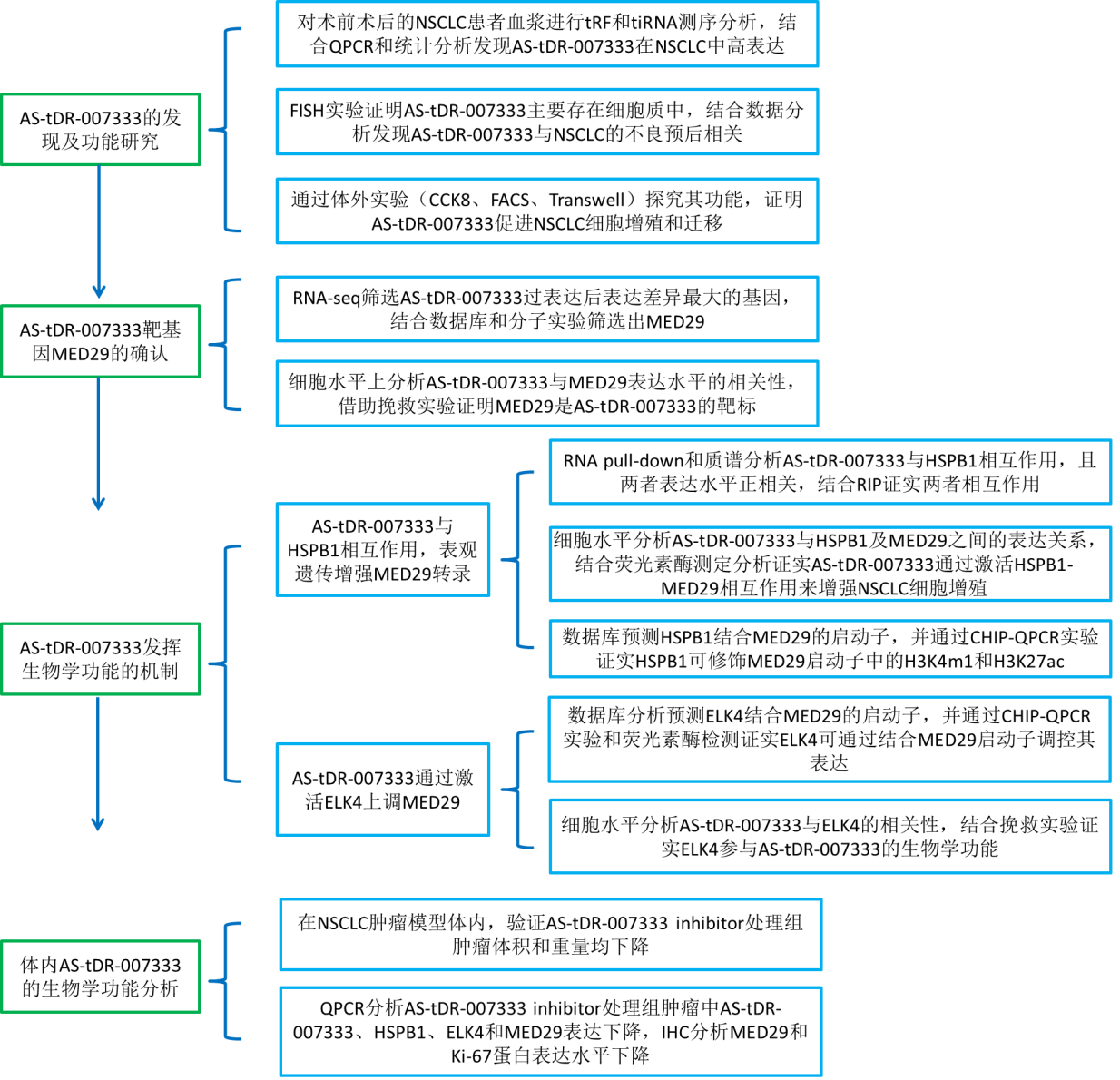
一种新的tRNA衍生片段AS-tDR-007333通过HSPB1/MED29和ELK4/MED29轴促进NSCLC的发展
759 人阅读发布时间:2022-05-20 13:30
近年来的研究表明,tRNA不仅是一种参与解码mRNA、翻译蛋白质的接头分子,还是tRNA衍生片段(tRF)和tRNA半片段(tiRNAs)的主要来源,从而通过RNA沉默、翻译调控和表观遗传调控等作用,参与一些病理过程,但tRF在NSCLC中的生物学功能和机制仍未明了。近日,有研究发现AS-tDR-007333通过HSPB1/MED29和ELK4/MED29轴促进NSCLC的发展。
研究表明tRF可参与到癌细胞的增殖、迁移和侵袭等过程中,但其发挥功能的分子机制在很大程度上尚不清楚,依据先前的研究,一些tRF可通过直接与靶基因的3’UTR结合,抑制基因翻译;还有一些tRF可通过替换mRNA的3’UTR来抑制基因的稳定性;其他tRF可与蛋白质结合并改变靶蛋白的磷酸化和功能。本研究中发现了一种称为AS-tDR-007333的新型tRF,能通过HSPB1- MED29和ELK4-MED29双重调节机制促进NSCLC肿瘤发生。
技术路线:
1. 循环tRFs在NSCLC 患者术前和术后血浆样本中的表达差异
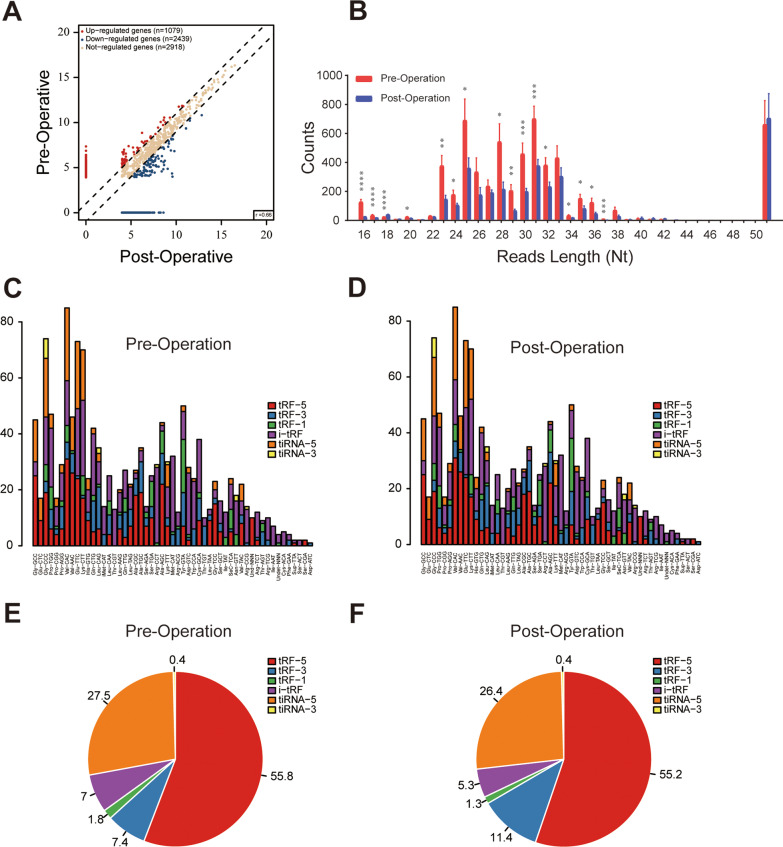
对NSCLC患者术前术后的血浆进行tRFs和tiRNA测序,结果显示tRF表达谱在术前术后存在显著差异,大多数血浆tRF来源于tRNA的5'端,且术后血浆中大多数tRF的表达显著降低,说明这些tRF与NSCLC有关。
 2. tRF AS-tDR-007333在NSCLC中高表达
2. tRF AS-tDR-007333在NSCLC中高表达
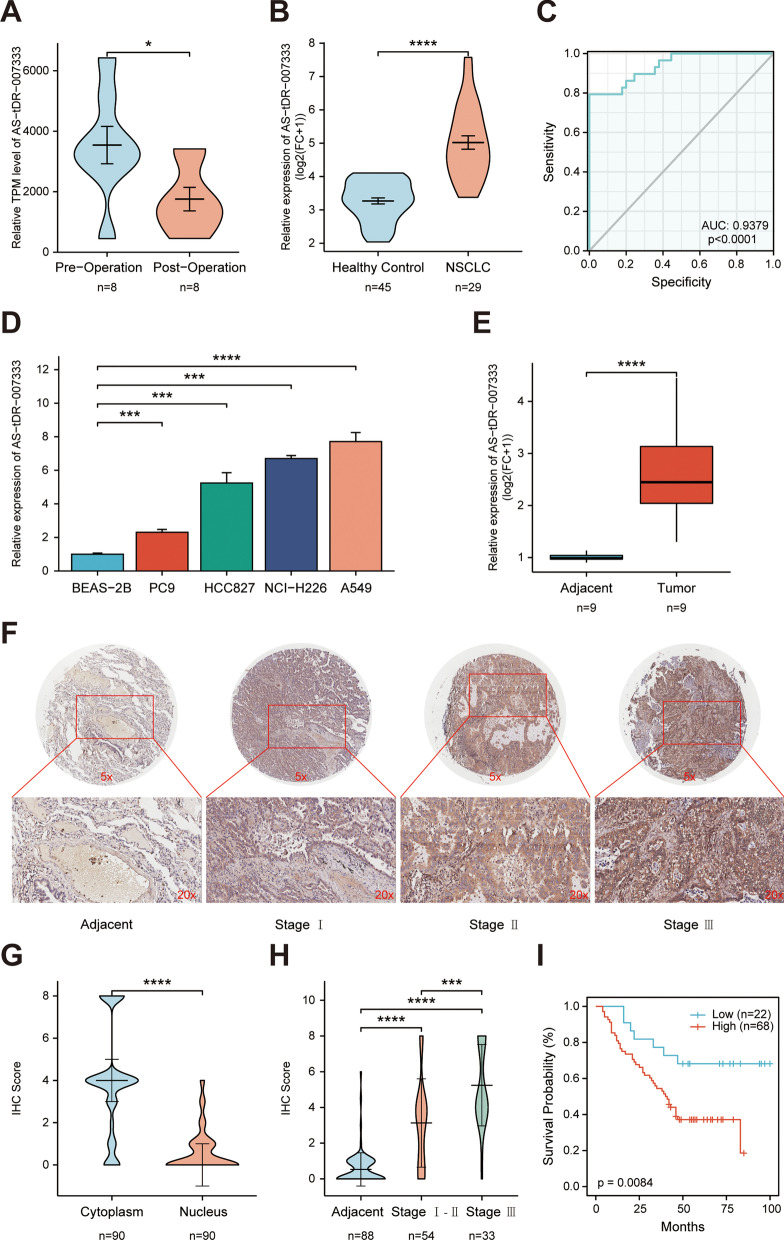
以术前术后血浆中tRF的倍数变化≥2和P<0.05的筛选标准,筛选出一个新的tRF AS-tDR-007333在术前血浆中高表达,并通过QPCR确认其在NSCLC患者血浆和细胞系中高表达,结合ROC分析,表明其具有作为NSCLC诊断标志物的潜能。
 3. 高表达的AS-tDR-007333与NSCLC的不良预后有关
3. 高表达的AS-tDR-007333与NSCLC的不良预后有关
为了评估AS-tDR-007333在NSCLC患者中的临床意义,首先通过FISH实验验证AS-tDR-007333与TNM分期呈正相关,且主要富集在细胞质中,结合Kaplan-Meier生存分析,表明高水平的AS-tDR-007333与NSCLC患者的不良预后相关。
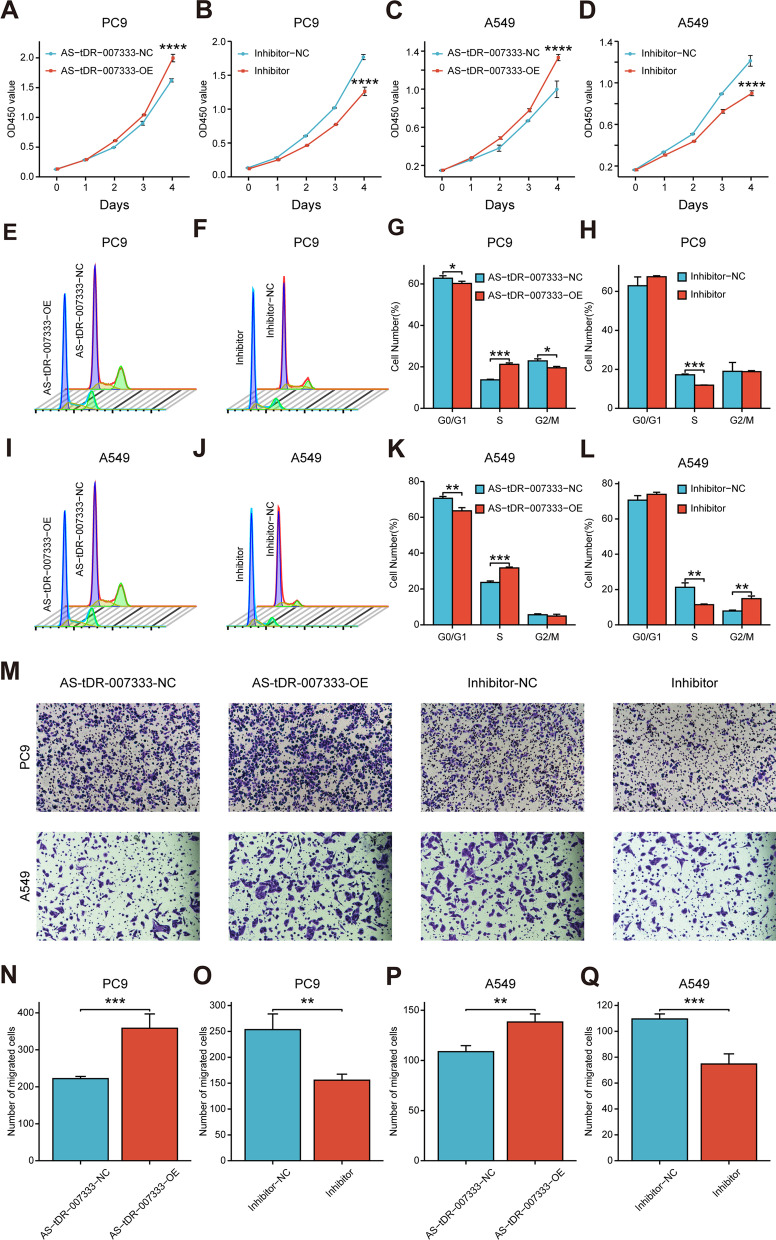 4. AS-tDR-007333促进NSCLC细胞增殖迁移
4. AS-tDR-007333促进NSCLC细胞增殖迁移
接着通过CCK8、FACS和Transwell实验评估AS-tDR-007333的生物学功能,实验结果显示,高表达的AS-tDR-007333可促进NSCLC细胞系增殖,细胞周期停滞在S期,迁移能力增强,但对细胞凋亡无影响。
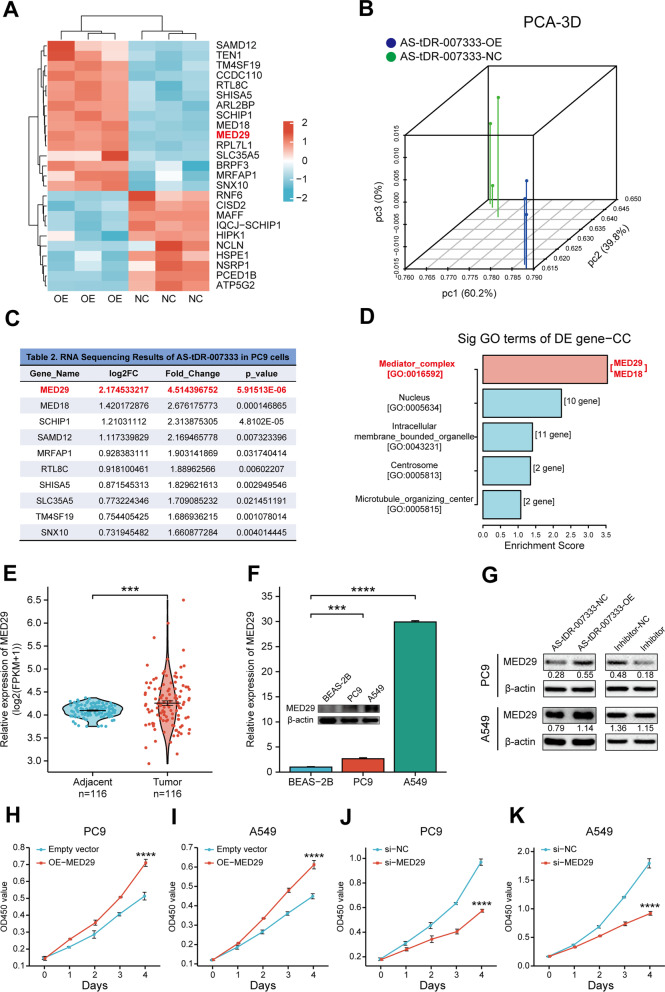 5. AS-tDR-007333通过上调MED29的表达促进NSCLC细胞增殖
5. AS-tDR-007333通过上调MED29的表达促进NSCLC细胞增殖
RNA-seq及数据库分析发现MED29在AS-tDR-007333过表达后细胞中富集,TCGA数据库亦显示非小细胞肺癌组织中MED29的表达水平高于癌旁,借助QPCR和WB证实了MED29在NSCLC细胞中显著上调。在细胞内过表达/敲低AS-tDR-007333后,MED29的表达表现增加/降低趋势,同时MED29的表达与NSCLC细胞增殖能力呈正相关。在过表达AS-tDR-007333的细胞中转染si-MED29,可以导致细胞增殖显著降低。表明AS-tDR-007333可诱导MED29表达,MED29可作为癌基因增强NSCLC细胞的增殖。
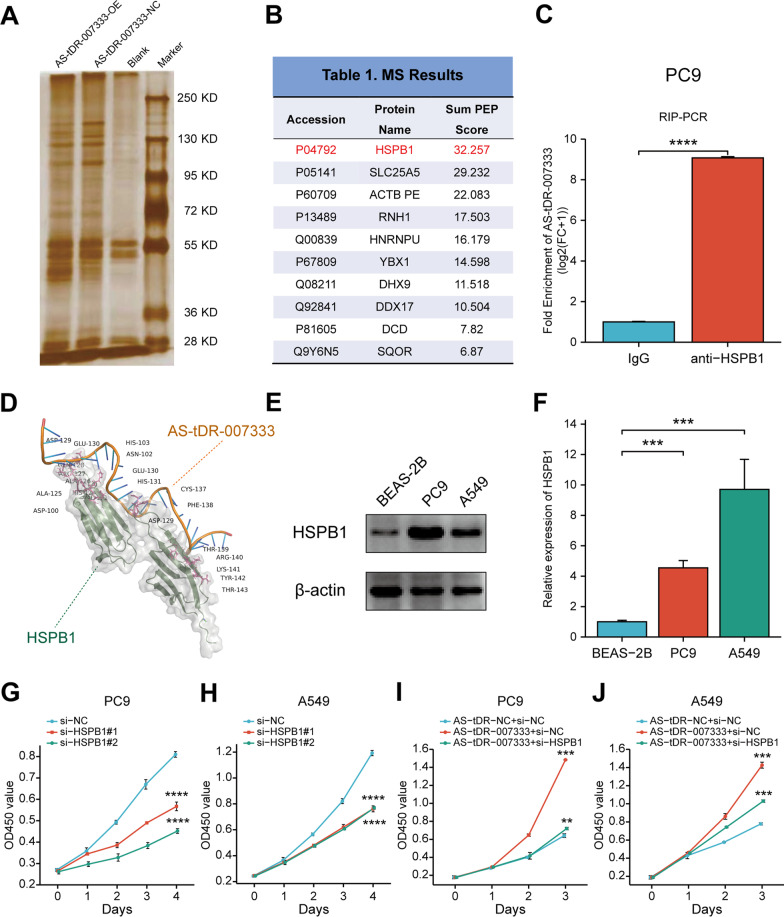 6. AS-tDR-007333与HSPB1相互作用后表观遗传增强MED29的转录
6. AS-tDR-007333与HSPB1相互作用后表观遗传增强MED29的转录
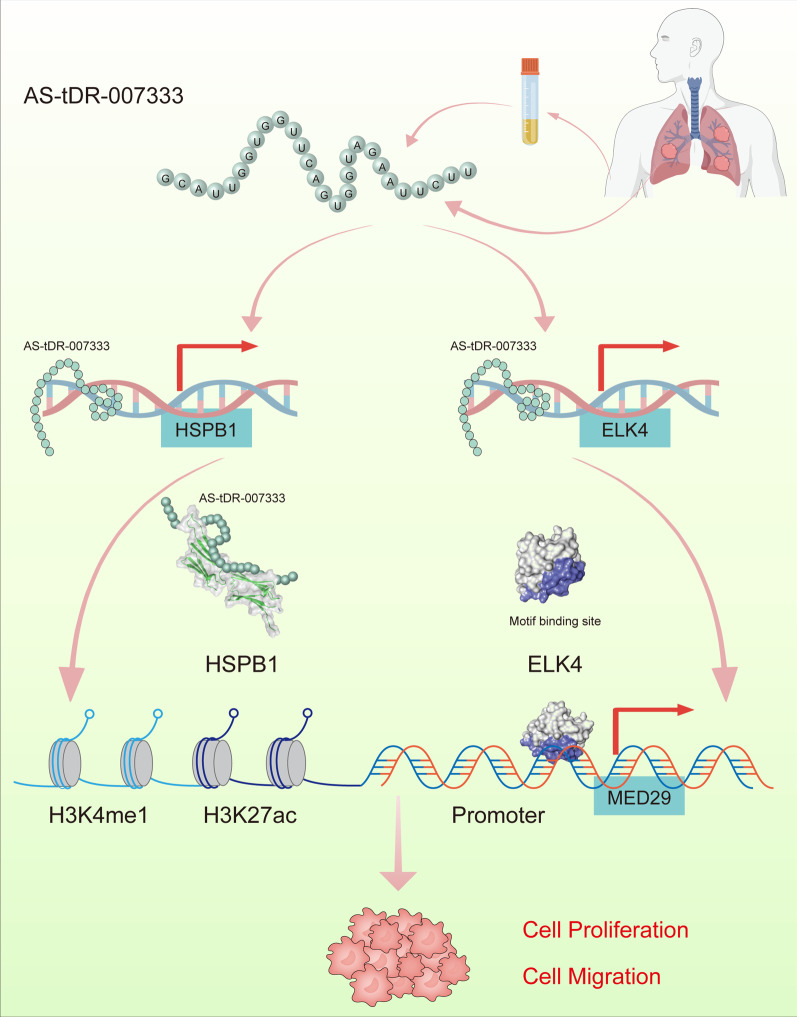
为了研究AS-tDR-007333的作用机制,作者结合RNA pull-down实验和质谱分析,发现AS-tDR-007333可以与几种癌症相关的RNA结合蛋白相关作用,如HSPB1、DHX9、ACTB、YBX3和ILF2,其中HSPB1的匹配度最高。在肿瘤组织中,HSPB1表达水平与AS-tDR-007333正相关,RIP实验进一步确认二者的特异性结合,但AS-tDR-007333并不影响HSPB1的稳定性。
接着为确定AS-tDR-007333通过HSPB1来调节NSCLC细胞增殖,首先通过QPCR和WB实验证实HSPB1在NSCLC细胞系中高表达,将AS-tDR-007333和si-HSPB1共转到NSCLC细胞能显著降低细胞增殖能力,表明AS-tDR-007333对NSCLC细胞增殖的影响部分依赖于HSPB1。
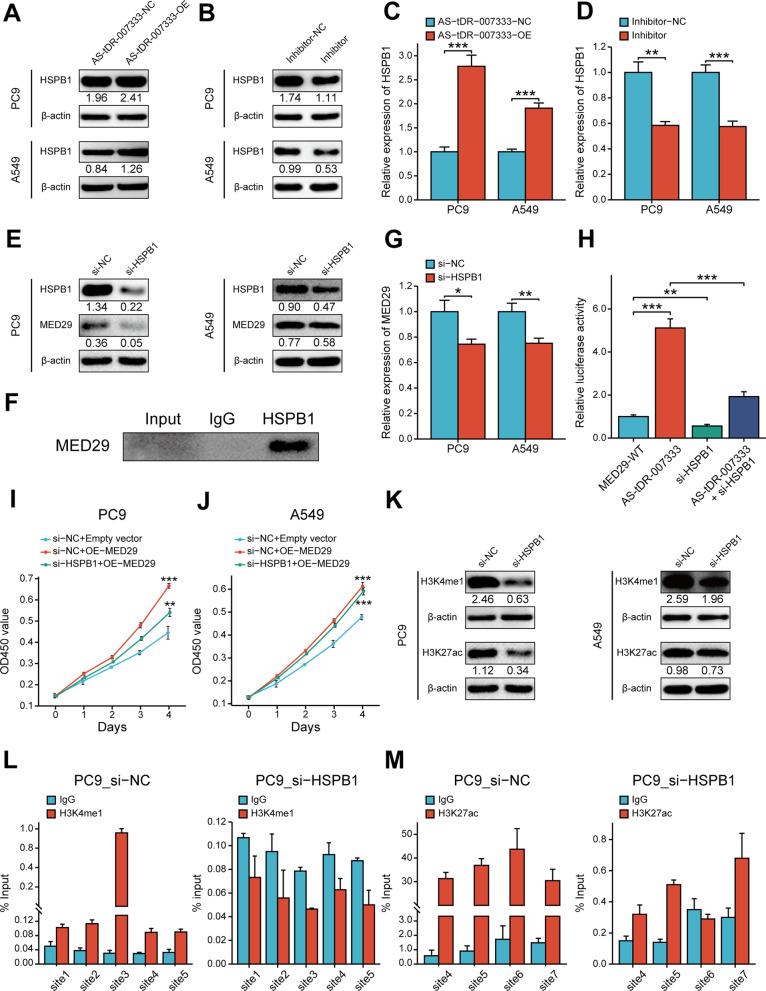
在细胞内AS-tDR-007333的表达水平与HSPB1正相关,但敲低HSPB1后抑制HSPB1表达的同时,还抑制了MED29的表达。借用COIP分析发现HSPB1结合MED29 。荧光素酶检测证实AS-tDR-007333的上调能增加MED29的启动子活性,而AS-tDR-007333和si-HSPB1的共转降低了MED29的启动子活性;将MED29和si-HSPB1的共转到细胞中能显著抑制MED29对细胞增殖的影响,说明AS-tDR-007333可以通过激活HSPB1-MED29相互作用来增强NSCLC细胞增殖。
组蛋白修饰在基因转录的表观遗传调控中起到重要作用,数据库分析预测在MED29启动子有HSPB1的结合位点,且MED29启动子区域包含转录激活标志组蛋白H3K4me1和H3K27ac,但细胞内敲低HSPB1能抑制H3K4me1和H3K27ac的表达水平,同时显著降低了MED29启动子区域中的H3K4me1和H3K27ac水平,表明AS-tDR-007333可能部分通过HSPB1介导的MED29启动子中H3K4me1和H3K27ac的修饰来促进癌细胞增殖。
 7. AS-tDR-007333通过激活ELK4介导的转录调控上调 MED29
7. AS-tDR-007333通过激活ELK4介导的转录调控上调 MED29
由于HSPB1-MED29相互作用只能部分解释MED29的表达,因此作者推测AS-tDR-007333对MED29的表达调控可能还存在其他机制。JASPAR和UCSC数据库分析发现MED29启动子包含转录因子ELK4的结合位点,且ELK4在NSCLC中的表达与AS-tDR-007333正相关。si-ELK4能显著抑制NSCLC增殖,AS-tDR-007333的过表达可以促进细胞内ELK4的表达。借助CHIP-PCR和荧光素酶报告基因检测证实ELK4直接结合MDE29启动子。表明AS-tDR-007333与ELK4相互作用,从而调控MED29转录。
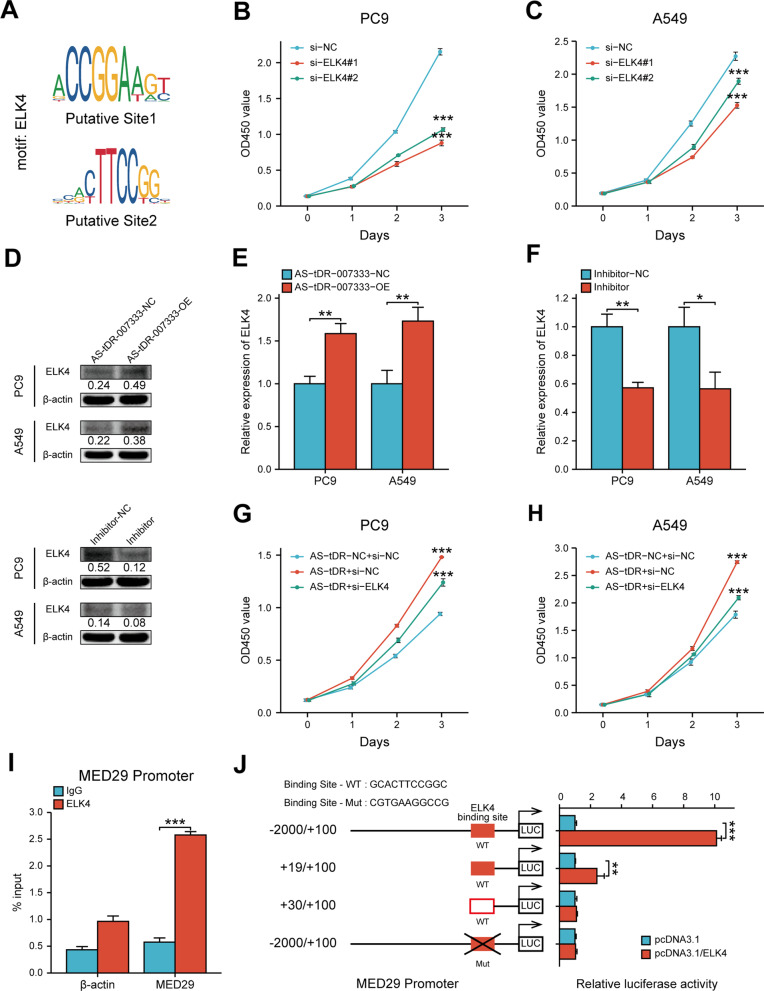 8. 体内靶向AS-tDR-007333可抑制NSCLC细胞生长
8. 体内靶向AS-tDR-007333可抑制NSCLC细胞生长
建立NSCLC肿瘤模型后,给予AS-tDR-007333 inhibitor或NC进行处理,发现AS-tDR-007333 inhibitor组肿瘤体积及重量明显小于对照组,AS-tDR-007333 inhibitor肿瘤组织中AS-tDR-007333、HSPB1、ELK4和MED29的RNA表达水平受到抑制,IHC显示MED29和Ki-67蛋白水平的表达在AS-tDR-007333 inhibitor的处理下受到抑制,表明在体内抑制AS-tDR-007333的表达后可抑制NSCLC肿瘤的生长。
讨论:
在本研究中作者首次发现一个新的tRF AS-tDR-007333作为致癌基因,能促进NSCLC的发展,其作用机制不同于以前发现tRF的作用机制,它能通过与结合蛋白HSPB1相互作用以修饰组蛋白并激活转录因子ELK4,增强MED29启动子活性,从而促进MED29基因的表达,促进NSCLC细胞的恶性发展,揭示AS-tDR-007333可作为NSCLC的诊断和预后标志物或治疗靶点。
研究表明tRF可参与到癌细胞的增殖、迁移和侵袭等过程中,但其发挥功能的分子机制在很大程度上尚不清楚,依据先前的研究,一些tRF可通过直接与靶基因的3’UTR结合,抑制基因翻译;还有一些tRF可通过替换mRNA的3’UTR来抑制基因的稳定性;其他tRF可与蛋白质结合并改变靶蛋白的磷酸化和功能。本研究中发现了一种称为AS-tDR-007333的新型tRF,能通过HSPB1- MED29和ELK4-MED29双重调节机制促进NSCLC肿瘤发生。
技术路线:


1. 循环tRFs在NSCLC 患者术前和术后血浆样本中的表达差异
对NSCLC患者术前术后的血浆进行tRFs和tiRNA测序,结果显示tRF表达谱在术前术后存在显著差异,大多数血浆tRF来源于tRNA的5'端,且术后血浆中大多数tRF的表达显著降低,说明这些tRF与NSCLC有关。

以术前术后血浆中tRF的倍数变化≥2和P<0.05的筛选标准,筛选出一个新的tRF AS-tDR-007333在术前血浆中高表达,并通过QPCR确认其在NSCLC患者血浆和细胞系中高表达,结合ROC分析,表明其具有作为NSCLC诊断标志物的潜能。

为了评估AS-tDR-007333在NSCLC患者中的临床意义,首先通过FISH实验验证AS-tDR-007333与TNM分期呈正相关,且主要富集在细胞质中,结合Kaplan-Meier生存分析,表明高水平的AS-tDR-007333与NSCLC患者的不良预后相关。

接着通过CCK8、FACS和Transwell实验评估AS-tDR-007333的生物学功能,实验结果显示,高表达的AS-tDR-007333可促进NSCLC细胞系增殖,细胞周期停滞在S期,迁移能力增强,但对细胞凋亡无影响。

RNA-seq及数据库分析发现MED29在AS-tDR-007333过表达后细胞中富集,TCGA数据库亦显示非小细胞肺癌组织中MED29的表达水平高于癌旁,借助QPCR和WB证实了MED29在NSCLC细胞中显著上调。在细胞内过表达/敲低AS-tDR-007333后,MED29的表达表现增加/降低趋势,同时MED29的表达与NSCLC细胞增殖能力呈正相关。在过表达AS-tDR-007333的细胞中转染si-MED29,可以导致细胞增殖显著降低。表明AS-tDR-007333可诱导MED29表达,MED29可作为癌基因增强NSCLC细胞的增殖。

为了研究AS-tDR-007333的作用机制,作者结合RNA pull-down实验和质谱分析,发现AS-tDR-007333可以与几种癌症相关的RNA结合蛋白相关作用,如HSPB1、DHX9、ACTB、YBX3和ILF2,其中HSPB1的匹配度最高。在肿瘤组织中,HSPB1表达水平与AS-tDR-007333正相关,RIP实验进一步确认二者的特异性结合,但AS-tDR-007333并不影响HSPB1的稳定性。
接着为确定AS-tDR-007333通过HSPB1来调节NSCLC细胞增殖,首先通过QPCR和WB实验证实HSPB1在NSCLC细胞系中高表达,将AS-tDR-007333和si-HSPB1共转到NSCLC细胞能显著降低细胞增殖能力,表明AS-tDR-007333对NSCLC细胞增殖的影响部分依赖于HSPB1。
在细胞内AS-tDR-007333的表达水平与HSPB1正相关,但敲低HSPB1后抑制HSPB1表达的同时,还抑制了MED29的表达。借用COIP分析发现HSPB1结合MED29 。荧光素酶检测证实AS-tDR-007333的上调能增加MED29的启动子活性,而AS-tDR-007333和si-HSPB1的共转降低了MED29的启动子活性;将MED29和si-HSPB1的共转到细胞中能显著抑制MED29对细胞增殖的影响,说明AS-tDR-007333可以通过激活HSPB1-MED29相互作用来增强NSCLC细胞增殖。
组蛋白修饰在基因转录的表观遗传调控中起到重要作用,数据库分析预测在MED29启动子有HSPB1的结合位点,且MED29启动子区域包含转录激活标志组蛋白H3K4me1和H3K27ac,但细胞内敲低HSPB1能抑制H3K4me1和H3K27ac的表达水平,同时显著降低了MED29启动子区域中的H3K4me1和H3K27ac水平,表明AS-tDR-007333可能部分通过HSPB1介导的MED29启动子中H3K4me1和H3K27ac的修饰来促进癌细胞增殖。

由于HSPB1-MED29相互作用只能部分解释MED29的表达,因此作者推测AS-tDR-007333对MED29的表达调控可能还存在其他机制。JASPAR和UCSC数据库分析发现MED29启动子包含转录因子ELK4的结合位点,且ELK4在NSCLC中的表达与AS-tDR-007333正相关。si-ELK4能显著抑制NSCLC增殖,AS-tDR-007333的过表达可以促进细胞内ELK4的表达。借助CHIP-PCR和荧光素酶报告基因检测证实ELK4直接结合MDE29启动子。表明AS-tDR-007333与ELK4相互作用,从而调控MED29转录。

建立NSCLC肿瘤模型后,给予AS-tDR-007333 inhibitor或NC进行处理,发现AS-tDR-007333 inhibitor组肿瘤体积及重量明显小于对照组,AS-tDR-007333 inhibitor肿瘤组织中AS-tDR-007333、HSPB1、ELK4和MED29的RNA表达水平受到抑制,IHC显示MED29和Ki-67蛋白水平的表达在AS-tDR-007333 inhibitor的处理下受到抑制,表明在体内抑制AS-tDR-007333的表达后可抑制NSCLC肿瘤的生长。
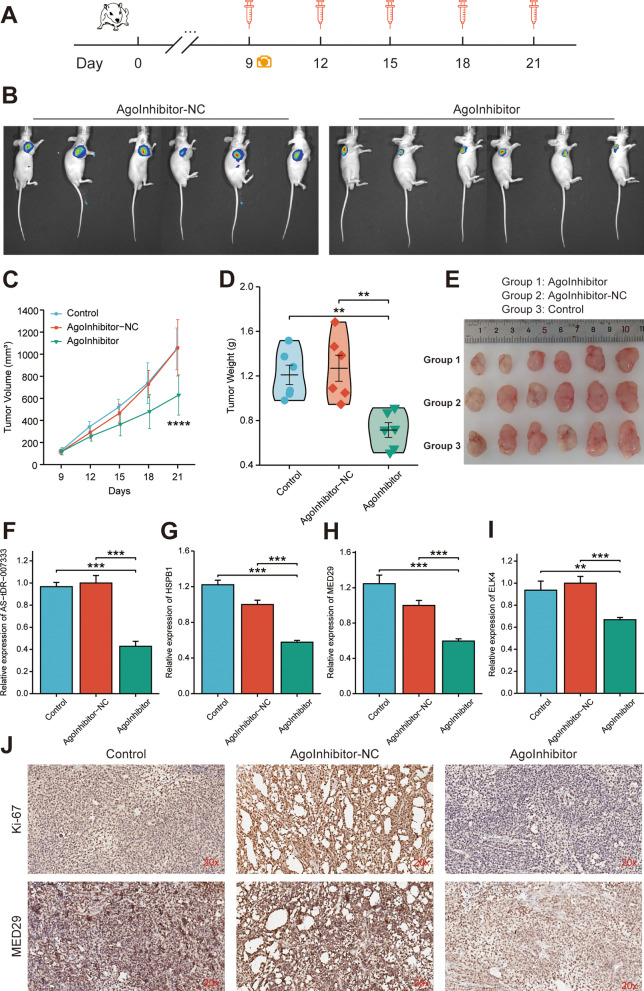

讨论:
在本研究中作者首次发现一个新的tRF AS-tDR-007333作为致癌基因,能促进NSCLC的发展,其作用机制不同于以前发现tRF的作用机制,它能通过与结合蛋白HSPB1相互作用以修饰组蛋白并激活转录因子ELK4,增强MED29启动子活性,从而促进MED29基因的表达,促进NSCLC细胞的恶性发展,揭示AS-tDR-007333可作为NSCLC的诊断和预后标志物或治疗靶点。







