研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Nat Cell Biol】21+ 硬性基质诱导外泌体分泌促进肿瘤生长
1049 人阅读发布时间:2023-08-30 14:12
组织纤维化和细胞外基质(ECM)硬化促进肿瘤进展。ECM调节其接触细胞的机制已被广泛研究。然而,硬度如何影响肿瘤进展微环境中的细胞间通讯仍然未知。湾湾今天分享发表在【Nat Cell Biol】上的一篇题为“Stiff Matrix Induces Exosome Secretion to Promote Tumor Growth”文章,作者报道硬性ECM刺激癌细胞外泌体的释放。描述了一种将硬性ECM与Akt的激活联系起来的分子途径,Akt的激活反过来促进gtp加载到Rab8,从而驱动外泌体的分泌。作者进一步表明,生长在变硬ECM上的细胞产生的外泌体有效地促进了肿瘤的生长。蛋白质组学分析显示,在硬性ECM上生长的肿瘤细胞衍生的外泌体处理的细胞中,Notch信号通路被激活,这与作者对患者肝组织的基因表达分析一致。本研究揭示了调节外泌体分泌的分子机制,并为ECM的机械特性如何控制肿瘤微环境以促进肿瘤生长提供了见解。

研究结果
1.基质硬化促进外泌体分泌
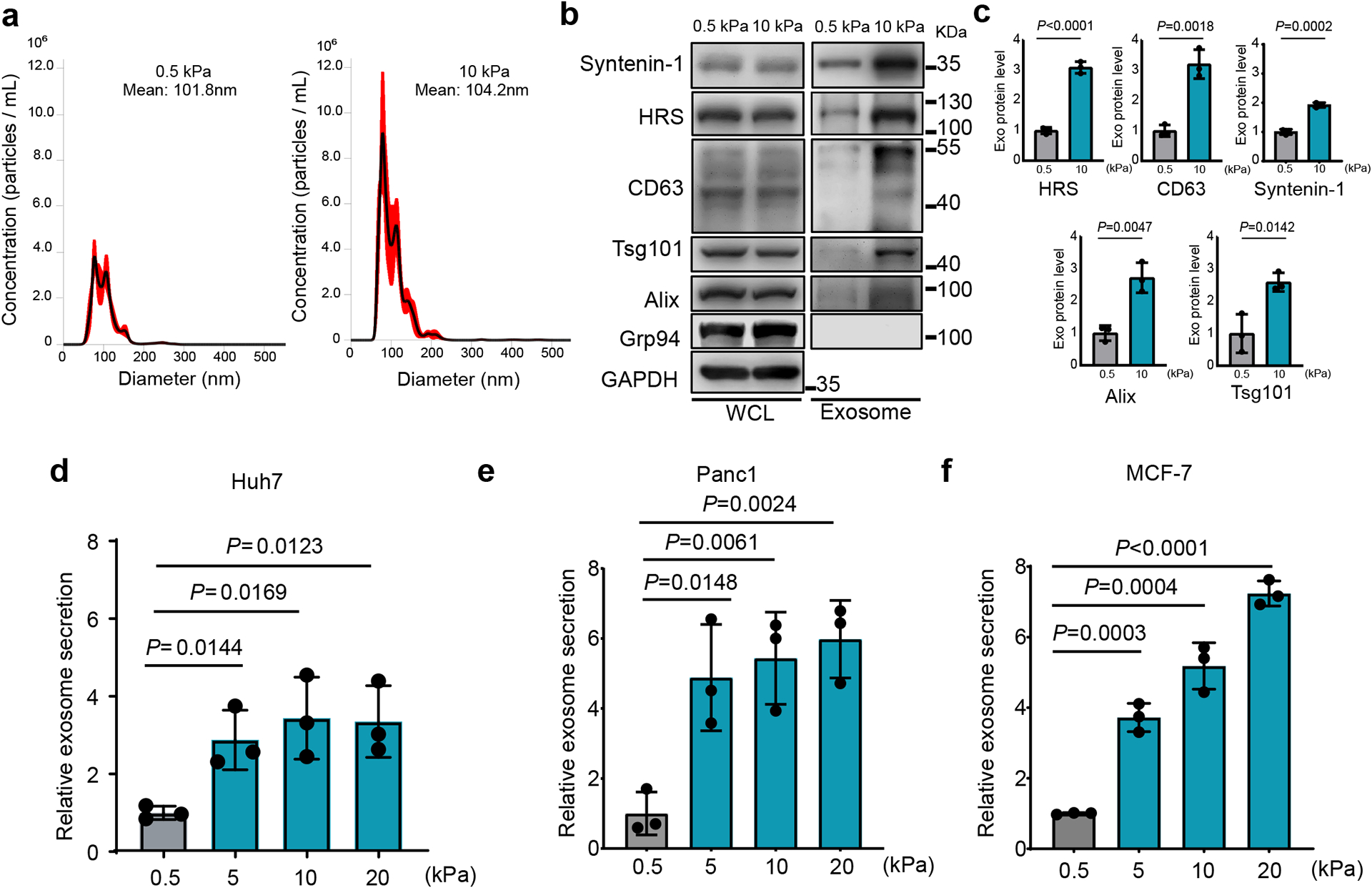
图1a:收集Huh7细胞在软性(0.5 kPa)或硬性(10 kPa)基质上生长的条件培养基。在离心耗尽细胞碎片和大囊泡后,将含有外泌体的上清液进行NTA检测。
图1b:在全细胞裂解液中对外泌体标记物(HRS, Syntenin-1, Alix, Tsg101和CD63)进行免疫印迹,并在软性和硬性基质上纯化107个Huh7细胞的外泌体。
图1c:定量测定HRS、Syntenin-1、CD63、Alix、Tsg101的水平。
图1d-f:将相同数量的细胞(Huh7、Panc1和MCF7)在不同硬度的基质上释放的外泌体进行量化,将0.5 kPa基质上细胞释放的外泌体量归一化为1。
2.Akt促进硬性基质上生长的细胞分泌外泌体
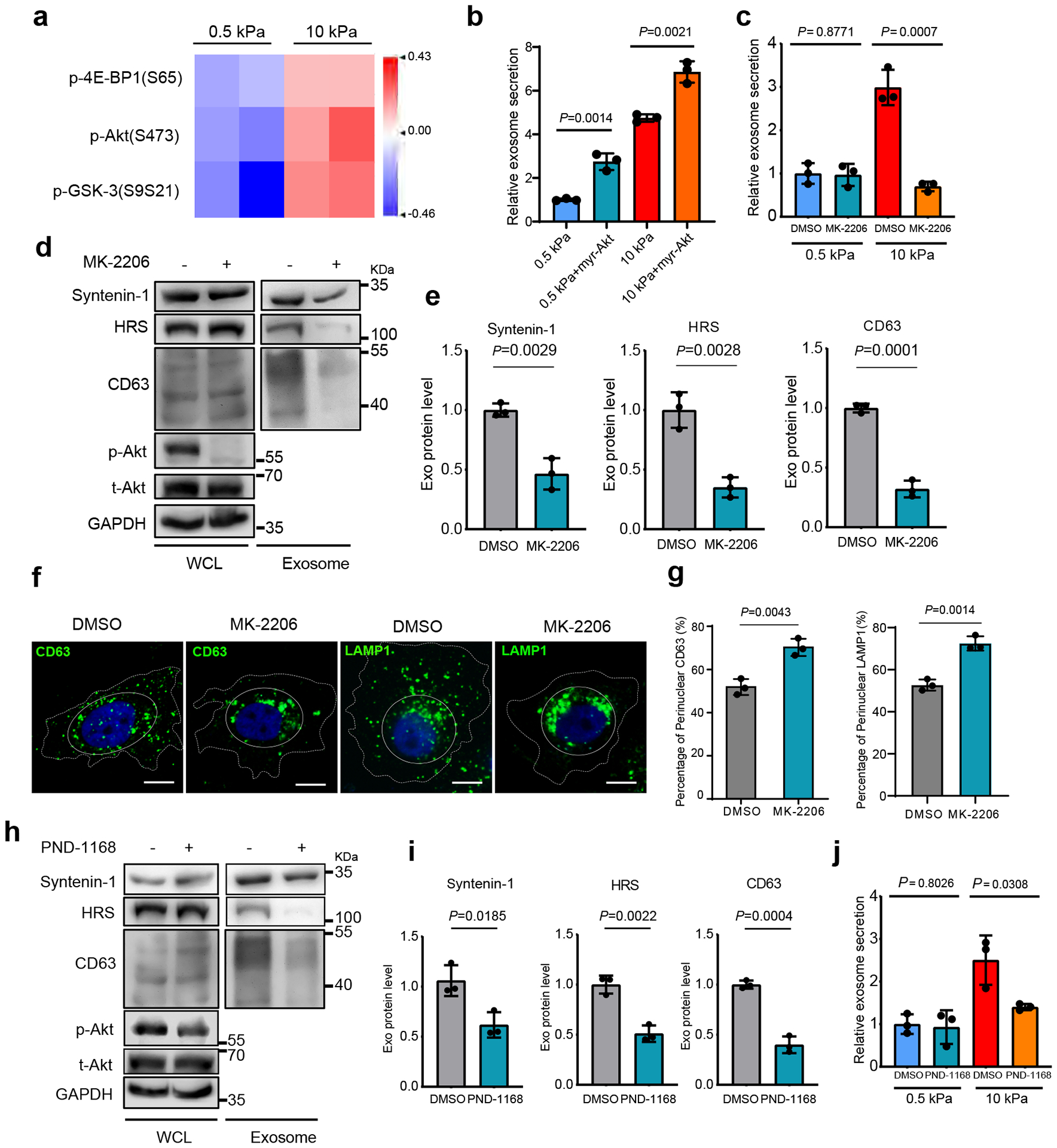
图2a:RPPA数据的热图显示了在软性与硬性基质上生长的Huh7细胞中P-Akt及其下游信号蛋白p-4E-BP1和pGSK-3的水平。
图2b:表达GFP对照或myr-Akt的Huh7细胞外泌体在软性或硬性基质上进行NTA分析。
图2c:用DMSO或Akt抑制剂MK-2206处理软性或刚性基质上生长的Huh7细胞。软性基质上DMSO处理的细胞外泌体浓度归一化为1。
图2d-e:用DMSO或MK-2206处理的等量Huh7细胞培养基中纯化外泌体。免疫印迹法检测全细胞裂解物和纯化外泌体中HRS、Syntenin-1和CD63的水平,并量化表达水平。同时检测WCL中总Akt和p-Akt。
图2f-g:用MK-2206处理Huh7细胞并进行CD63和LAMP1免疫染色,并进行定量百分比。
图2h-i:用FAK抑制剂PND-1168处理在硬性基质上生长的等量Huh7细胞,纯化条件培养基中的外泌体。检测外泌体标志物(HRS、Syntenin-1和CD63)并量化表达水平。同时检测细胞裂解物中t-Akt和p-Akt的水平。
图2j:用FAK抑制剂PND-1168处理软性和硬性基质上生长的Huh7细胞。
3.基质硬化导致Rab8激活,从而调节外泌体的分泌
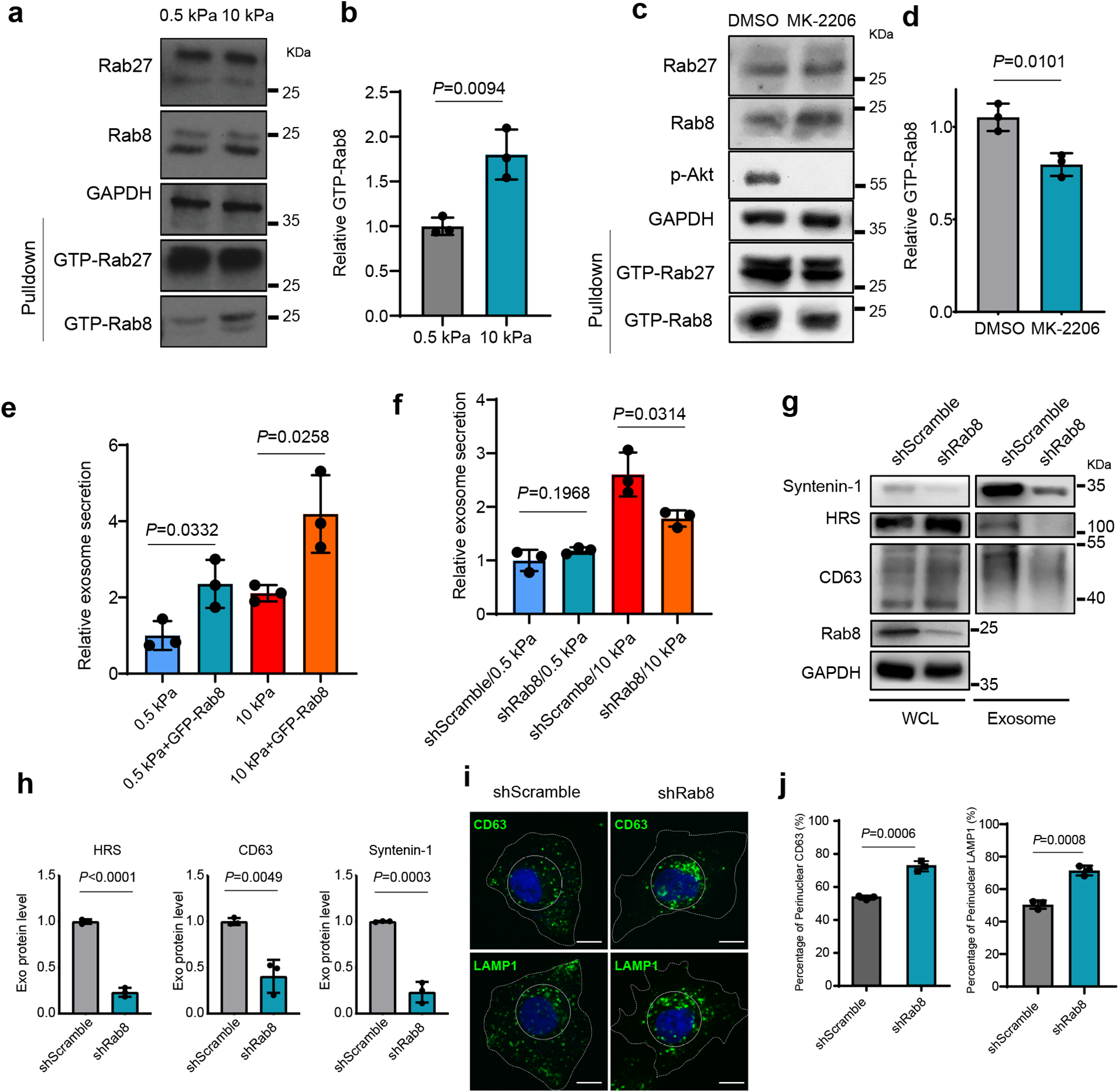
图3a:用GST-JFC1 RBD融合蛋白孵育在0.5 kPa或10 kPa基质上生长的相同数量的细胞裂解物。用免疫印迹法分析细胞裂解液中的Rab8和Rab27,以及与GST-JFC1 RBD结合的活化形式的Rab8和Rab27。
图3b:通过ImageJ定量GTP-Rab8,并归一化为软性基质上细胞的水平。
图3c:在硬性基质上生长的细胞用DMSO或MK-2206处理,裂解GST-JFC1 RBD。western blotting分析蛋白。
图3d:通过Image J定量测定GTP-Rab8和GTP-Rab27,并将其归一化为DMSO处理后的细胞水平。
图3e:表达GFP或GFP- rab8的Huh7细胞分别生长在软性基质和硬性基质上。收集条件培养基用于NTA。外泌体浓度归一化为在软性基质上表达GFP的细胞的浓度。
图3f:从转染了对照shRNA或Rab8 shRNA的Huh7细胞中收集条件培养基,在软性或硬性基质上进行NTA。外泌体浓度归一化,与软性基质上的细胞浓度一致。
图3g-h:在硬性基质上生长的Huh7细胞的条件培养基中,通过超离心纯化Rab8敲除或不敲除的外泌体,并从相同数量的细胞中装载外泌体,进行HRS, Syntenin-1和CD63的免疫印迹,并定量分析。
图3i-j:用对照或Rab8 shRNA处理Huh7细胞,然后进行CD63和LAMP1的免疫染色,并进行定量分析。
4.Rabin8被Akt磷酸化并激活
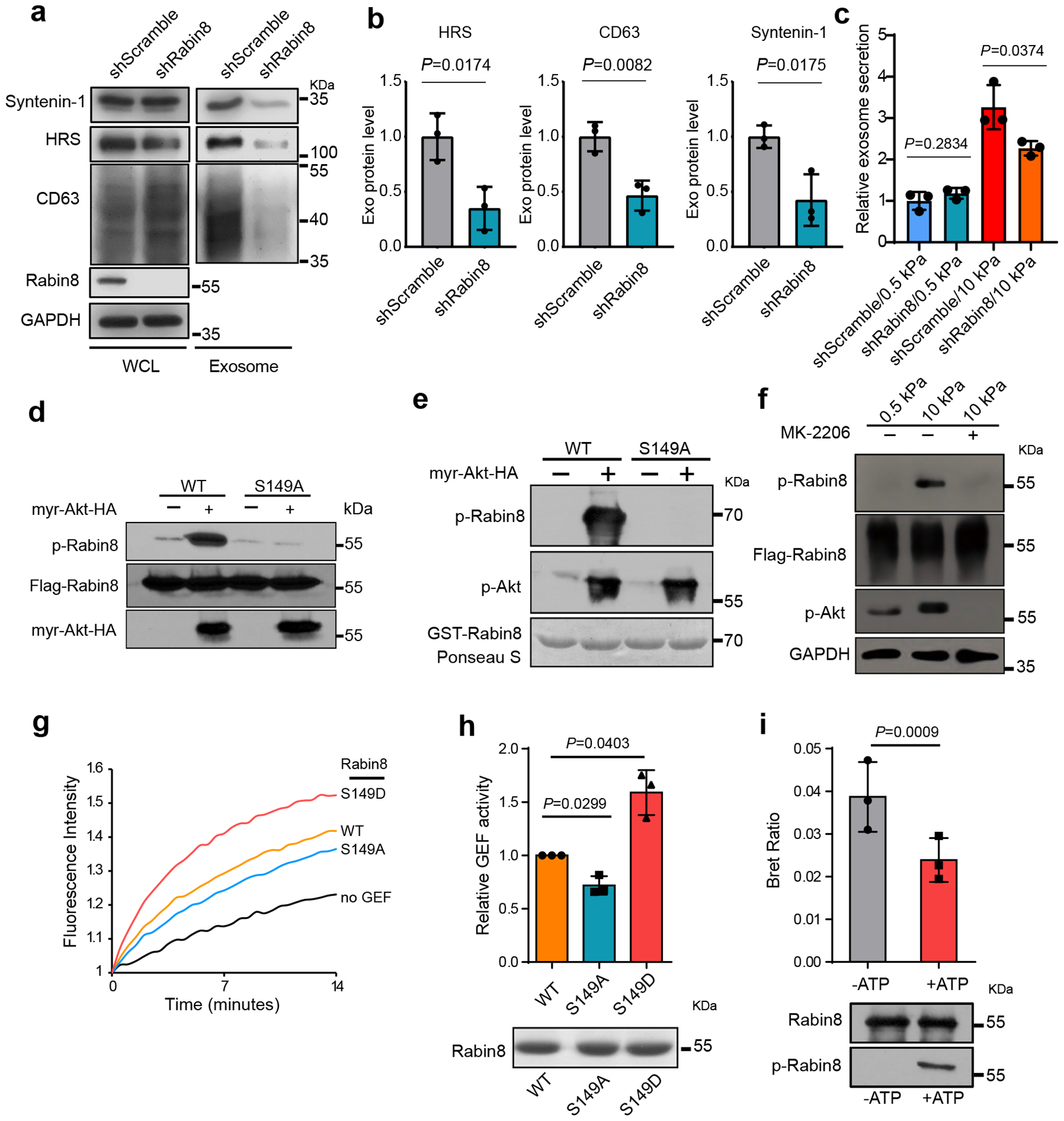
图4a-b:在硬性基质上生长的Huh7细胞转染对照或Rabin8 shRNA。细胞培养基中的外泌体通过超离心纯化,并从相同数量的细胞中装载外泌体,用抗HRS, CD63和Syntenin-1的抗体进行免疫印迹并定量分析。
图4c:在软性基质和硬性基质上分别收集对照或Rabin8 shRNA处理细胞的条件培养基进行NTA。外泌体浓度与软性基质上转染对照shRNA的细胞的外泌体浓度归一化。
图4d:将标记野生型Rabin8 (WT)或磷酸化缺陷突变型Rabin8 (S149A)与myr-Akt或对照载体共表达到细胞中。用抗flag M2珠分离Flag-Rabin8。用phospho-Akt底物抗体检测Rabin8被Akt磷酸化的情况。
图4e:纯化的GST-Rabin8与纯化的myr-Akt或不纯化的myr-Akt孵育。用Akt磷酸化底物抗体检测Rabin8的体外磷酸化。
图4f:表达Flag-Rabin8的Huh7细胞分别生长在软、硬基质上。用抗flag M2珠拉下Flag-Rabin8,用Akt磷酸化底物抗体检测其磷酸化情况。用MK-2206处理细胞可抑制Rabin8磷酸化。
图4g:测定了野生型Rabin8、缺磷型Rabin8突变体(S149A)和拟磷型Rabin8突变体(S149D)催化的与Rab8结合的GDP-BODIPY的交换。
图4h:7分钟时GEF活动的量化。Coomassie蓝染色显示GEF交换试验中使用的蛋白质样品。
图4i:纯化的Rabin8-NLHT蛋白首先与活性Akt(含或不含ATP)孵育,然后用于BRET试验。BRET比率(620nm/460nm)比较。
5.硬基质诱导外泌体促进肿瘤生长
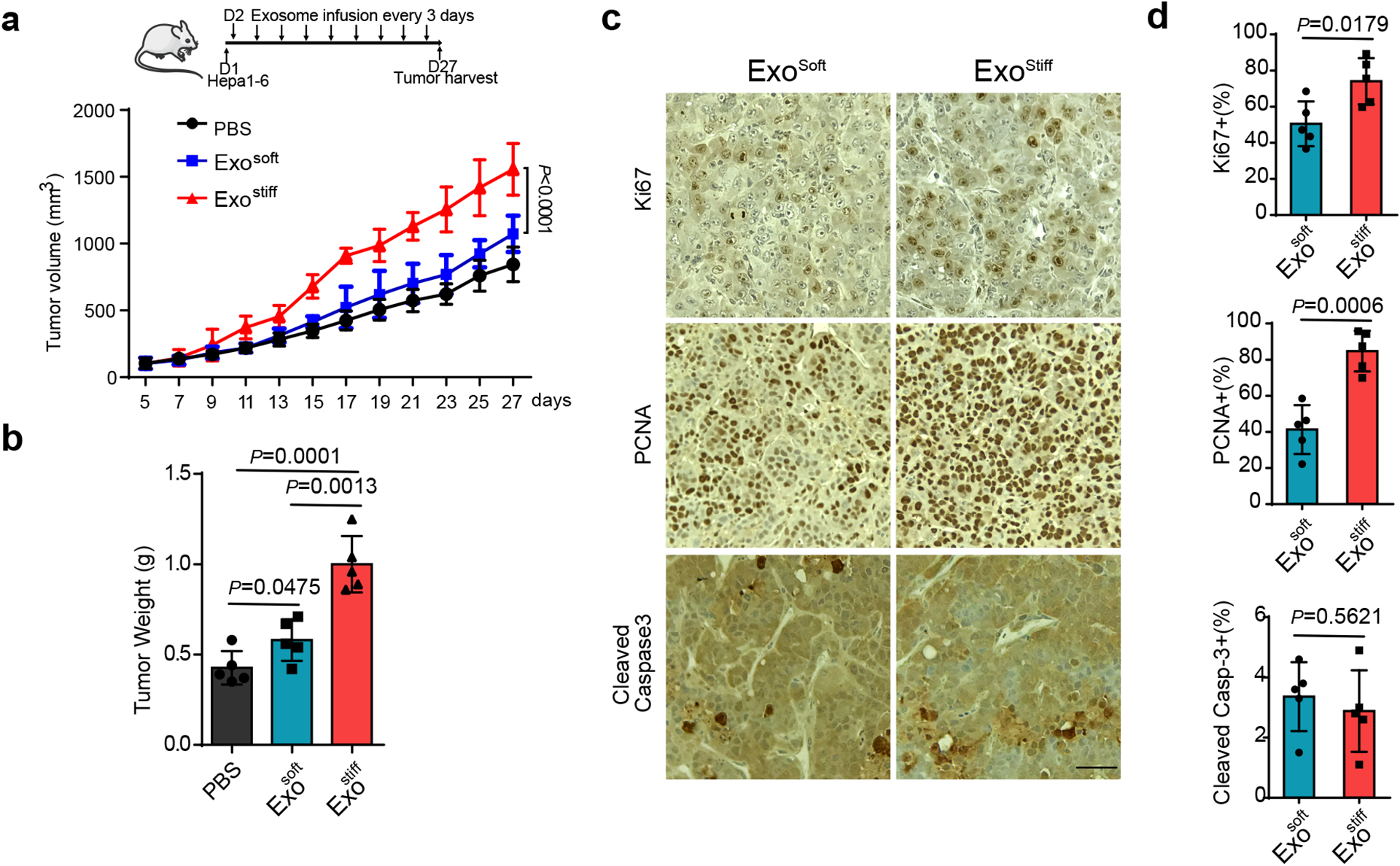
图5a:注射PBS和外泌体的C57L/J小鼠Hepa1-6肿瘤生长曲线。
图5b:PBS、Exosoft或Exostiff治疗C57L/J小鼠后Hepa1-6肿瘤的重量。
图5c-d:Exosoft或Exostiff处理小鼠异种移植物后Ki67、PCNA和cleaved Caspase3的免疫组化。
6.在硬性ECM上生长的细胞或Exostiff处理的细胞中,Notch信号被激活
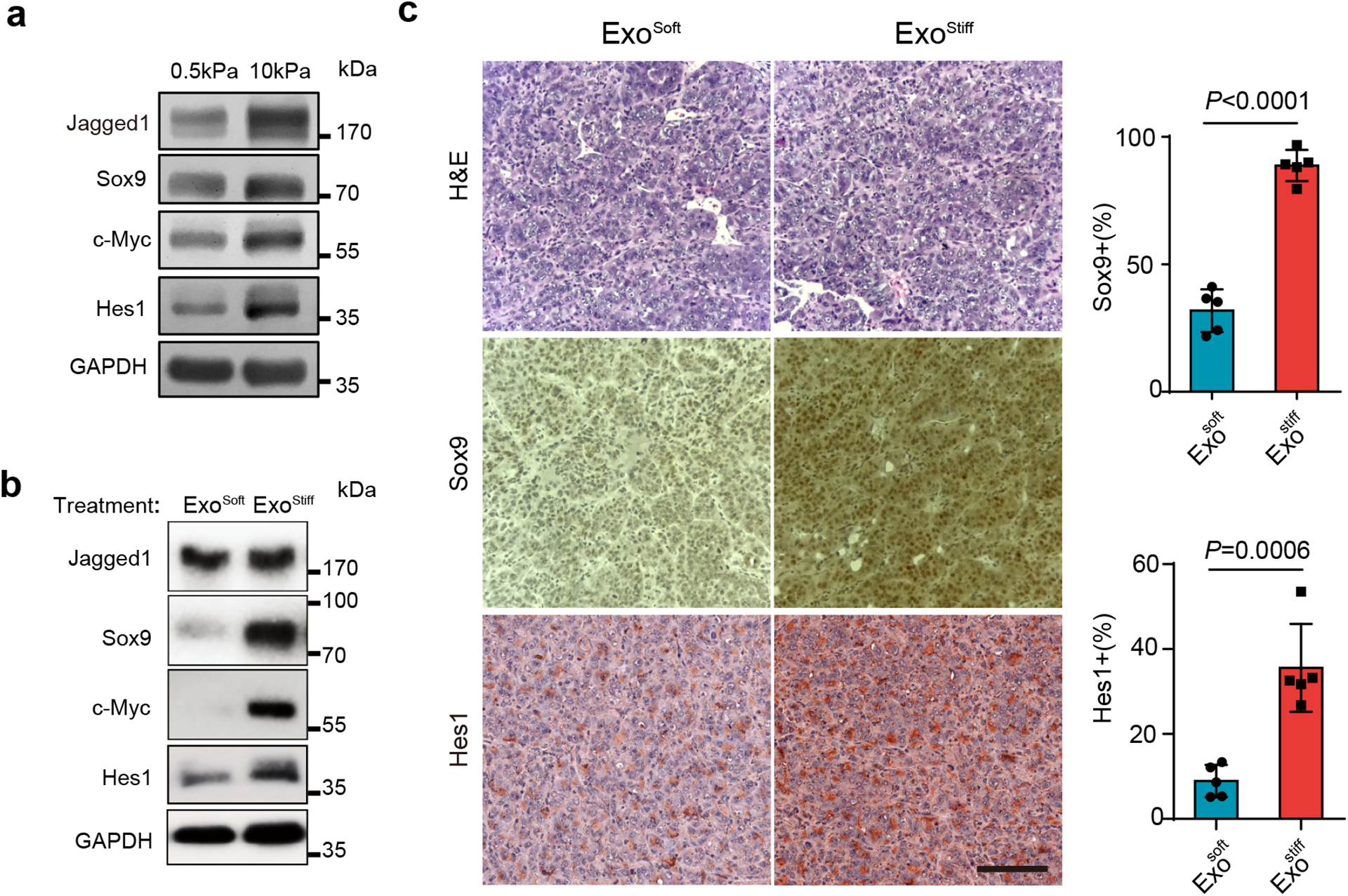
图6a:将生长在0.5或10 kPa基质上的Huh7细胞裂解,Western blot分析证实,在硬性基质上培养的细胞中,Sox9、c-Myc、Jagged1和Hes1的表达水平较高。
图6b:在软性基质上生长的Huh7细胞分别用Exosoft或Exostiff处理。与Exosoft处理的细胞相比,Exostiff处理的细胞中Notch下游蛋白Sox9、c-Myc和Hes1的表达升高。
图6c:Exosoft或Exostiff处理小鼠肿瘤,第27天收获肿瘤组织,用HE染色、Sox9或Hes1免疫组化染色。exostiff处理的肿瘤组织显示出更高水平的Sox9和Hes1表达,表明Notch信号被激活。
7.Jagged1富含Exostiff
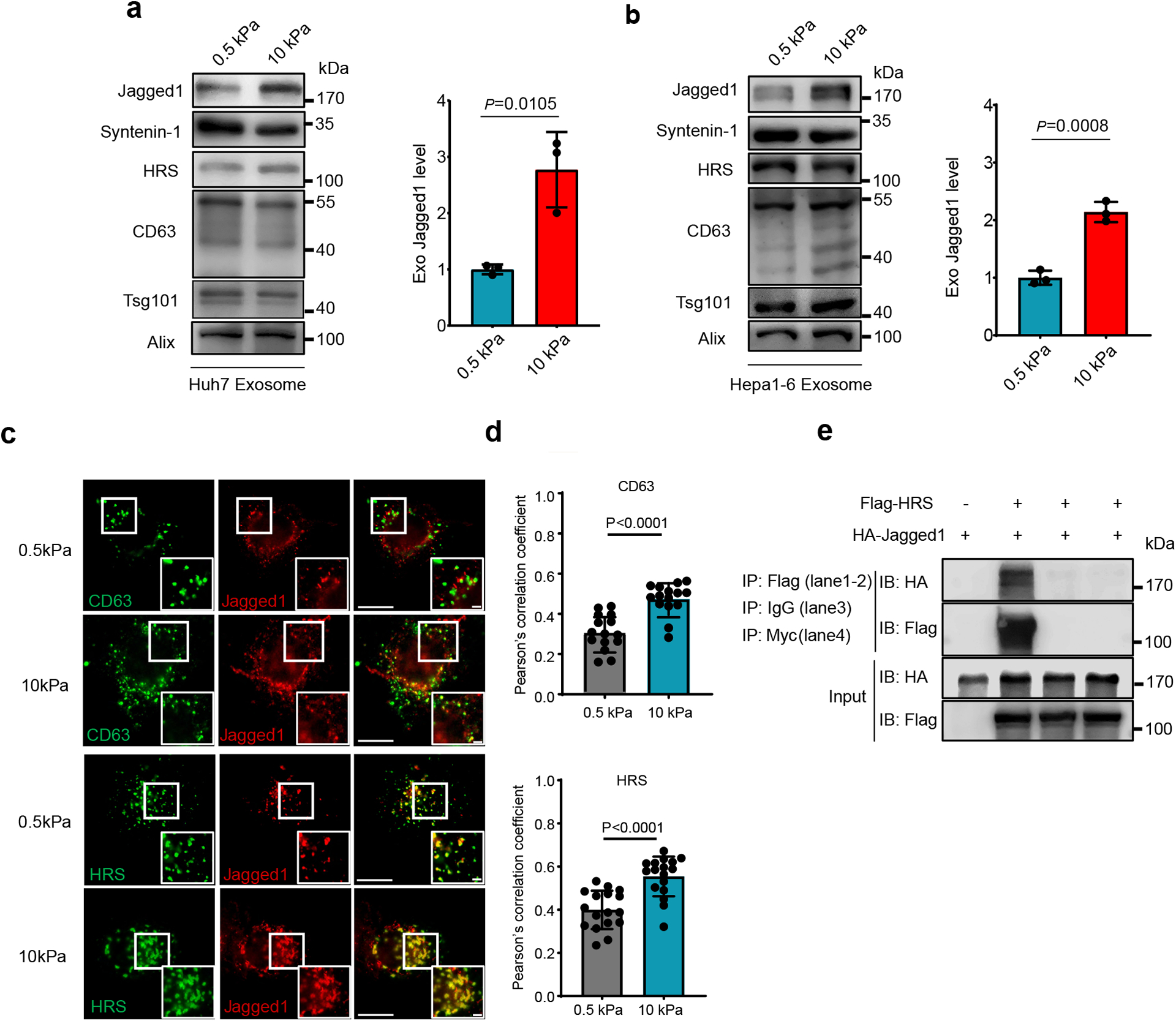
图7a-b:从软性和硬性基质上的Huh7 (a)或Hepa1-6细胞(b)的条件培养基中纯化外泌体。装载相同数量的外泌体,通过western blot分析,Huh7细胞和Hepa-6细胞的Exostiff中都富集了Jagged1。
图7c-d:荧光显微镜显示,在硬性基质上生长的细胞中,Jagged1与外泌体标志物CD63和介导外泌体转运进入MVEs的ESCRT-0亚基HRS具有更高水平的共定位。
图7e:免疫共沉淀实验显示Jagged1与HRS相关。
结论
作者的研究结果揭示了从ECM硬性基质到外泌体释放的分子途径。最近,也有报道称Akt可以磷酸化Rabin8,从而影响Rab11a与其效应物WDR44在原发性纤毛发生过程中的结合。在硬性基质ECM条件下,研究其他rabin8相关蛋白在外泌体分泌中的作用将是有趣的。在功能水平上,作者研究了硬性基质ECM下产生的外泌体是否影响肿瘤生长。作者的数据显示,与Exosoft相比,Exostiff显著促进了肿瘤细胞的生长,这表明ECM硬性基质不仅影响接触肿瘤细胞的内在致癌信号,还通过产生促瘤外泌体影响肿瘤细胞。Exostiff的促瘤作用可能是通过其对肿瘤微环境中不同类型的细胞(如免疫细胞和成纤维细胞)的影响而介导的,而不是肿瘤细胞。
除了进一步了解外泌体生物发生的机制外,作者的研究结果还强调需要考虑外泌体生物发生、分泌和功能研究中使用的底物的力学特性。这种考虑不仅适用于癌症,也可能适用于其他疾病的研究,如神经退行性疾病和心血管疾病。






