研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Theranostics】12+,Tsp-1+小胶质细胞通过降低miR-27a-5p外泌体维持内皮细胞中Smad3表达,从而减弱视网膜新生血管
925 人阅读发布时间:2023-08-24 09:52
具有一系列功能的小胶质细胞在视网膜血管生成的病理调节中起着关键作用。然而在病理性新生血管形成过程中,视网膜小胶质细胞的有益贡献及其相应机制尚不清楚。一篇被发表在【Theranostics】上的题为“Tsp-1+ microglia attenuate retinal neovascularization by maintaining the expression of Smad3 in endothelial cells through exosomes with decreased miR-27a-5p”的研究中,作者利用生物信息学工具和公共数据集分析脊髓和视网膜小胶质细胞的单细胞转录组特征。对于血管生成的调节,作者发现MG3小胶质细胞(来自脊柱的小胶质细胞群)比来自视网膜的RMG1小胶质细胞群具有更多的抗血管生成特征。此外,Tsp-1(一种有效抑制血管生成的细胞外基质蛋白)对区分这两组小胶质细胞至关重要。为了证实生物信息学结果,作者利用OIR动物模型和BV2小胶质细胞系研究Tsp-1+小胶质细胞在视网膜微环境中的作用和功能。通过一系列的Tsp-1基因功能缺失研究、小胶质细胞外泌体实验和内皮细胞形态学检测,揭示了通过小胶质细胞和内皮细胞之间的细胞间通讯调节视网膜血管生成的潜在机制。

研究结果
1.脊髓损伤新生小鼠和OIR小鼠视网膜中的小胶质细胞亚群具有一致的抗血管生成特征
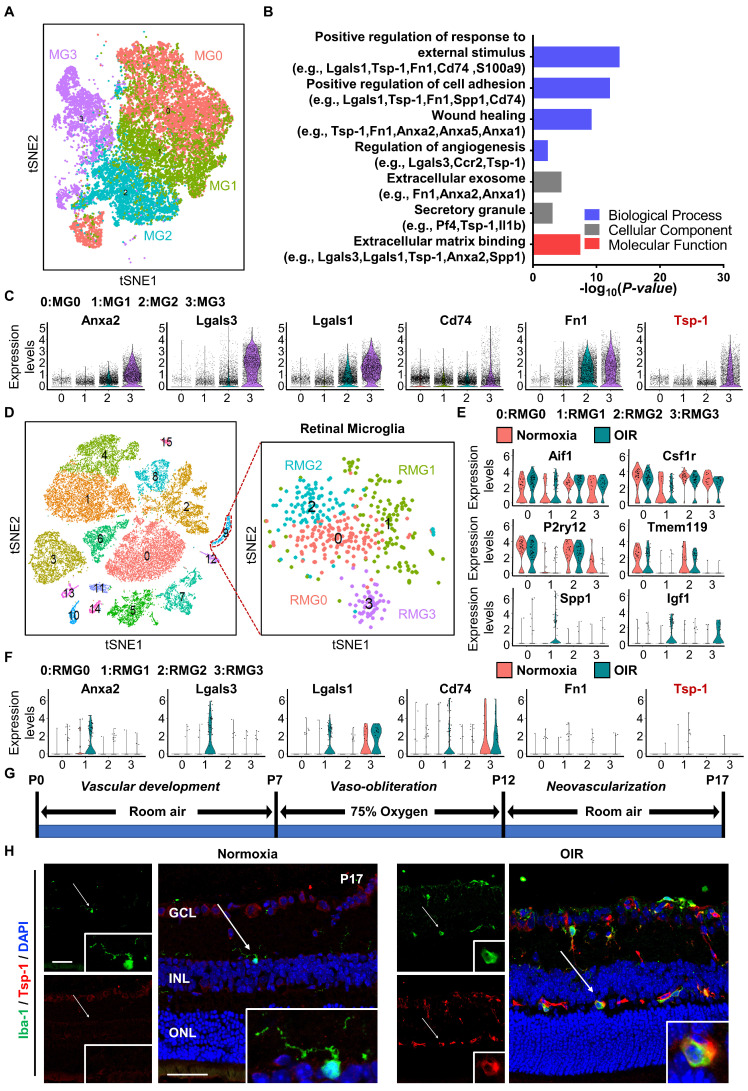
图1A: t-SNE图显示出生后第2天从小鼠损伤脊髓中分离出的4簇小胶质细胞。图1B:选定的基因本体(GO)术语和MG3中富集的相关基因。功能富集GO分析表明,与新生血管形成相关的许多途径具有统计学意义。
图1C:小提琴图显示MG3中Anxa2、Lgals3、Lgals1、CD74、Fn1和Tsp-1的高水平表达,结果表明MG3的标记基因在创面愈合、血管生成和细胞粘附的正向调节中显著富集。
图1D:正常缺氧和氧致视网膜病变(OIR)视网膜P14和P17(左图)和小胶质细胞亚聚类分离细胞的t-SNE图显示了4个不同的细胞群(右图)。
图1E-F:小提琴图显示6个小胶质细胞相关标记基因(Aif1、Csf1r、P2ry12、Tmem119、Spp1和Igf1) 和6个血管生成相关基因(Anxa2、Lgals3、Lgals1、CD74、Fn1和Tsp-1)在4个视网膜小胶质细胞簇中的差异表达。
图1G:采用OIR模型,实验验证P17点激活的视网膜小胶质细胞中Tsp-1的表达模式。
图1H:免疫荧光染色显示,在常氧视网膜中仅存在少量褐色脂肪细胞1 (Iba-1)+小胶质细胞的诱导,且呈分枝状静息状态,胞体小,突细而长。相比之下,Iba-1+小胶质细胞在OIR视网膜中显著增加。特别是,大多数小胶质细胞表现出激活状态,其特征是细胞体增大,板足厚而短。此外,在OIR视网膜中观察到几个具有强大的Tsp-1信号与Iba-1+共定位细胞。
2.Tsp-1通过源自小胶质细胞的外泌体抑制HUVEC的迁移和管的形成
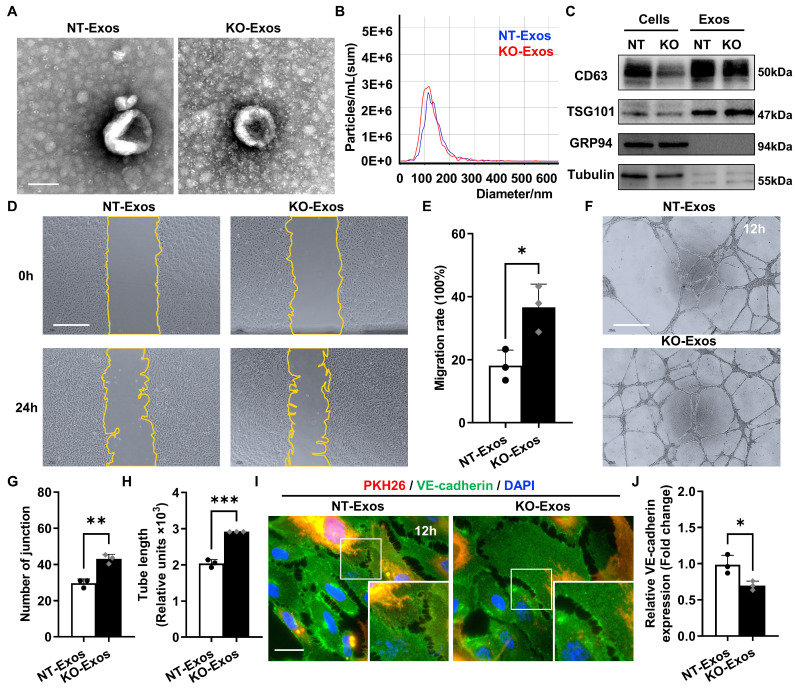
图2A: NT-Exos和KO-Exos的代表性TEM图像。囊泡直径约50- 150nm。
图2B: NTA显示外泌体的平均大小和数量(NT-Exos: 97.9%的外泌体大小为117.4 nm,蓝色;KO-Exos: 96.6%的外泌体大小为110.9 nm,红色)。
图2C:Western blot分析细胞裂解物或外泌体中外泌体蛋白标记物,结果显示NT-Exos和KO-Exos中存在CD63和TSG101,而不存在GRP94。
图2D-E:NT-Exos或KO-Exos处理HUVEC后0 h和24 h的代表性图像(D)和伤口愈合定量分析(E)。与KO-Exos相比,NT-Exos的存在显著降低了细胞迁移率。
图2F-H:NT-Exos或KO-Exos处理的HUVEC的代表性图像(F)和管形成的量化,包括管结数量(G)和管长(H),显示与KO-Exos组相比,NT-Exos处理的HUVEC的管连接减少。
图2I-J:NT-Exos或KO-Exos处理的HUVEC血管内皮cadherin (VE-cadherin)染色的代表性图像(I)和统计分析(J)。外泌体用PKH26标记。与KO-Exos组相比,NT-Exos处理的HUVEC细胞间连接处VE-cadherin表达显著升高。
3.敲除Tsp-1会影响KO-Exos和NT-Exos中miRNA表达的差异
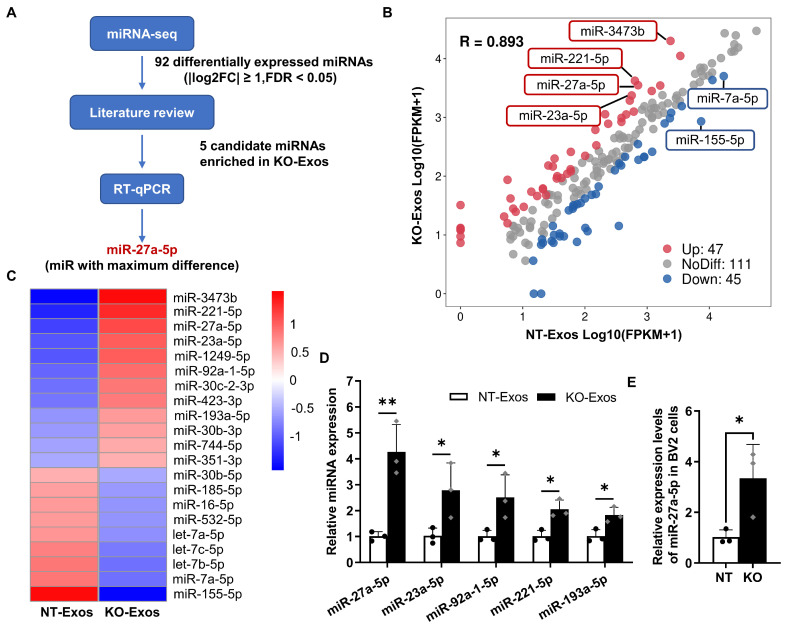
图3A:高通量miRNA测序分析KO-Exos和NT-Exos中的miRNA。
图3B:在KO-Exos和NT-Exos中共检测到203个成熟miRNAs,散点图描述,其中47个miRNAs在KO-Exos中富集,45个miRNAs缺失。
图3C:热图显示NT-Exos和KO-Exos之间富集且差异显著的miRNAs。红色和蓝色分别表示高表达或低表达的miRNAs。
图3D:RT-qPCR显示miR-27a-5p、miR-23a-5p、miR-92a-1-5p、miR-211-5p和miR-193a-5p在KO-Exos中比NT-Exos富集
图3E:RT-qPCR显示miR-27a-5p在NT和KO BV2细胞中的相对表达水平,细胞内miR-27a-5p水平在BV2-KO细胞中升高,从而导致外泌体中miRNA水平升高,最终可能影响HUVEC的功能。
4. 4.Tsp-1缺失导致KO-Exos中miR-27a-5p富集并引发HUVEC迁移
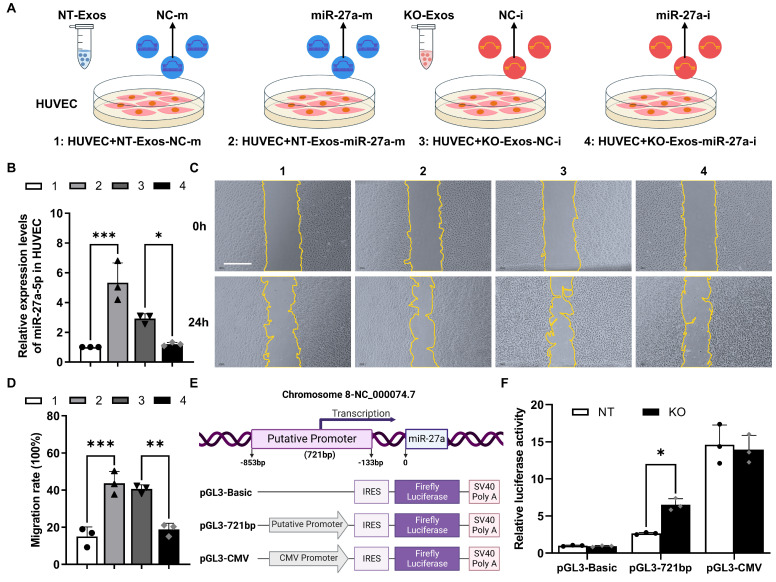
图4A:miR-27a-5p功能增益/功能丧失实验设计示意图。转染合成模拟物对照或miR-27a-5p模拟物的NT-Exos,转染合成抑制剂对照或miR-27a-5p抑制剂的KO-Exos与HUVEC孵育,证明miR-27a-5p在BV2外泌体中的功能。
图4B:RT-qPCR检测HUVEC中miR-27a-5p的表达,结果显示合成的miR-27a-5p mimic从外泌体高效转移到受体细胞,而inhibitor显著降低了miR-27a-5p水平。
图4C-D:划痕实验表明,携带miR-27a-5p mimic的NT-Exos显著增加了HUVEC的迁移。相反,转染miR-27a-5p inhibitor的KO-Exos强烈抑制HUVEC的迁移,这与NT-Exos的结果一致。
图4E:图中显示了miR-27a基因的推定启动子区域以及pGL3-IES-Luc报告基因中miR-27a启动子的构建。pGL3-Basic作为阴性对,pGL3-CMV作为阳性对照。
图4F:pGL3-Basic、pGL3-721bp和pGL3-CMV被转染到BV2-NT或BV2-KO细胞中,荧光素酶活性测定表明pGL3-721bp在BV2-KO细胞中表现出显著的活性转录。
5.Smad3作为miR-27a-5p的功能靶基因,参与外泌体受体细胞的迁移活性调控
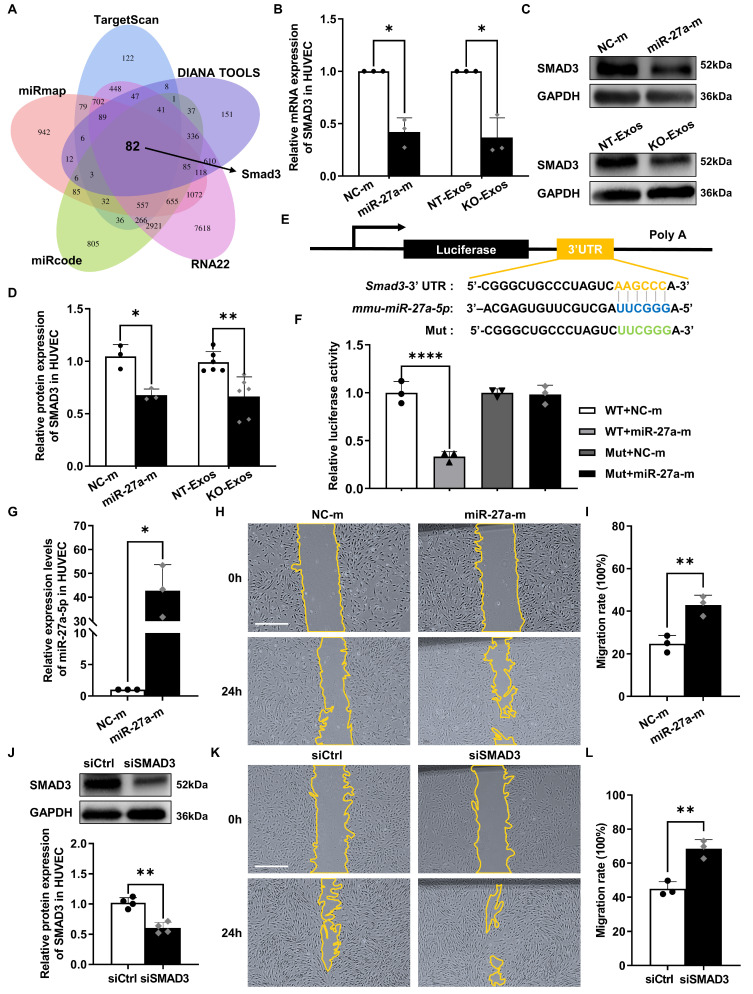
图5A:维恩图显示TargetScan、DIANA TOOLS、RNA22、miRcode和miRmap数据库中候选靶基因的重叠。Smad3是mmu-miR-27a-5p潜在的靶基因之一。
图5B:用合成模拟物对照或miR-27a-5p模拟物转染HUVEC,或用NT-Exos或KO-Exos处理。RT-PCR结果显示,转染miR-27a-m或KO-Exos处理的HUVEC中SMAD3 mRNA水平降低。
图5C-D:Western blot分析(C)和蛋白表达的相对定量分析(D)表明,过表达miR-27a-5p或KO-Exos处理可下调HUVEC中SMAD3的表达。
图5E:Smad3 mRNA的3'-UTR中预测的mmu-miR-27a-5p结合位点示意图。
图5F:用NC-m或miR-27a-m和含有野生型或突变型smad3 3 '-UTR的荧光素酶报告基因共转染HEK-293T细胞的荧光素酶报告基因检测。
图5G:用NC-m或miR-27a-m转染HUVEC,RT-PCR结果显示miR-27a-5p的相对表达量明显升高。
图5H-I:在划伤后0小时和24小时转染NC-m或miR-27a-m的HUVEC划痕实验的代表性图像(H)和相对定量(I)显示,miR-27a-5p过表达增强HUVEC的迁移。
图5J:用非特异性对照siRNA 或小干扰RNA (siSMAD3)转染HUVEC。siSMAD3沉默了HUVEC中SMAD3大部分表达。
图5K-L:siCtrl或siSMAD3转染的HUVEC在0 h和24 h的划痕实验的代表性图像(K)和相对定量(L)表明,SMAD3敲低诱导HUVEC的迁移率更高。
6.NT-Exos和KO-Exos在视网膜中扩散并可能被血管内皮细胞吸收,从而导致OIR小鼠视网膜新生血管的不同命运
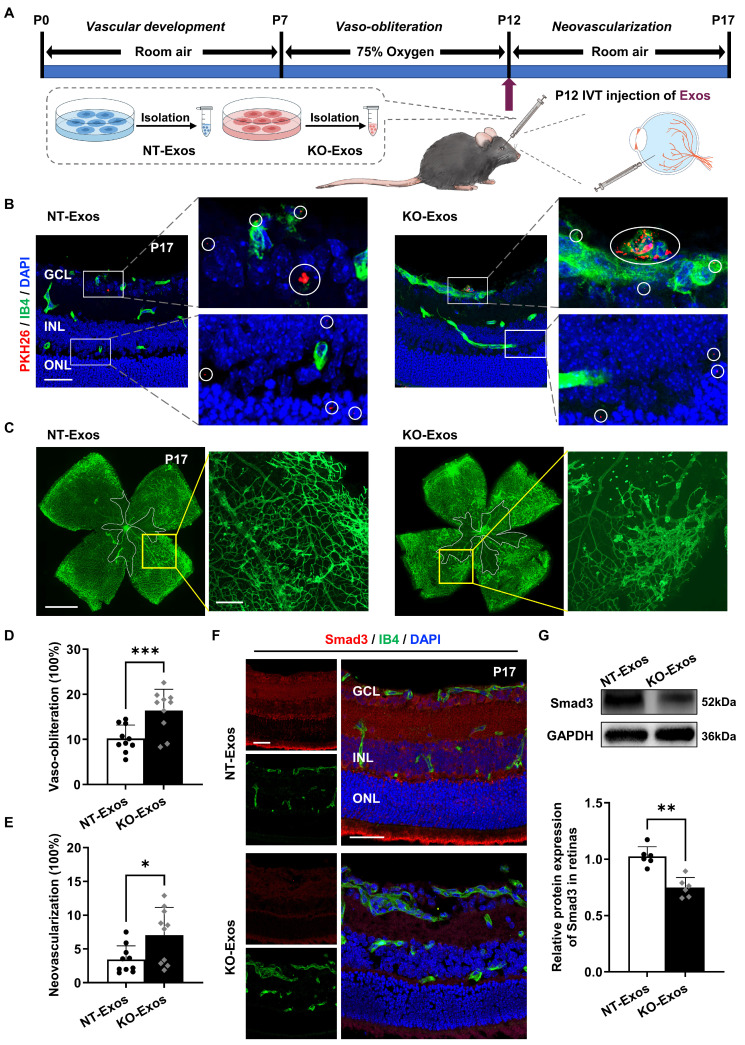
图6A:玻璃体内注射外泌体的氧致视网膜病变(OIR)小鼠示意图。
图6B:用PKH26标记的NT-Exos或KO-Exos处理的OIR小鼠视网膜切片的代表性共聚焦图像。外泌体被视网膜的多个细胞层所占据。PKH26和Isolectin B4 (IB4)共染色显示,一些外泌体内化到视网膜血管内皮细胞(ECs)中。
图6C:NT-Exos和KO-Exos处理的OIR小鼠P17处IB4染色视网膜的代表性图像。中心血管闭塞区被分割(白色边框内),新生血管区扩大(黄色框内)。
图6D-E:定量血管闭塞(D)和新生血管(E)在OIR视网膜的总面积的百分比表示。
图6F:经NT-Exos和KO-Exos处理的小鼠视网膜切片Smad3和IB4共聚焦图像。
图6G:Western blot分析和蛋白表达的相对定量显示,KO-Exos处理可以下调P17时OIR视网膜中Smad3的表达。
7.miR-27a-5p敲低的KO-Exos通过维持视网膜Smad3的表达,重新获得抑制OIR小鼠视网膜血管生成的能力
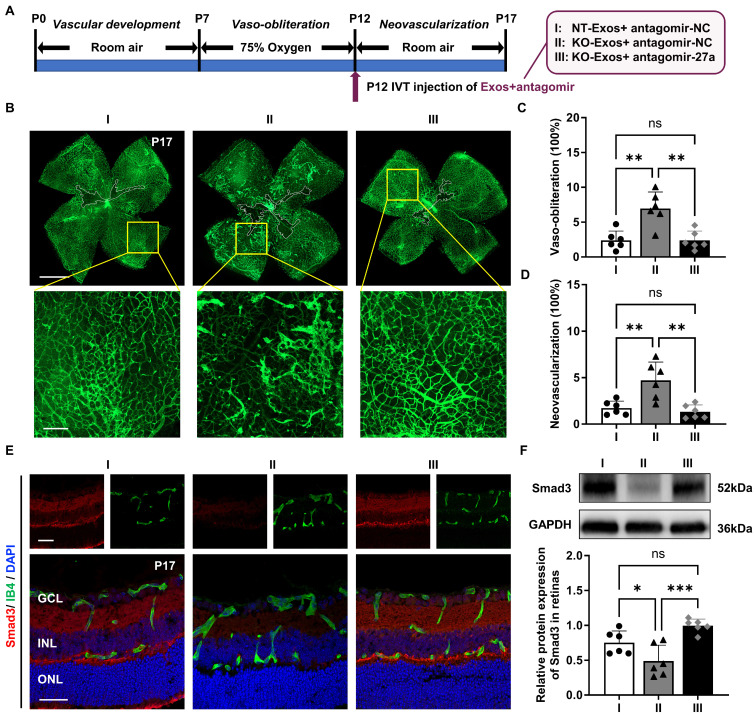
图7A:玻璃体内(IVT)注射负载antagomir的外泌体治疗氧致视网膜病变(OIR)小鼠的示意图。
图7B:用负载antagomir的外泌体处理过的OIR小鼠,获得了P17上用Isolectin B4 (IB4)染色的视网膜平片的代表性图像。中心血管闭塞区被分割(白色边框内),新生血管区扩大(黄色框内)。
图7C-D:血管闭塞(C)和新生血管(D)在OIR视网膜的定量表示为视网膜总面积的百分比。
图7E:用负载antagomir的外泌体处理的小鼠的视网膜切片Smad3和IB4共同染色共聚焦图像。
图7F:Western blot分析和相对定量的Smad3蛋白在P17的OIR视网膜中的表达。
结论
总的来说,这些OIR动物模型的体内结果为Tsp-1/miR-27a-5p/Smad3轴参与视网膜血管生成提供了强有力的证据。激活的小胶质细胞中的Tsp-1在视网膜新生血管形成中发挥重要作用,而这一功能是由具有重要成分miR-27a-5p的小胶质外泌体执行的,miR-27a-5p调节受体血管内皮细胞中Smad3的表达,从而决定视网膜新生血管的命运。
本研究表明,来自视网膜小胶质细胞独特亚型的Tsp-1调节小胶质细胞和血管内皮细胞之间的细胞间通讯。Tsp-1不仅直接干预ECs的迁移和增殖,还改变了外泌体中一些microRNAs的丰度,从而促进了Tsp-1的抗血管生成功能。研究表明,Tsp-1可抑制小胶质细胞中miR-27a-5p的转录活性,从而降低其在外泌体中的丰度,从而降低靶基因Smad3的抑制作用,从而限制视网膜血管的过度生长。因此,该研究揭示了小胶质细胞Tsp-1参与抗血管生成的新机制,可作为一种潜在的临床治疗方法。Tsp-1是一种众所周知的血管生成负调节因子,在多种眼细胞类型中表达,包括内皮细胞、周细胞、星形胶质细胞和小胶质细胞。然而,广泛抑制或增加视网膜中的Tsp-1作为一种治疗策略是不可行的,因为它在单个细胞类型中的功能是多样化的。鉴定具有血管生成调节特异性的视网膜Tsp-1+小胶质细胞可以用于实现精确治疗,通过在小胶质细胞中设计Tsp-1和miR-27a-5p的表达来产生具有最大抗血管生成效力的外泌体,作为一种创新和精确的治疗方法。






