研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Mol Cancer】37+,外泌体衍生的circCCAR1促进肝细胞癌中CD8 +T细胞功能障碍和抗PD1耐药性
793 人阅读发布时间:2023-08-10 14:44
环状RNAs(circRNAs)可以被包裹在外泌体中参与细胞间通讯,影响多种肿瘤的恶性进展。CD8 + T细胞功能障碍是肝细胞癌(HCC)免疫逃逸的主要因素。但外泌体衍生的circRNA对CD8 +T细胞功能障碍的影响还需要进一步探索。在【Mol Cancer】期刊上发表的一篇题为“Exosome-derived circCCAR1 promotes CD8 + T-cell dysfunction and anti-PD1 resistance in hepatocellular carcinoma”的文章中,作者首先发现了一个新的circ_0000240 (circCCAR1),并发现circCCAR1/miR-127-5p/WTAP反馈回路可以促进HCC的生长和转移。HCC细胞释放的外泌体circCCAR1通过阻止程序性细胞死亡1(PD1)降解促进CD8 + t细胞功能障碍,增强了HCC对抗PD1治疗的耐药性。因此,作者的研究结果揭示了circCCAR1在HCC进展中的功能,为研究circrna在HCC免疫治疗中的功能奠定了基础。

研究结果
1. CircCCAR1在HCC组织中升高
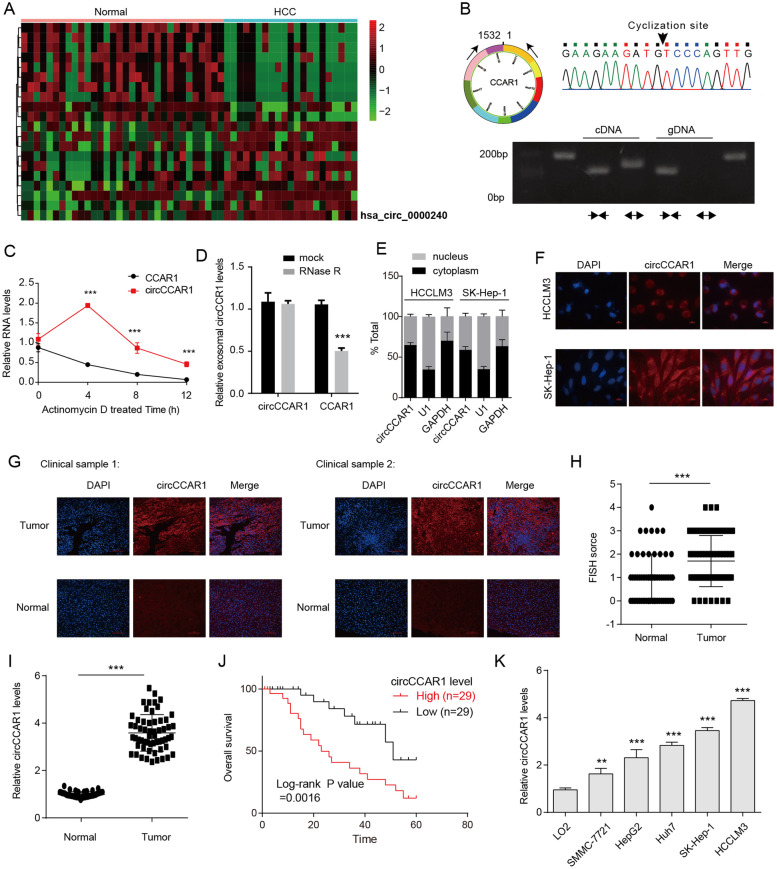
图1A:聚类热图显示健康受试者和HCC患者血清外泌体中的异常circRNAs,其中CircCCAR1在HCC患者血清外泌体中表达水平最高。
图1B:采用不同引物的RT-PCR方法,从HCCLM3细胞的cDNA或基因组DNA (gDNA)中扩增circCCAR1,后剪接连接序列经Sanger测序验证。
图1C:用Dactinomycin处理HCCLM3细胞一段时间后,发现circCCAR1比线性CCAR1转录本更稳定。
图1D:RNase R消化结果显示,与线性宿主基因CCAR1相比,circCCAR1对RNase R酶消化具有抗性。
图1E-F:通过核/细胞质分离实验和RNA荧光原位杂交(FISH)实验观察circCCAR1在HCC细胞系中的亚细胞分布,发现大多数circCCAR1优先定位在细胞质中。
图1G-I:通过FISH和qRT-PCR检测发现,与邻近正常组织相比,HCC患者肿瘤组织中的circCCAR1表达上调。
图1J:生存分析表明,circCCAR1水平升高的HCC患者预后不良。
图1K:RT-QPCR检测正常人肝癌细胞系LO2细胞和HCC细胞系中circCCAR1的表达水平,结果显示circCCAR1在HCC细胞系表达更高。
2.CircCCAR1在体内和体外都能促进HCC的生长
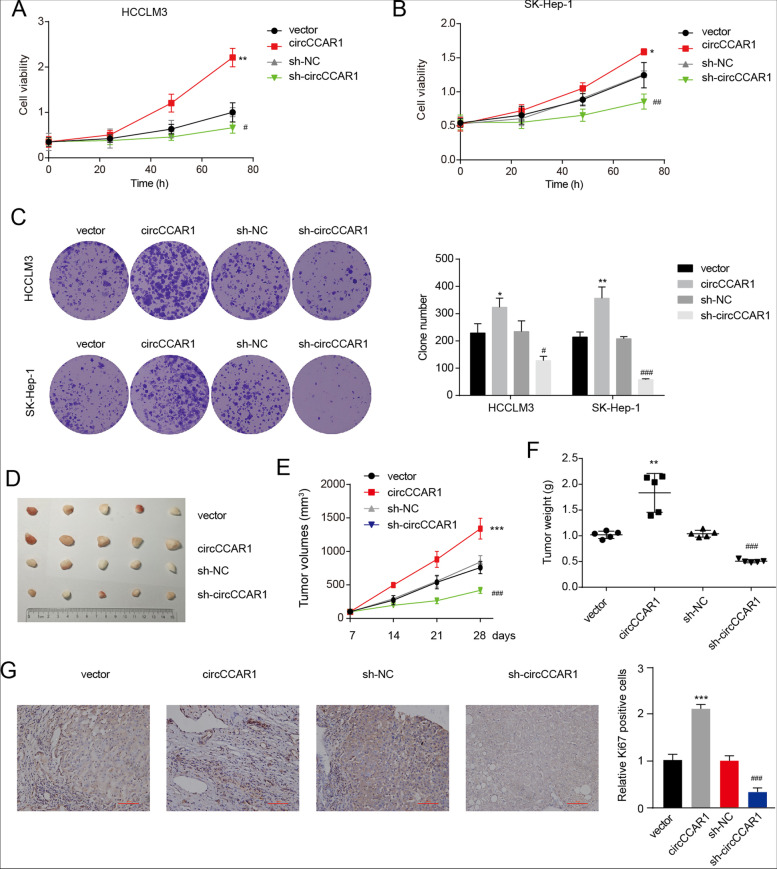
图2A-B:在circCCAR1过表达或缺失后的HCC细胞中进行CCK-8检测,结果显示HCC细胞中circCCAR1的敲低可显著抑制细胞活力。
图2C:在circCCAR1过表达或缺失后的HCC细胞中进行集落形成实验,过表达circCCAR1可显著促进HCCLM3和SK-Hep-1细胞的增殖。此外,circCCAR1的下调会损害HCCLM3和SK-Hep-1细胞的集落形成能力,而circCCAR1的过表达则会产生相反的效果。
图2D-F:异种移植肿瘤照片(D),异种移植肿瘤生长曲线(E),测定肿瘤重量(F)。结果显示过表达circCCAR1促进了异种移植肿瘤的生长,而circCCAR1缺失抑制了肿瘤在体内的生长。
图2G:异种移植瘤Ki67染色,结果显示来自circCCAR1过表达细胞的异种移植物显示Ki67的表达增加,而circCCAR1敲低则表现出相反的效果。
3.CircCCAR1在体内和体外都能促进HCC的转移
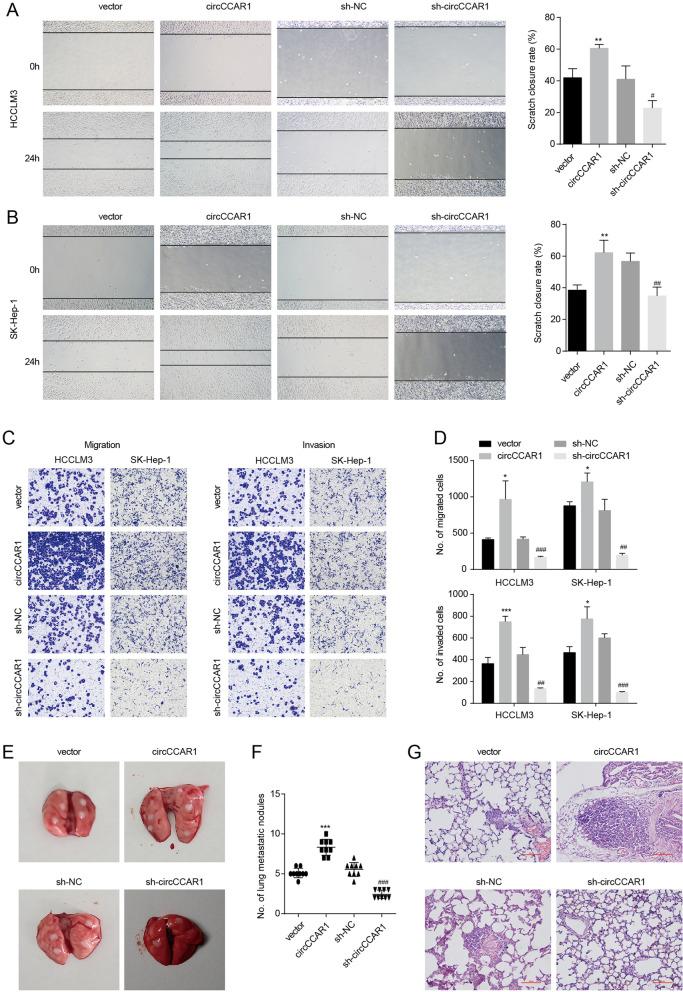
图3A-C:通过伤口愈合和Transwell迁移实验评估circCCAR1对HCC细胞迁移的功能,结果显示circCCAR1缺失减少了HCC细胞的迁移,而circCCAR1过表达增强了HCC细胞的迁移。
图3D:Transwell侵袭实验表明过表达circCCAR1会增加HCC细胞的侵袭能力,而敲低circCCAR1的表达会降低HCC细胞的侵袭能力。
图3E:小鼠肺转移大体观察结果显示,circccar1过表达组100%的小鼠出现转移性结节,而载体组44%的小鼠最终发现转移性结节。
图3F:计算转移结节数量,数据显示,在circCCAR1缺失组中,只有11%的小鼠发现转移性结节。
图3G:肺切片进行H&E染色,结果显示circccar1过表达组的肿瘤结节数量更多,而circccar1缺失组的肿瘤结节数量更少。
4.EP300介导的H3K27ac促进circCCAR1在HCC中的表达
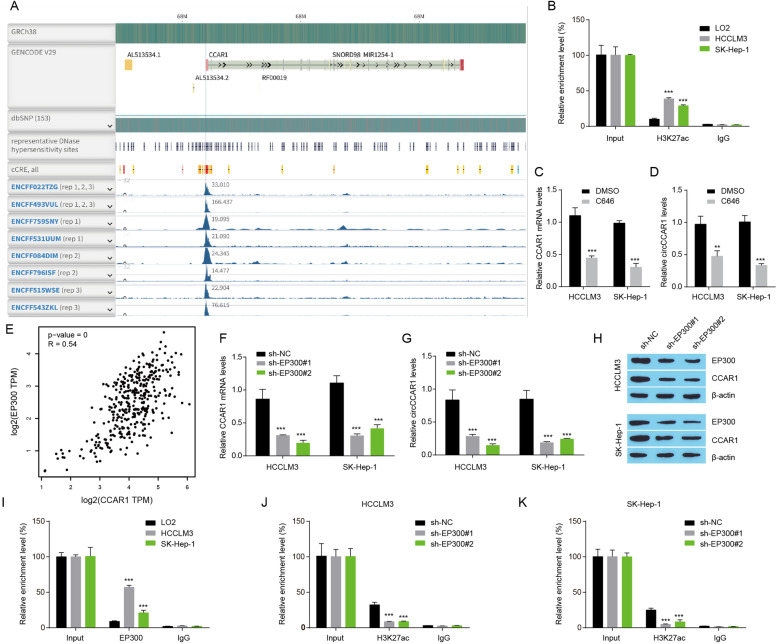
图4A:利用ENCODE分析HepG2细胞CCAR1启动子区域的H3K27ac信号,在CCAR1启动子区域发现了丰富的组蛋白H3K27ac信号,表明组蛋白乙酰化可能控制circCCAR1或CCAR1的表达。
图4B:ChIP-qPCR检测在LO2、HCCLM3和SK-Hep-1细胞中CCAR1启动子中的H3K27ac信号,结果显示富集的H3K27ac位于CCAR1启动子中,并且在HCC细胞系中比在对照LO2细胞中更高。
图4C-D:qRT-PCR检测C646或DMSO处理肝癌细胞48 h后CCAR1 mRNA和circCCAR1的表达,结果显示组蛋白乙酰转移酶(HAT)抑制剂C646降低了CCAR1 mRNA和circCCAR1水平。
图4E:TCGA肝细胞癌中EP300与CCAR1的相关性分析,结果显示E1A结合蛋白EP300与TCGA HCC组织中CCAR1的表达呈正相关。
图4F-G:EP300缺失后检测了HCC细胞中circCCAR1的表达,结果显示EP300的抑制显著降低CCAR1 mRNA和circCCAR1的表达。
图4H:EP300缺失后降低了HCC细胞中EP300和CCAR1蛋白水平。
图4I:ChIP-qPCR检测在LO2、HCCLM3和SK-Hep-1细胞中CCAR1启动子中的EP300信号,结果显示富集的EP300位于CCAR1启动子中,并且在HCC细胞系中比在对照LO2细胞中含量更高。
图4J-K:ChIP-qPCR检测在EP300沉默的HCC细胞中CCAR1启动子中的H3K27ac信号,结果显示EP300缺失降低了CCAR1启动子上占用的H3K27ac。
5.EIF4A3促进了circCCAR1的环化和核输出
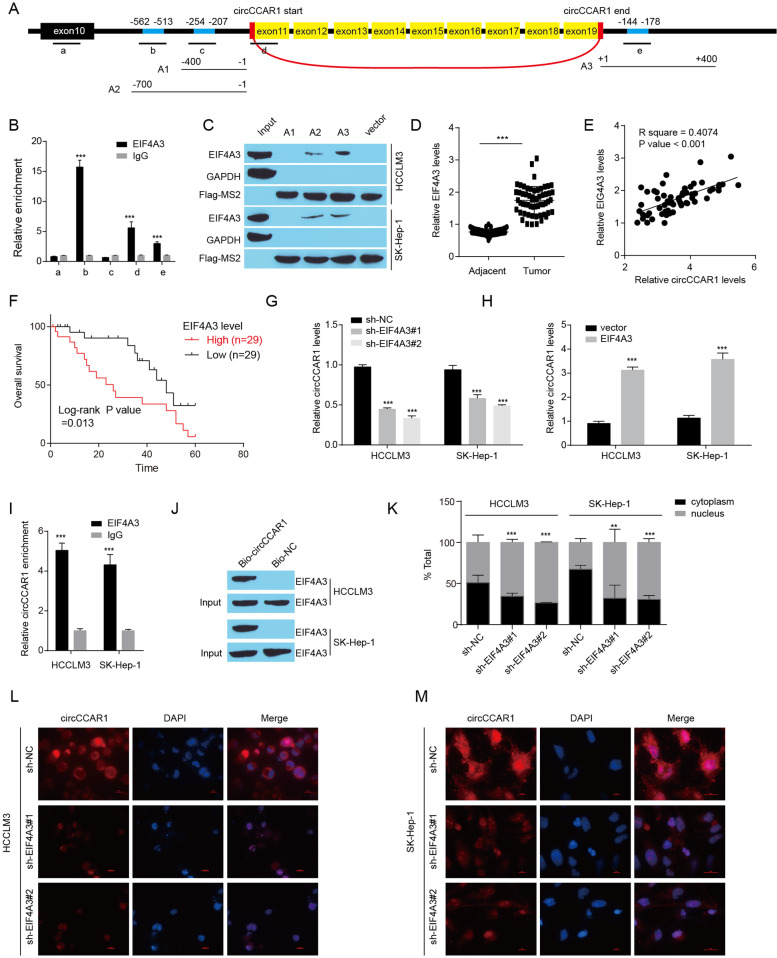
图5A:选择circCCAR1 pre-mRNA中的5个位点(a -e)设计qPCR引物,构建含有EIF4A3结合位点的3个质粒(A1-A3),拉下EIF4A3蛋白。
图5B:通过RIP实验证实EIF4A3与circCCAR1 pre-mRNA的相互作用,发现EIF4A3结合了一个上游推定结合位点、一个后剪接连接位点和一个下游推定结合位点。
图5C:MS2 RNA pull down实验结果证实EIF4A3与circCCAR1的上下游序列结合。
图5D-E:检测肝细胞癌组织及其癌旁组织中EIF4A3水平,计算肝癌样本中EIF4A3与circCCAR1水平的关系。结果显示在HCC样本中EIF4A3水平升高,且circCCAR1与HCC内部样本中EIF4A3表达呈正相关。
图5F:肝癌患者中EIF4A3表达与总生存率的关系,结果显示高水平EIF4A3的HCC患者总生存时间较短。
图5G-H:EIF4A3缺失或过表达的HCCLM3和SK-Hep-1细胞中circCCAR1的表达结果显示EIF4A3过表达使HCC细胞中的circCCAR1水平升高,EIF4A3缺失使HCC细胞中的circCCAR1水平降低。
图5I:RIP实验表明circCCAR1可以被抗EIF4A3抗体拉低。
图5J:RNA-pull down实验表明EIF4A3蛋白在circCCAR1探针复合物中富集。
图5K-M:采用核质分离实验和FISH-IF实验评估EIF4A3耗损后肝癌细胞中circCCAR1的细胞质输出,发现EIF4A3敲除后HCC细胞的细胞质circCCAR1水平明显降低。
6.WTAP介导的m6A修饰通过IGF2BP3增强circCCAR1的稳定性
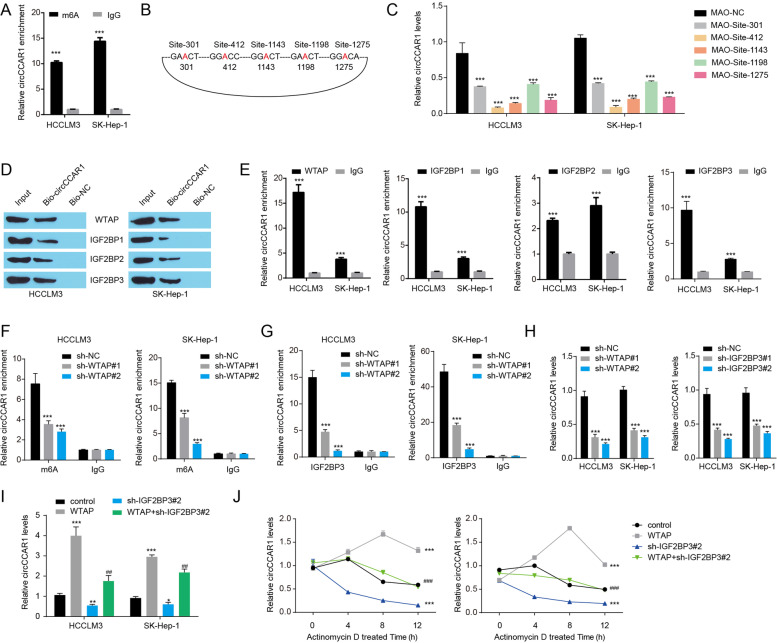
图6A:circCCAR1中m6A富集。
图6B:图中显示了circCCAR1中综合得分高的m6A基序的位置。
图6C:用MAO-circCCAR1或MAO-NC处理后HCC细胞中CircCCAR1的水平。
图6D-E:RIP和RNA pull down验证circCCAR1与WTAP、IGF2BP1、IGF2BP2和IGF2BP3之间潜在的相互作用。结果表明这四种蛋白都被发现在circCCAR1复合体中富集
图6F-G:肝癌细胞WTAP敲除后circCCAR1中m6A和IGF2BP3的富集,结果表明WTAP敲低显著降低了circCCAR1的m6A修饰和IGF2BP3与circCCAR1的结合。
图6H:WTAP敲低或IGF2BP3敲低后可以降低HCC细胞中的CircCCAR1水平。
图6I:WTAP过表达或IGF2BP3敲低后HCC细胞中的CircCCAR1水平,结果表明WTAP过表达可增强circCCAR1水平,而IGF2BP3敲低可逆转WTAP过表达诱导的circCCAR1水平升高。
图6J:Dactinomycin 处理下WTAP过表达或IGF2BP3敲低后肝癌细胞中circCCAR1的稳定性,结果表明WTAP过表达增加了circCCAR1的稳定性,IGF2BP3敲低则降低了circCCAR1的稳定性。
7.hnRNPA2B1介导的circCCAR1包装到外泌体
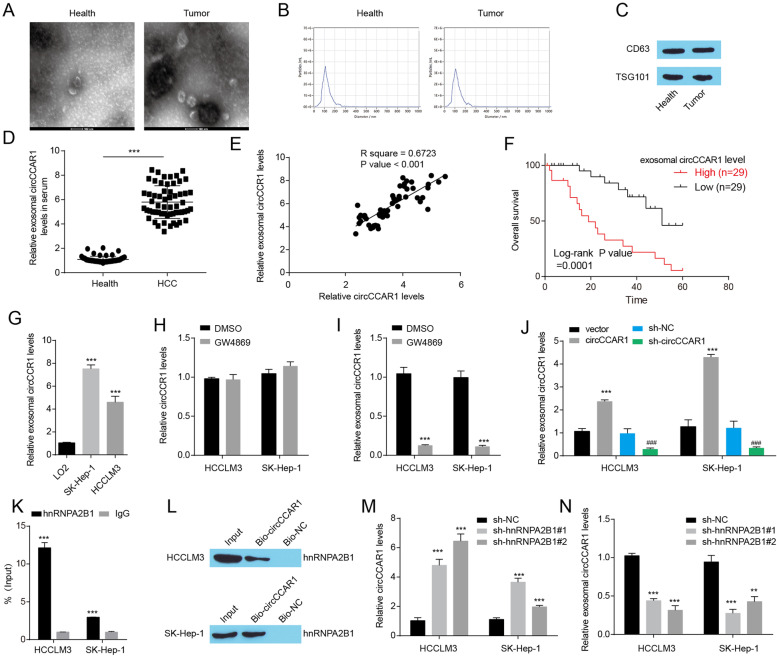
图7A-C:透射电镜检测、NanoSight颗粒跟踪分析、Western Blot检测外泌体标志蛋白CD63和TSG101。
图7D:肝癌患者和健康供者血清外泌体中circCCAR1的水平,在HCC患者的血清中检测到外泌体中较高水平的circCCAR1。
图7E:采用Spearman相关分析评估显示肿瘤组织中circCCAR1水平与HCC患者血清中外泌体circCCAR1水平呈正相关。
图7F:肝癌患者外泌体circCCAR1水平与总生存率的关系,表明血清外泌体circCCAR1可作为预后指标。
图7G:检测LO2细胞和HCC细胞培养液外泌体中circCCAR1的表达水平,结果显示与LO2细胞相比,在HCC细胞培养液中观察到外泌体circCCAR1水平升高。
图7H-I:肝癌细胞或肝癌细胞用GW4869处理的上清分离的外泌体中circCCAR1水平,结果显示GW4869阻断外泌体的形成可显著抑制外泌体circCCAR1的水平,而对HCC细胞中circCCAR1的水平无影响。
图7J:肝癌细胞circCCAR1过表达或缺失后外泌体中circCCAR1的表达水平,结果显示HCC细胞中circCCAR1的过表达增强了外泌体circCCAR1的水平,而circCCAR1的缺失降低了外泌体circCCAR1的水平。
图7K-L:通过RIP和RNA pull-down实验发现circCCAR1可以在HCC细胞中与hnRNPA2B1结合。
图7M-N:circCCAR1在hnrnpa2b1缺失的HCC细胞中表达增强,而在hnrnpa2b1缺失的HCC细胞分泌的外泌体中表达降低。
8.外泌体circCCAR1加速抗肿瘤CD8 + T细胞的衰竭
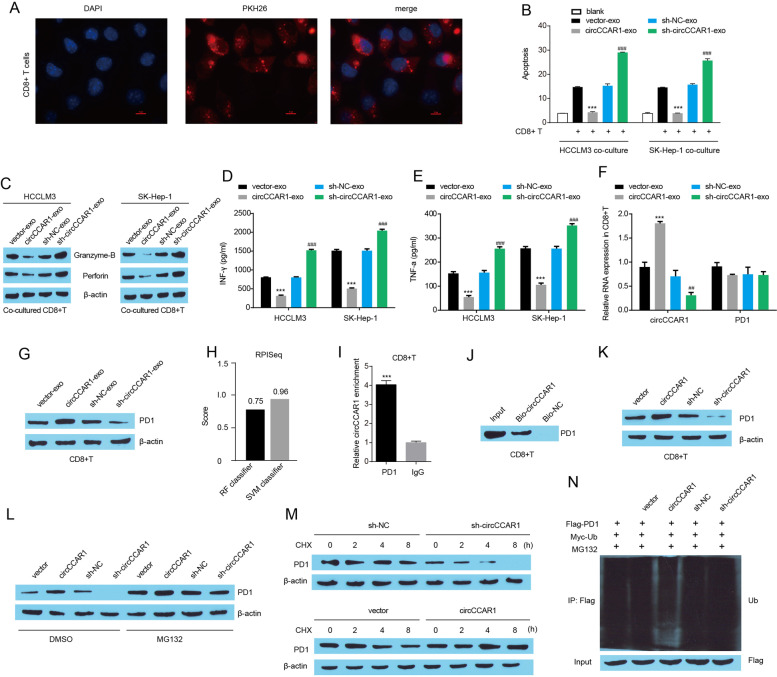
图8A:pkh67标记的HCCLM3外泌体(红色)被外泌体被活化的CD8 + T细胞有效吸收。
图8B:采用T细胞介导的杀伤实验来评估活化CD8 + T细胞的细胞毒性,CD8 + T细胞与来自过表达circCCAR1的HCC细胞的外泌体共培养,对HCC细胞的细胞毒性较弱。
图8C-E:外泌体circCCAR1共培养可降低活化CD8 + T细胞穿孔素和颗粒酶B蛋白水平,抑制活化CD8 + T细胞培养上清中IFN-γ和TNF-α的分泌。
图F-G:过表达circCCAR1的HCCLM3细胞外泌体增加了CD8 + T细胞中circCCAR1水平和PD1蛋白表达。
图8H:利用RPISeq工具分析circCCAR1与PD1蛋白之间的潜在相互作用,结果表明circCCAR1和PD1蛋白之间具有很高的结合潜力。
图8I-J:RIP和RNA pull-down实验,结果证实了circCCAR1和PD1在CD8 + T细胞中的相互作用。
图8K:在活化的CD8 + T细胞中,circCCAR1的缺失降低了PD1蛋白水平,而circCCAR1的过表达增加了PD1蛋白水平。
图8L:蛋白酶体抑制剂MG132挽救了CD8 + T细胞中circCCAR1缺失或过表达引起的PD1蛋白表达变化。
图8M:CD8 + T细胞经CHX处理后circCCAR1缺失或过表达后PD1蛋白的稳定性分析,结果表明circCCAR1缺失显著缩短了PD1蛋白的半衰期,circCCAR1过表达延长了CD8 + T细胞中PD1蛋白的半衰期。
图8N:通过泛素化实验发现circCCAR1过表达极大地抑制了PD1蛋白的泛素化,而circCCAR1缺失则增加了PD1蛋白的泛素化。
9.CircCCAR1促进HCC对抗PD1治疗的耐药性
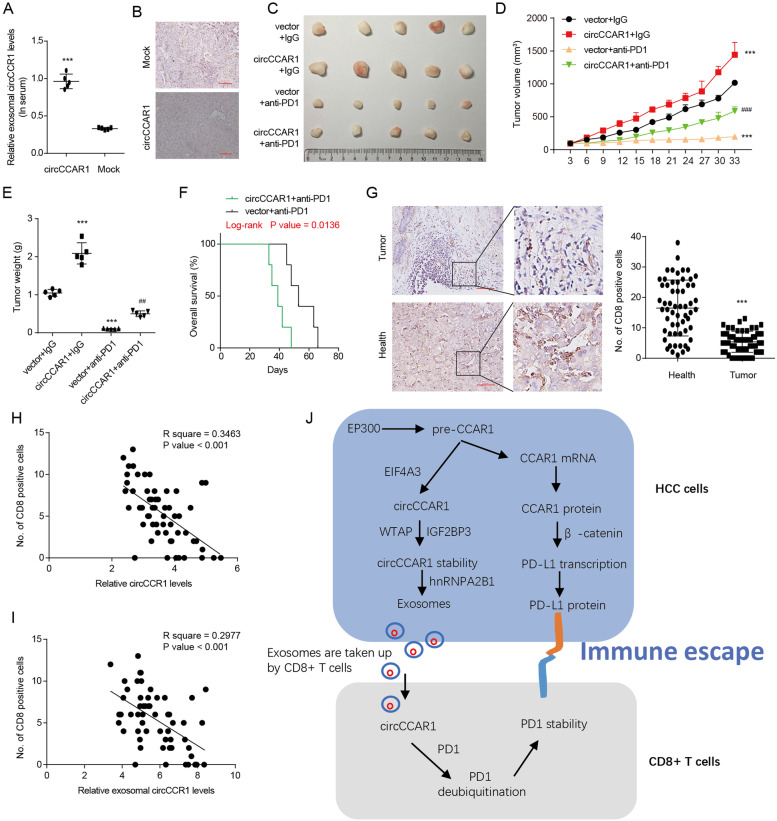
图9A:构建了HuNSG小鼠异种移植模型,与模拟处理小鼠相比,移植了过表达circCCAR1的HCCLM3细胞的异种移植物的HuNSG小鼠外周血外泌体circCCAR1增加。
图9B:CD8免疫组化染色结果表明,在模拟细胞源性组织中,CD8 + T细胞比circCCAR1过表达细胞源性组织中更多。
图9C-F:Opdivo注射到接受过表达circCCAR1的HCCLM3细胞或模拟细胞的HuNSG小鼠体内。通过观察肿瘤体积、重量以及异种移植物小鼠的存活曲线,发现circCCAR1高表达的异种移植小鼠对抗pd1治疗具有耐药性,存活时间较短。
图9G:CD8免疫组化染色结果显示,HCC组织中CD8 + T细胞的浸润较邻近正常组织减少。
图9H-I:计算circCCAR1与组织中或血清外泌体中CD8阳性细胞数的关系,结果表明HCC组织中circCCAR1和外泌体circCCAR1水平均与CD8 + t细胞频率呈负相关。
图9J:circCCAR1介导的肝癌免疫抑制作用模型。
结论:
研究结果表明,circCCAR1加速了HCC患者的肿瘤进展和免疫逃避。在HCC患者的血清中检测到外泌体中较高水平的circCCAR1。血清外泌体circCCAR1可作为HCC患者的诊断和预后指标。高circCCAR1水平的HCC细胞对抗PD1治疗具有耐药性。这些结果表明外泌体circCCAR1表达可作为HCC抗PD1治疗的一种新的有效标志物。
综上所述,circCCAR1和CCAR1在HCC中升高,可能是HCC患者的预后因素。circCCAR1/miR-127-5p/WTAP正反回馈调控机制促进HCC的生长和转移。HCC细胞分泌的外泌体circCCAR1可被活化的CD8 + T细胞吸收,并通过增强PD1蛋白的稳定性促进CD8 + T细胞功能障碍。此外,HCC细胞中CCAR1蛋白表达的增加通过结合β-catenin促进PD-L1的转录,这可能增强抗PD1治疗的耐药性。因此,靶向外泌体circCCAR1或CCAR1可能为HCC患者提供一种最大化免疫治疗效果的新策略。






