研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Exp Mol Med】12+,循环富集miRNA-21-5P的细胞外囊泡促进创伤性脑损伤患者骨重塑
542 人阅读发布时间:2023-08-02 14:46
骨折合并创伤性脑损伤(TBI)是临床上最常见、最严重的复合创伤之一,其特点是损伤脏器细胞通讯功能障碍。作者之前研究发现,创伤性脑损伤能够以旁分泌的方式促进骨折愈合。外泌体(Exos)作为细胞外小泡,是非细胞治疗中重要的旁分泌载体。然而,来自TBI患者的循环Exos (TBI-Exos)是否调节骨折的促愈合作用仍不清楚。作者在【Exp Mol Med】期刊上发表的一篇题为“Circulating MiRNA-21-enriched extracellular vesicles promote bone remodeling in traumatic brain injury patients”文章,研究旨在探讨TBI-Exos对骨折愈合的生物学作用,并揭示其潜在的分子机制。

Mir-21-5p是一种众所周知的与骨重塑相关的miRNA。最近的一项研究报道来自生长激素分泌垂体腺瘤的外泌体mir-21-5p在体外诱导骨形成并在体内增加骨小梁数量。
此外,在本研究中,作者试图阐明TBI在骨折愈合中的有益作用,特别关注TBI-Exos。作者证明mir-21-5p在TBI-Exos中显著富集,并可以被递送到hMSCs,其中与SMAD7结合以增强成骨细胞分化和骨折愈合。
研究结果
1.TBI-Exos加速骨折愈合
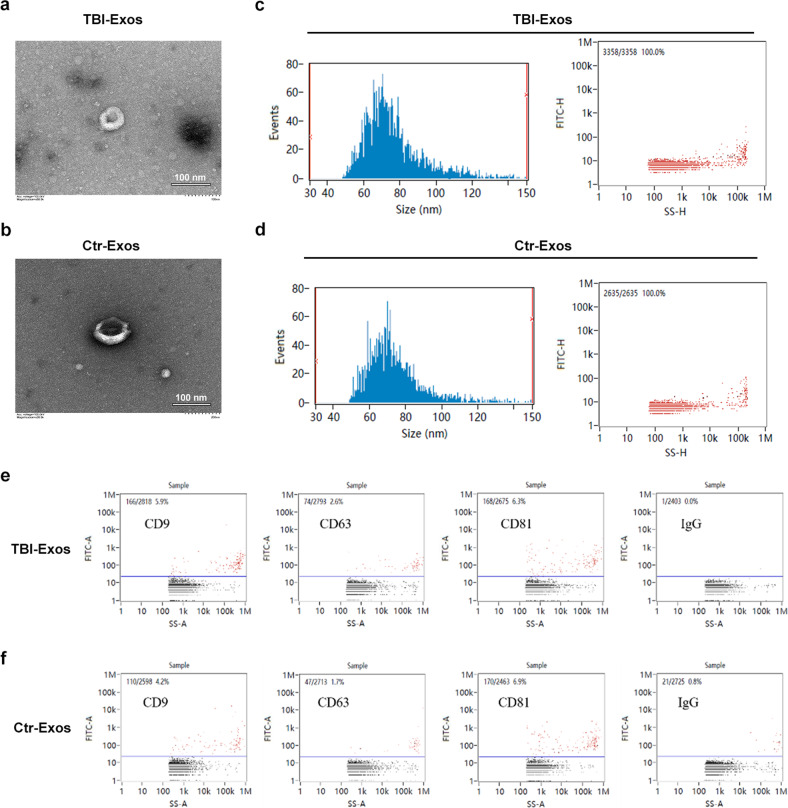
图1a-b:透射电镜检测Ctr-Exos和TBI-Exos,呈现茶托状结构。
图1c-d:NTA检测Ctr-Exos和TBI-Exos粒径大小在30-150nm。
图1e-f:NanoFCM检测Ctr-Exos和TBI-Exos的表面标记物CD9、CD63和CD81。
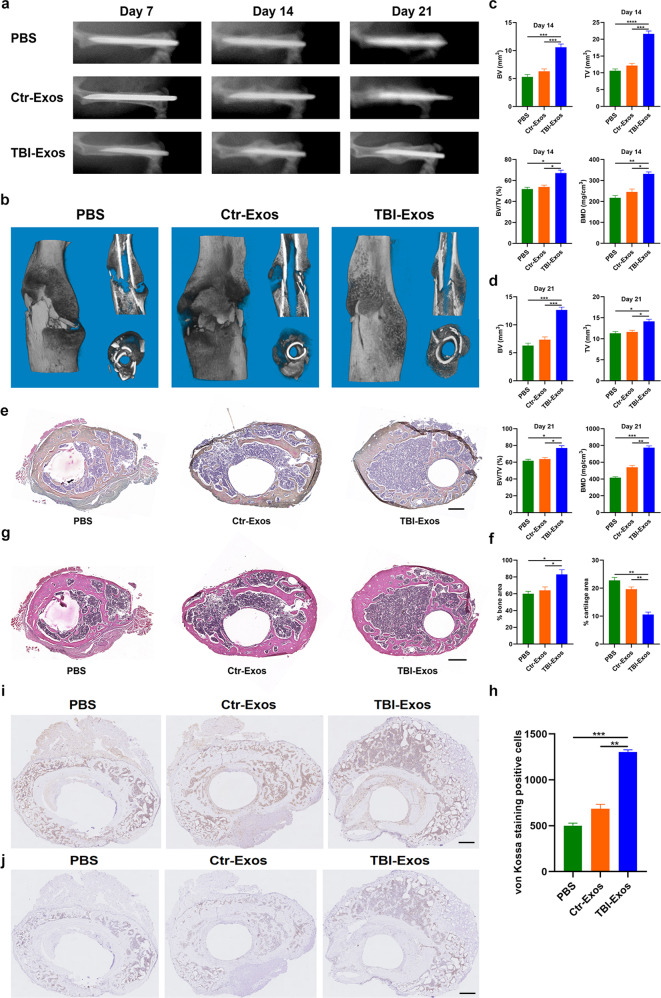
图2a-b:采用x射线和micro-CT分析评估不同处理小鼠模型的愈合过程,TBI-Exos组比PBS组和Ctr-Exos组显示明显更大的骨痂形成和更窄的骨折间隙。
图2c-d:CT分析结果显示,TBI-Exos组小鼠的BV、TV、BV/TV和BMD均高于PBS组和Ctr-Exos组
图2e-h:小鼠骨折后第21天ABHEOG和Von Kossa染色结果显示,与PBS组和Ctr-Exos组相比,TBI - Exos处理的小鼠骨形成性能更好,软骨形成较少。
图2i-j:CD31和Ki67免疫组化显示对TBI-Exos血管生成和增殖有积极作用。
2. TBI-Exos促进体外增殖和成骨分化
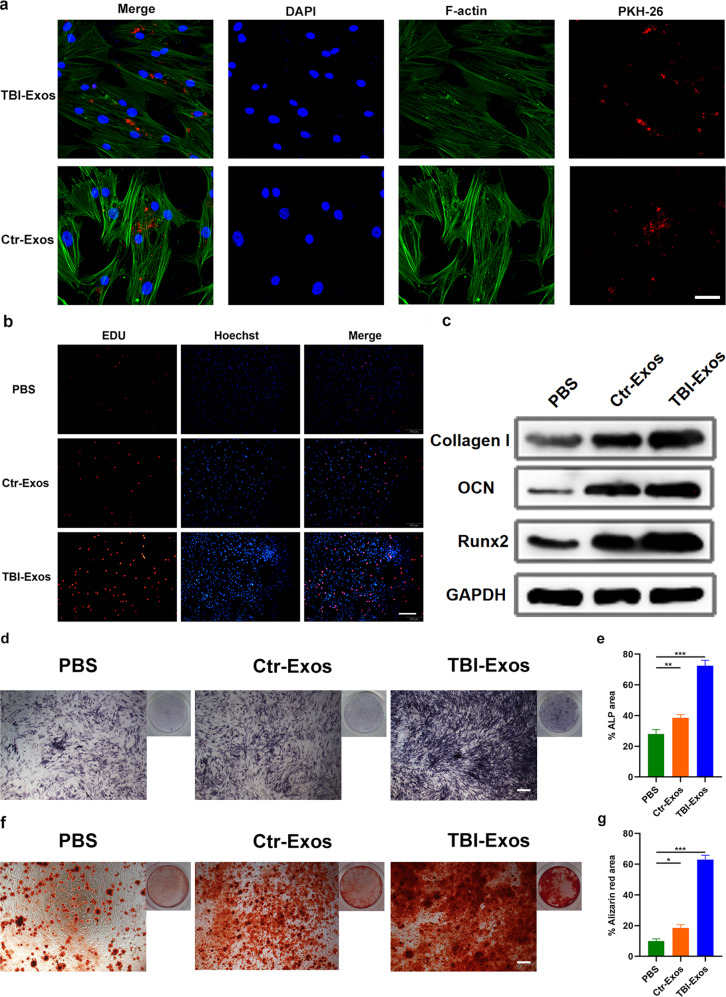
图3a:用PKH26染料(红色)标记Exos,然后加入hMSC培养基。结果表明hMSCs能够在12小时内摄取Ctr-Exos和TBI-Exos。
图3b:用EdU实验研究Ctr-Exos和TBI-Exos对hMSCs增殖的影响。结果显示,相对于PBS-和Ctr-Exos处理组小鼠,TBI-Exos显著促进hMSC增殖。
图3c:Western blotting分析评估不同组之间的成骨相关蛋白Collagen I、Runx 2和OCN。结果表明,与其他组相比,TBI-exo处理组中这些蛋白的含量较高。
图3d-e:通过ALP染色和茜素红染色测定细胞外矿物质沉积水平,结果表明,与其他处理相比,TBI-Exos能够诱导增强矿物质沉积。
3.外泌体miR-21-5p对TBI对骨折愈合的重要影响
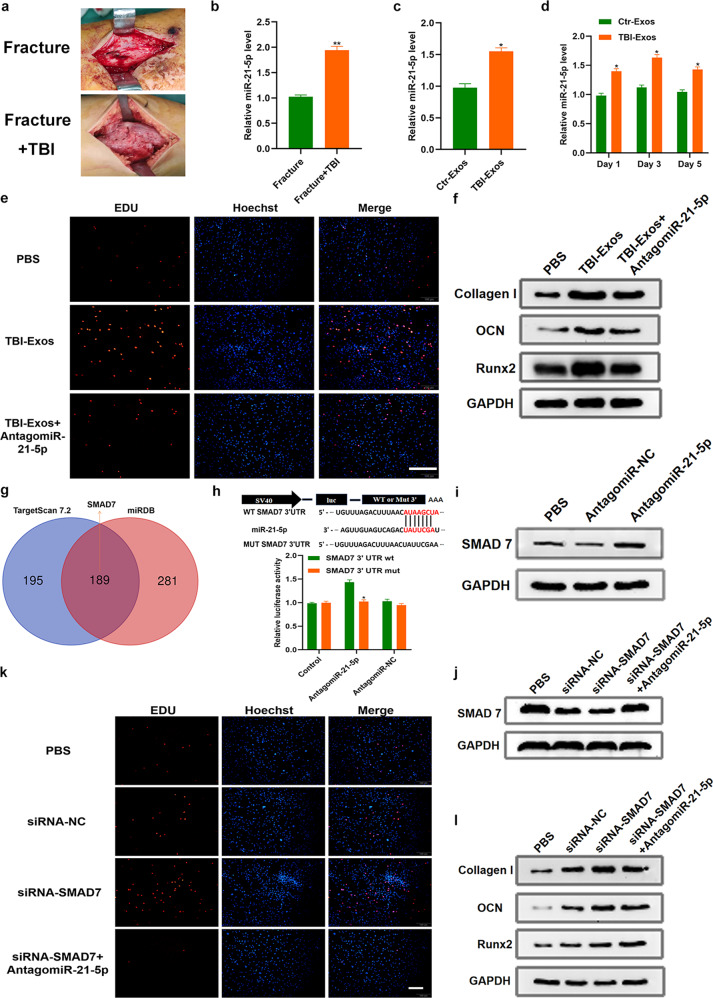
图4a:骨折+TBI组骨折部位的胼胝比骨折组更明显。
图4b-c:qRT-PCR检测评估了患者血清和Exos中mir-21-5p的水平。结果显示,TBI后血清和Exos中的mir -21- 5p均显著升高。
图4d: Ctr-Exos和TBI-Exos分别处理hMSCs 细胞1天、3天和5天。qRT-PCR检测结果显示,在三个时间点TBI- Exos处理的细胞中mir-21-5p水平明显高于Ctr-exos处理的细胞。
图4e:EdU法测定不同处理对hMSCs细胞增殖影响,结果显示TBI-Exos显著促进hMSC增殖,而mir-21-5p抑制显著削弱了TBI-Exos的这种促增殖作用。
图4f:采用Western blotting检测各组成骨相关蛋白,结果显示添加antagomiR -21- 5p可显著降低TBI-Exos升高的成骨相关蛋白水平。
图4g:使用在线预测工具确定mir-21-5p的潜在靶标,SMAD7确定为预测的靶基因。
图4h:荧光素酶报告基因检测检测mir-21-5p与SMAD7的相互作用,结果显示mir-21-5p能够特异性结合SMAD7 mRNA区域。
图4i-j:western blotting分析检测各组SMAD7水平,结果显示mir-21- 5p抑制明显导致SMAD7水平升高。
图4k:EdU实验评估SMAD7对hMSCs增殖的影响,结果显示siRNA SMAD7可以显著促进hMSCs增殖,而mir-21-5p抑制可能部分损害siRNA SMAD7的这种促增殖作用。
图4L:western blotting结果显示,添加antagomir-21-5p可显著降低siRNA smad7升高的成骨相关蛋白水平。
4.外泌体miR-21-5p在体内加速骨折愈合
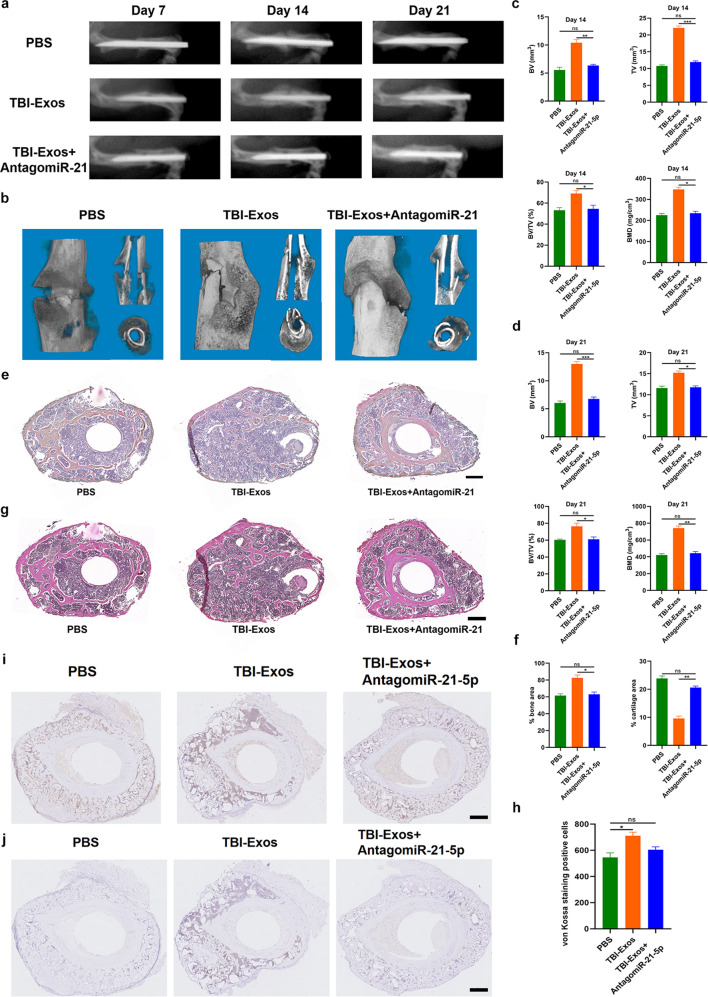
图5a-b:采用x射线(a)和micro-CT (b)分析不同处理小鼠模型的愈合过程,TBI-Exo组的骨痂形成明显大于PBS组,骨折间隙更窄,而加入antagomir-21-5p后,TBI-Exos的促愈合作用部分逆转。
图5c-d:CT分析结果显示,与PBS组相比,TBI-Exos组小鼠的BV、TV、BV/TV和BMD均较高,且antagomir-21-5p的加入部分逆转了TBI-Exos的作用。
图5e- h:骨标本进行ABHEOG和Von Kossa染色,结果显示与PBS处理的小鼠相比,TBI-Exos处理的小鼠表现出更好的骨形成性能和更少的软骨形成,antagomir-21-5p的添加部分削弱了TBI-Exos的促愈合作用。
图5i-j:CD31、Ki67免疫组化结果显示TBI-Exos处理组对血管生成和增殖有积极作用,而antagomir-21-5p可以部分逆转这种作用。
结论
在这项研究中,作者发现mir-21-5p在TBI-Exos中比Ctr-Exos显著富集,并且外泌体mir-21-5p在体外和体内进一步被证明可以加速骨重塑。此外,SMAD7信号的抑制被认为是这种促愈合作用的潜在机制。作者的研究结果表明,使用纳米材料结合miR-21-5p模拟物可能是一种促进骨折愈合的可行策略。
本研究结果对骨形成障碍相关疾病的治疗具有潜在的应用价值。TBI-Exos介导的mir-21-5p传递对骨间充质干细胞具有促进作用,可能是诱导成骨分化的主要因素。考虑到骨形成障碍患者骨重塑的全身性功能障碍,针对TBI-Exos和mir-21-5p的治疗干预可能会改善这些患者的骨再生。在这项研究中,作者特别关注外泌体mir-21-5p从TBI-Exos传递到hMSCs。然而,Exos传递比miRNA更多的活性因子,潜在地调节靶细胞。此外,其他调控问题如血管生成和炎症,可能影响骨重塑和骨折愈合。有必要进一步阐明TBI-Exos介导骨折愈合的确切因素,揭示骨折部位微环境的变化及其在骨折愈合中的作用。

Mir-21-5p是一种众所周知的与骨重塑相关的miRNA。最近的一项研究报道来自生长激素分泌垂体腺瘤的外泌体mir-21-5p在体外诱导骨形成并在体内增加骨小梁数量。
此外,在本研究中,作者试图阐明TBI在骨折愈合中的有益作用,特别关注TBI-Exos。作者证明mir-21-5p在TBI-Exos中显著富集,并可以被递送到hMSCs,其中与SMAD7结合以增强成骨细胞分化和骨折愈合。
研究结果
1.TBI-Exos加速骨折愈合

图1a-b:透射电镜检测Ctr-Exos和TBI-Exos,呈现茶托状结构。
图1c-d:NTA检测Ctr-Exos和TBI-Exos粒径大小在30-150nm。
图1e-f:NanoFCM检测Ctr-Exos和TBI-Exos的表面标记物CD9、CD63和CD81。

图2a-b:采用x射线和micro-CT分析评估不同处理小鼠模型的愈合过程,TBI-Exos组比PBS组和Ctr-Exos组显示明显更大的骨痂形成和更窄的骨折间隙。
图2c-d:CT分析结果显示,TBI-Exos组小鼠的BV、TV、BV/TV和BMD均高于PBS组和Ctr-Exos组
图2e-h:小鼠骨折后第21天ABHEOG和Von Kossa染色结果显示,与PBS组和Ctr-Exos组相比,TBI - Exos处理的小鼠骨形成性能更好,软骨形成较少。
图2i-j:CD31和Ki67免疫组化显示对TBI-Exos血管生成和增殖有积极作用。
2. TBI-Exos促进体外增殖和成骨分化

图3a:用PKH26染料(红色)标记Exos,然后加入hMSC培养基。结果表明hMSCs能够在12小时内摄取Ctr-Exos和TBI-Exos。
图3b:用EdU实验研究Ctr-Exos和TBI-Exos对hMSCs增殖的影响。结果显示,相对于PBS-和Ctr-Exos处理组小鼠,TBI-Exos显著促进hMSC增殖。
图3c:Western blotting分析评估不同组之间的成骨相关蛋白Collagen I、Runx 2和OCN。结果表明,与其他组相比,TBI-exo处理组中这些蛋白的含量较高。
图3d-e:通过ALP染色和茜素红染色测定细胞外矿物质沉积水平,结果表明,与其他处理相比,TBI-Exos能够诱导增强矿物质沉积。
3.外泌体miR-21-5p对TBI对骨折愈合的重要影响

图4a:骨折+TBI组骨折部位的胼胝比骨折组更明显。
图4b-c:qRT-PCR检测评估了患者血清和Exos中mir-21-5p的水平。结果显示,TBI后血清和Exos中的mir -21- 5p均显著升高。
图4d: Ctr-Exos和TBI-Exos分别处理hMSCs 细胞1天、3天和5天。qRT-PCR检测结果显示,在三个时间点TBI- Exos处理的细胞中mir-21-5p水平明显高于Ctr-exos处理的细胞。
图4e:EdU法测定不同处理对hMSCs细胞增殖影响,结果显示TBI-Exos显著促进hMSC增殖,而mir-21-5p抑制显著削弱了TBI-Exos的这种促增殖作用。
图4f:采用Western blotting检测各组成骨相关蛋白,结果显示添加antagomiR -21- 5p可显著降低TBI-Exos升高的成骨相关蛋白水平。
图4g:使用在线预测工具确定mir-21-5p的潜在靶标,SMAD7确定为预测的靶基因。
图4h:荧光素酶报告基因检测检测mir-21-5p与SMAD7的相互作用,结果显示mir-21-5p能够特异性结合SMAD7 mRNA区域。
图4i-j:western blotting分析检测各组SMAD7水平,结果显示mir-21- 5p抑制明显导致SMAD7水平升高。
图4k:EdU实验评估SMAD7对hMSCs增殖的影响,结果显示siRNA SMAD7可以显著促进hMSCs增殖,而mir-21-5p抑制可能部分损害siRNA SMAD7的这种促增殖作用。
图4L:western blotting结果显示,添加antagomir-21-5p可显著降低siRNA smad7升高的成骨相关蛋白水平。
4.外泌体miR-21-5p在体内加速骨折愈合

图5a-b:采用x射线(a)和micro-CT (b)分析不同处理小鼠模型的愈合过程,TBI-Exo组的骨痂形成明显大于PBS组,骨折间隙更窄,而加入antagomir-21-5p后,TBI-Exos的促愈合作用部分逆转。
图5c-d:CT分析结果显示,与PBS组相比,TBI-Exos组小鼠的BV、TV、BV/TV和BMD均较高,且antagomir-21-5p的加入部分逆转了TBI-Exos的作用。
图5e- h:骨标本进行ABHEOG和Von Kossa染色,结果显示与PBS处理的小鼠相比,TBI-Exos处理的小鼠表现出更好的骨形成性能和更少的软骨形成,antagomir-21-5p的添加部分削弱了TBI-Exos的促愈合作用。
图5i-j:CD31、Ki67免疫组化结果显示TBI-Exos处理组对血管生成和增殖有积极作用,而antagomir-21-5p可以部分逆转这种作用。
结论
在这项研究中,作者发现mir-21-5p在TBI-Exos中比Ctr-Exos显著富集,并且外泌体mir-21-5p在体外和体内进一步被证明可以加速骨重塑。此外,SMAD7信号的抑制被认为是这种促愈合作用的潜在机制。作者的研究结果表明,使用纳米材料结合miR-21-5p模拟物可能是一种促进骨折愈合的可行策略。
本研究结果对骨形成障碍相关疾病的治疗具有潜在的应用价值。TBI-Exos介导的mir-21-5p传递对骨间充质干细胞具有促进作用,可能是诱导成骨分化的主要因素。考虑到骨形成障碍患者骨重塑的全身性功能障碍,针对TBI-Exos和mir-21-5p的治疗干预可能会改善这些患者的骨再生。在这项研究中,作者特别关注外泌体mir-21-5p从TBI-Exos传递到hMSCs。然而,Exos传递比miRNA更多的活性因子,潜在地调节靶细胞。此外,其他调控问题如血管生成和炎症,可能影响骨重塑和骨折愈合。有必要进一步阐明TBI-Exos介导骨折愈合的确切因素,揭示骨折部位微环境的变化及其在骨折愈合中的作用。






