研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Nanobiotechnology】10+高分文章,抗chac1外泌体在脑缺血再灌注损伤小鼠中抑制神经元铁死亡
1021 人阅读发布时间:2023-07-28 16:19
中风是世界范围内导致长期残疾的主要原因和第二大死亡原因,是影响世界人口的最普遍和最具破坏性的疾病之一,其中大约70%的中风病例为缺血性中风。铁死亡是一种新发现的细胞死亡程序类型,其特征是脂质氢过氧化物的铁依赖性积累达到致死水平。已在多种神经系统疾病(包括退行性疾病、外伤性脑损伤、出血性中风和缺血性中风)中发现并研究了铁死亡。
最近,鼻内(IN)给药被认为是一种可靠的给药方式,给药绕过血脑屏障通过嗅觉神经和三叉神经将治疗药物输送到大脑。IN给药比静脉给药更有效,比局部立体定向注射侵入性更小。许多研究已经证明了IN给药在将治疗剂输送到脑部方面的递送效率并证实了鼻内给药在脑相关疾病中的积极作用。因此,探索一种可经鼻给药到脑内的抗铁死亡药物是很有必要的,且具有重要的临床应用价值。作者发表在【J Nanobiotechnology】上一篇题为“Anti-CHAC1 exosomes for nose-to-brain delivery of miR-760-3p in cerebral ischemia/reperfusion injury mice inhibiting neuron ferroptosis”的文章,研究设计并制备了脂肪源性间充质干细胞(ADSC-Exo)抗铁死亡外泌体,通过鼻内给药治疗缺血性脑损伤。结果表明,ADSC-Exo中的miR-760-3p通过靶向神经元中的CHAC1有助于其抑制铁死亡的功能。本研究成功设计并制备了抗chac1 ADSC-Exo,并提出了一种于外泌体的抗脑缺血/再灌注损伤铁凋亡治疗策略。

研究结果
1.CHAC1被确定为缺血性中风中与铁死亡相关的DEG,并预测ADSC-Exo是一种合适的抗铁死亡药物
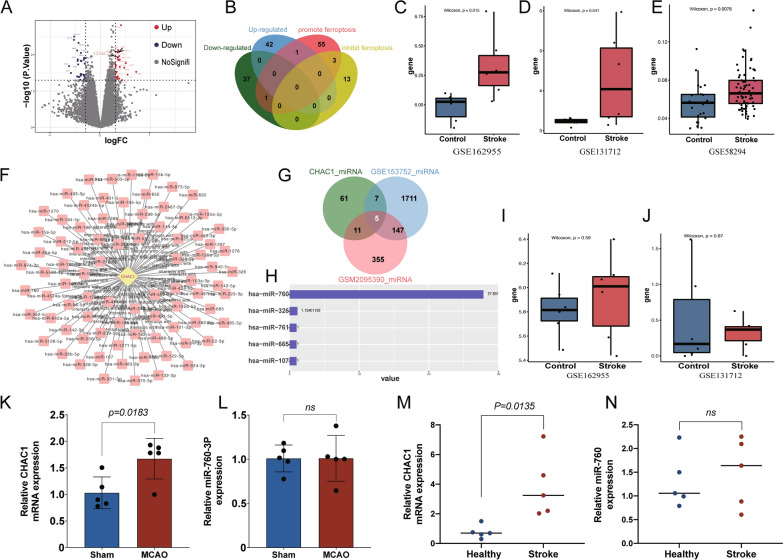
图1A:火山图显示,与健康对侧区域相比,在中风患者梗死核心鉴定出81个DEGs,其中43个上调,38个deg下调。
图1B:共获得43个上调的DEG和38个下调的DEG,与60个促进铁死亡相关基因和16个抑制铁死亡相关基因交叉,最终鉴定出促进铁死亡相关基因CHAC1
图1C:来自人类数据集的梗死核心和健康对侧区域的CHAC1表达,CHAC1的高表达在脑中风中患者梗死核心数据集中得到进一步验证。
图1D:来自小鼠数据集的MCAO组和对照组脑组织CHAC1表达。
图1E:来自人类数据集的缺血性脑中风组和健康组血清CHAC1表达。
图1F:利用starBase v2.0预测CHAC1的靶miRNAs。
图1G:通过维恩图鉴定ADSC-Exo和starbase预测mirna中的交叉mirna,选择ADSC-Exo中包含的候选靶miRNAs作为外泌体和starbase预测miRNAs中的5个交叉miRNAs。
图1H:对人ADSC-Exo的候选靶miRNAs进行排序,其中miR-760-3p在ADSC-Exo中含量最高。
图1I-J:分别在缺血性脑中风患者梗死核心组织和血液样本的数据集、小鼠MCAO和对照脑组织的数据集中进一步验证了miR-760-3p的表达。结果显示,脑中风组miR-760-3p的表达水平与对照组相似。
图1K-N:RT-qPCR验证MCAO组和sham组大鼠脑组织,缺血性卒中和健康人血清中CHAC1和miR-760-3p表达,结果与生物信息学分析一致。
2.ADSC-Exo的分离鉴定及经鼻内给药后ADSC-Exo在MCAO小鼠脑内递送效率的研究
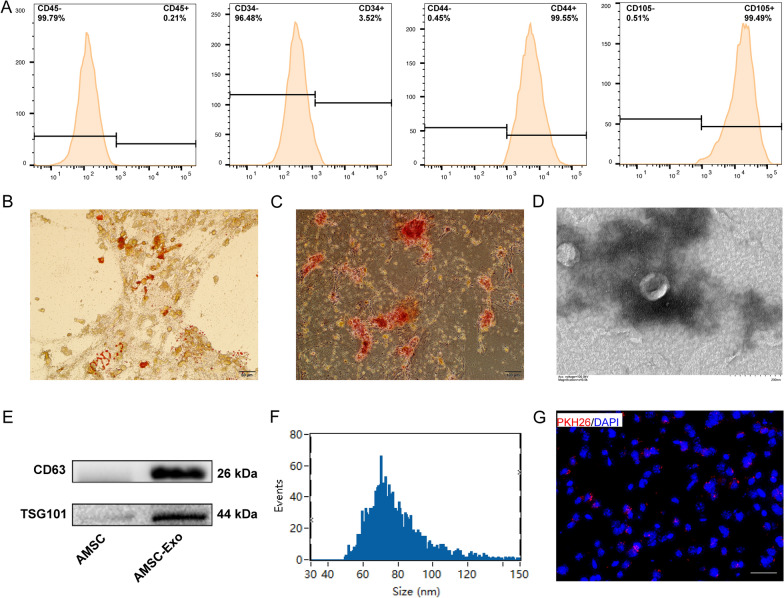
图2A:流式细胞术分析ADSCs表面标记物CD44和CD105以及阴性标记物CD45和CD34,符合ADSCs的鉴定标准。
图2B-C:油红O染色(细胞质中有大量红色油滴)和茜素红染色(细胞内形成红色钙结节)分别证实了ADSCs的成脂性和成骨性分化。
图2 D:透射电镜检测ADSC-Exo为典型杯状形态。
图2E: Western blot检测ADSC-Exo标志物CD63和TSG101的表达。
图2F:粒径分析显示,ADSC-Exo的平均粒径为78.88±16.12 nm。
图2G:在MCAO小鼠大脑同侧半球的核周围(蓝色)检测到PKH-26标记的ADSC-Exo(红色),表明通过IN给药ADSC-Exo的递送效率很高。
3.缺血性脑中风小鼠及患者发生铁死亡
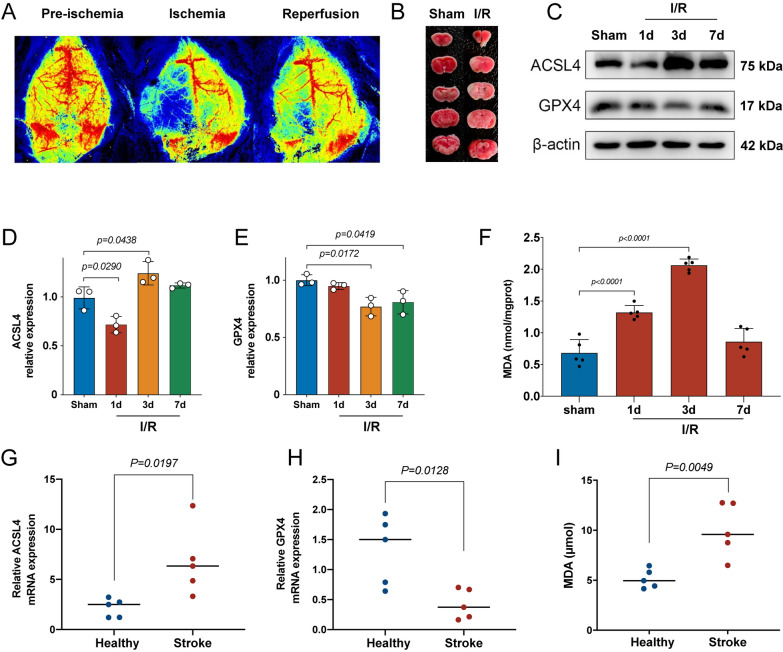
图3A:缺血性脑中风小鼠激光散斑成像显示局部脑血流在缺血时被阻断,再灌注后稍有恢复。
图3B:TTC染色结果显示,MCAO后24小时缺血小鼠脑冠状切片结果表明脑梗死体积明显。
图3C:Western blot检测小鼠MCAO后不同时间点铁死亡标志物ACSL4和GPX4。
图3D-E:RT-qPCR检测不同时间点ACSL4和GPX4蛋白的表达,MCAO后,ACSL4上调,GPX4下调。MCAO后3d小鼠ACSL4蛋白表达量最高,GPX4蛋白表达量在MCAO后3d小鼠中最低。
图3F:小鼠MCAO后不同时间点丙二醛(MDA)含量测定,MCAO后3d小鼠体内MDA浓度最高。
图3G- H:采用RT-qPCR检测健康志愿者和缺血性脑中风患者血清中ACSL4和GPX4 mRNA表达水平。
图3I:健康志愿者和缺血性脑中风患者血清中MDA的检测量。
4.经鼻给药ADSC-Exo可改善小鼠缺血性脑中风后的神经行为功能并抑制铁死亡
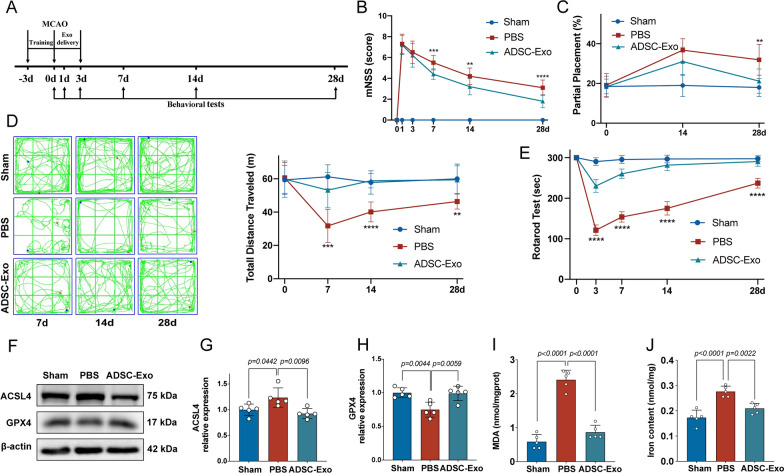
图4A:实验时间表。MCAO后1-3天每天ADSC-Exo鼻内给药。
图4B:mNSS评估MCAO前及术后1d、3d、7d、14d、28d神经功能缺损,显示在MCAO后7d、14d和28d, ADSC-Exo组小鼠的神经功能缺损明显小于PBS组
图4C:旋转杆实验显示,与PBS组相比,ADSC-Exo组小鼠在MCAO后3d、7d、14d和28d的旋转杆停留时间更长。
图4D:足断层试验显示,ADSC-Exo组小鼠患肢抓握功能在28d时优于PBS组。
图4E:在旷场实验中,ADSC-Exo组小鼠在MCAO后7d、14d和28d的总运动距离比PBS组更长。
图4F: Western blot检测凋亡相关蛋白标志物ACSL4、GPX4的表达。
图4G-I:ACSL4蛋白表达量定量分析、GPX4蛋白表达量测定、丙二醛(MDA)定量。在MCAO后3d, ADSC-Exo组小鼠体内ACSL4蛋白表达量显著低于PBS组,而GPX4蛋白表达量显著高于PBS组,在脂质过氧化MDA测定中,ADSC-Exo组小鼠体内MDA浓度低于PBS组。
图4J:亚铁铁水平(Fe2+)的定量,MCAO后3d ADSC-Exo组小鼠的Fe2+含量低于PBS组。
5.小鼠神经元中在体内和体外摄取MCAO和ADSC-Exo后,CHAC1在3d上调
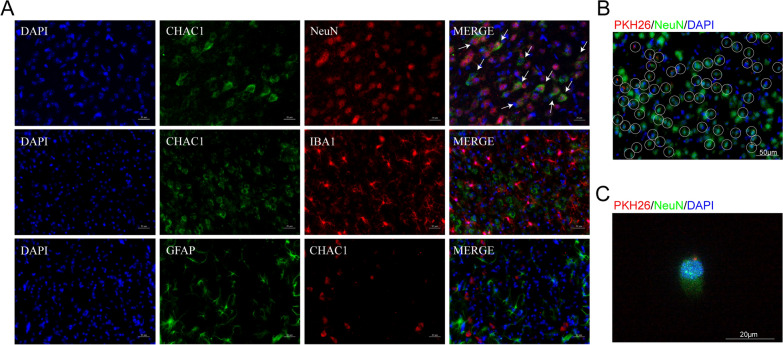
图5A:为研究CHAC1主要作用的靶细胞,进行了CHAC1/NeuN、CHAC1/IBA1和CHAC1/GFAP双染色,免疫荧光显示NeuN与CHAC1共定位明显,而CHAC1未与IBA1或GFAP共定位。
图5B:免疫荧光成像显示ADSC-Exo在体内被神经元摄取。PKH26标记的ADSC-Exo(红色)在MCAO后24小时经鼻给药。给药后6 h检测NeuN +神经元(绿色)对ADSC-Exo的内在化。
图5C:PKH-26标记的ADSC-Exo(红色)被NeuN + N2a细胞(绿色)摄取。
6.CHAC1在N2a细胞中被证实是miR-760-3p的下游靶基因
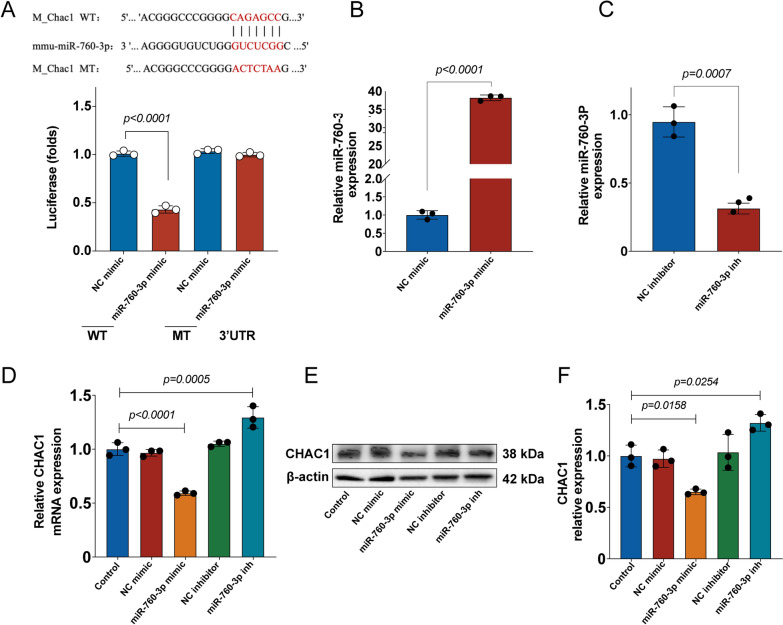
图6A:荧光素酶报告基因实验证实miR-760-3p可以结合CHAC1 mRNA的3 ' -UTR。
图6B-C:RT-qPCR结果显示,miR-760-3p mimic 提高了miR-760-3p水平,而miR-760-3p inhibotor抑制miR-760-3p水平。
图6D-F:RT-qPCR和western blot结果显示,miR-760-3p mimic降低了CHAC1的表达,而miR-760-3p inhibitor增加了CHAC1的表达。
7.miR-760-3p抑制剂逆转了ADSC-Exo对CHAC1蛋白下调和铁死亡的抑制作用
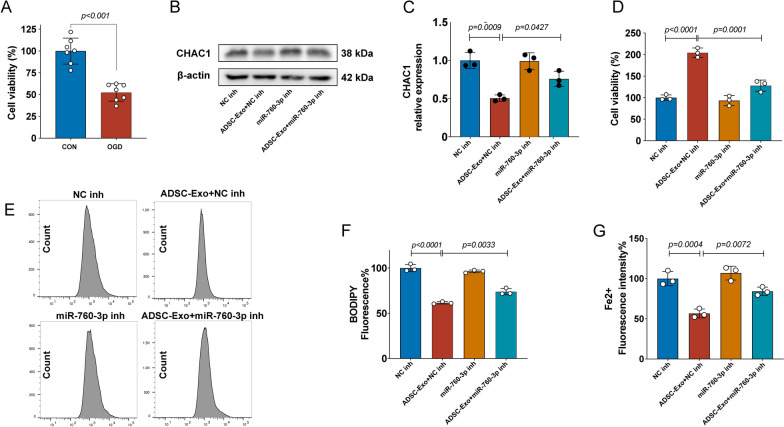
图7A:CCK-8法证实成功建立N2a细胞OGD模型。
图7B-C:Western blot检测各组OGD处理N2a细胞中CHAC1蛋白的表达,ADSC-Exo显著降低了CHAC1的表达,而miR-760-3p抑制剂逆转了ADSC-Exo降低CHAC1表达的作用。
图7D:采用CCK-8法测定各组OGD处理N2a细胞的存活率,ADSC-Exo提高了OGD处理的N2a细胞的存活率。
图7E-F:采用C11-BODIPY探针检测各组OGD处理N2a细胞的脂质过氧化情况,ADSC-Exo降低了脂质过氧化。
图7G:采用FerroOrange探针检测各组OGD处理N2a细胞的亚铁铁水平(Fe2+), ADSC-Exo降低了亚铁水平。
8.CHAC1过表达逆转了ADSC-Exo对铁死亡的抑制作用
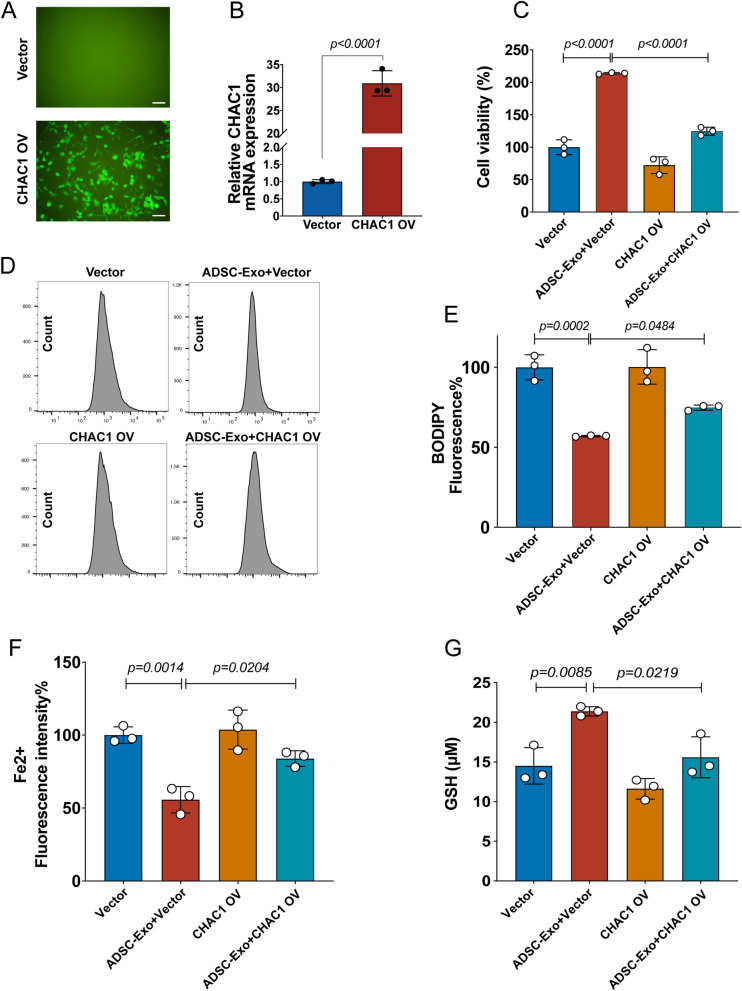
图8A:用荧光显微镜检测慢病毒的转染效率。
图8B:RT-qPCR证实了CHAC1在N2a细胞中的过表达。
图8C:采用CCK-8法测定各组OGD处理N2a细胞的存活率,ADSC-Exo提高了OGD处理的N2a细胞的存活率。
图8D-E:采用C11-BODIPY探针检测各组OGD处理N2a细胞的脂质过氧化情况,ADSC-Exo降低了脂质过氧化水平。
图8F:采用FerroOrange探针检测OGD处理不同组N2a细胞的亚铁铁水平(Fe2+), ADSC-Exo降低了亚铁水平。
图8G:采用谷胱甘肽测定试剂盒测定各组OGD处理N2a细胞的GSH水平。
结论
本研究成功地设计和制备了ADSC-Exo。作者论证了IN给药给药ADSC-Exo向脑内的递送效率,并利用小鼠MCAO模型研究了ADSC-Exo对缺血性脑中风的疗效,探讨了ADSC-Exo发挥作用的分子机制。研究结果表明,ADSC-Exo在体内和体外都能抑制铁死亡。此外,作者发现ADSC-Exo可以通过miR-760-3p下调神经元CHAC1表达来抑制铁死亡。本研究为缺血性脑中风提供了一种潜在的治疗策略。






