研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Int J Biol Sci】 9+,M1小胶质细胞来源的外泌体促进静息小胶质细胞的激活并放大促血管生成作用
2241 人阅读发布时间:2023-09-13 16:29
小胶质细胞的激活在新生血管性视网膜疾病的发展中起着关键作用。因此,揭示其干预疾病进展的病理生理和分子机制是必要的。湾湾今天给大家分享一篇发表在【Int J Biol Sci】杂志上题为“M1 Microglia-derived Exosomes Promote Activation of Resting Microglia and Amplifies Proangiogenic Effects through Irf1/miR-155-5p/Socs1 Axis in the Retina”的文章,该研究利用一系列实验和生物信息学分析来阐明M1小胶质外泌体相关的视网膜新生血管的细胞和分子机制。重新分析了氧诱导视网膜病变(OIR)模型的公开单细胞RNA测序数据集,以阐明各种小胶质细胞簇和血管内皮细胞之间的潜在联系。通过体外和体内实验,发现M1小胶质外泌体使静息小胶质细胞向M1促炎表型极化,增强了小胶质细胞的促血管生成潜能。通过外泌体miRNA-seq和基因干扰的证据表明,外泌体miR-155-5p作为介质在静息小胶质细胞中传播激活信号,miR-155-5p的功能与调节Socs1/NFkB信号通路相关。作者还通过转录组学分析和分子实验阐明了miR-155-5p上调的机制:在m1激活的小胶质细胞中富集的上游转录因子Irf1。因此,本研究阐明了血管生成过程中复杂视网膜微环境中不同类型小胶质细胞间细胞间通讯的关键作用,为临床视网膜新生血管提供新颖、靶向和潜在的治疗策略。

研究结果
1.生物信息学分析表明,在OIR模型中M1小胶质细胞与M0小胶质细胞之间的细胞间通讯通过外泌体增加
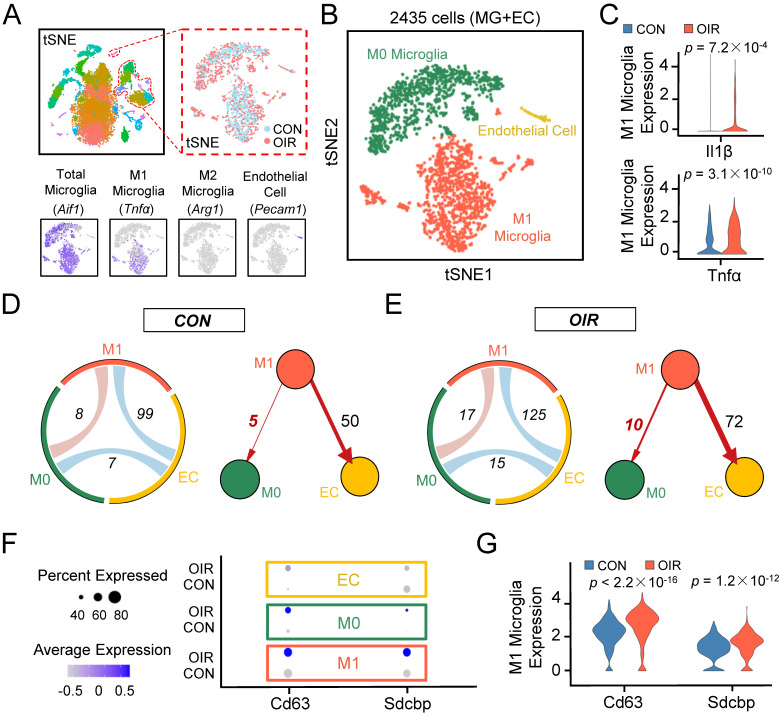
图1A:15185个单细胞的t-SNE图。下图:特征图显示了用于定义集群的一些基因的表达。
图1B:2435个细胞(内皮细胞加各种类型的小胶质细胞)在正常和OIR下的t-SNE图。
图1C:OIR使M1小胶质细胞中il - 1β、Tnfα等M1活化小胶质细胞标志物表达增加。
图1D-E:和弦图和有向图显示,不同细胞间的通讯增强,细胞间通讯从M1小胶质细胞到ECs或M0小胶质细胞增加。
图1F:两个已知外泌体标记基因在三个细胞群中的特征表达热图。
图1G:OIR的M1小胶质细胞中外泌体的两个已知标记基因的表达增加。
2.M1小胶质外泌体在体外促进小胶质细胞M1极化
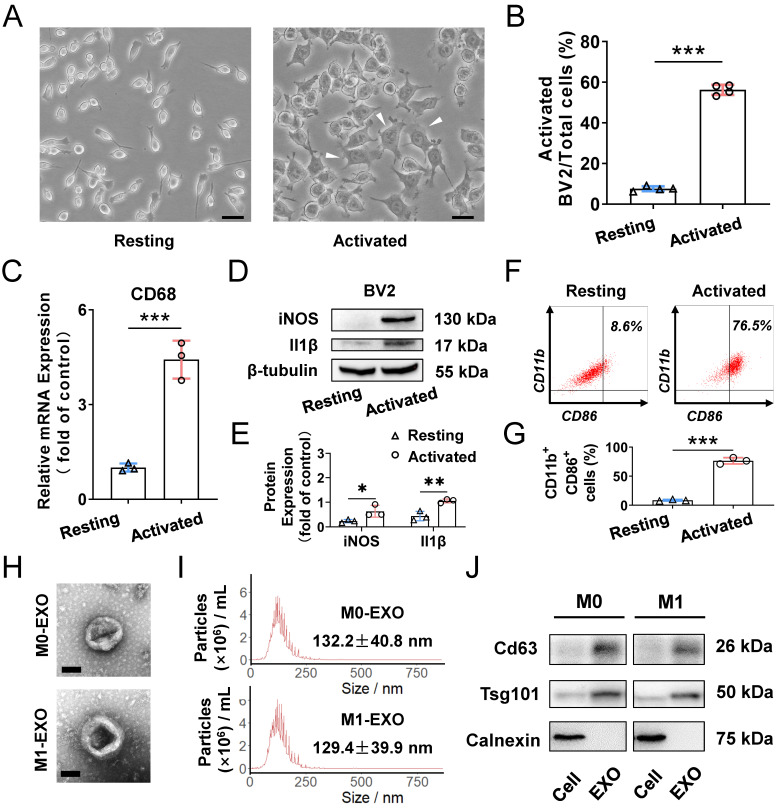
图2A:LPS处理后,静止和激活的小胶质细胞的代表性显微镜图像,LPS处理后细胞呈不规则形态,假足数量较多。
图2B:定量测定多极和变形虫型小胶质细胞每场激活的百分比,与添加PBS的对照组相比,激活的小胶质细胞比例增加。
图2C:qRT-PCR检测LPS处理组和阴性对照组CD68 mRNA水平。
图2D:Western blot检测结果显示,与M0小胶质细胞相比,M1小胶质细胞的iNOS和il - 1β蛋白水平升高。
图2E:小胶质细胞蛋白表达相对定量。
图2F:LPS增加了BV2小胶质细胞的M1表型(CD11b-和CD86 -阳性)转换。
图2G:LPS刺激BV2小胶质细胞CD11b-和CD86阳性细胞百分比的统计分析。
图H-J:M0和M1小胶质来源外泌体的代表性透射电镜图像,呈现典型杯状结构(H);纳米颗粒跟踪分析显示外泌体的平均大小在30-150nm(I);Western blot检测外泌体蛋白标志物CD63和TSG101的表达(J)。
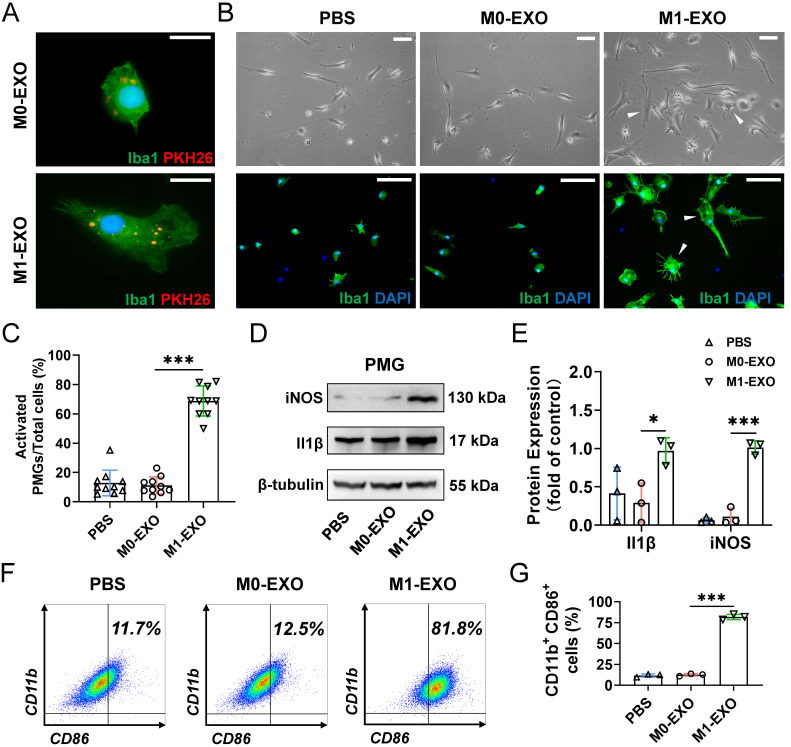
图3A:M0-EXO和M1-EXO(红色)都定位于iba1阳性pmg(绿色)的细胞质中,表明外泌体被pmg吞噬。
图3B:显微镜(上)和免疫荧光(下)图像显示M0-EXO或M1-EXO处理后PMGs的形态学变化。
图3C:量化多极和变形虫形态的每场活化PMGs的百分比,结果显示与PBS组和M0 - EXO处理组比较,M1-EXO处理组出现更多变形虫和不规则形状的iba1阳性细胞。
图3D:Western blot检测结果显示,M1-EXO处理后iNOS和Il - 1β蛋白水平升高。
图3E:RT-QPCR检测iNOS和Il-1β的表达水平,结果显示与PBS组和M0 - EXO处理组相比,M1-EXO组细胞中iNOS和Il-1β的表达显著升高
图3F-G:流式细胞术结果进一步证实,M1- exo处理显著增加了M1小胶质细胞的百分比。
3.M1小胶质细胞通过外泌体增强M0小胶质细胞的血管生成潜能
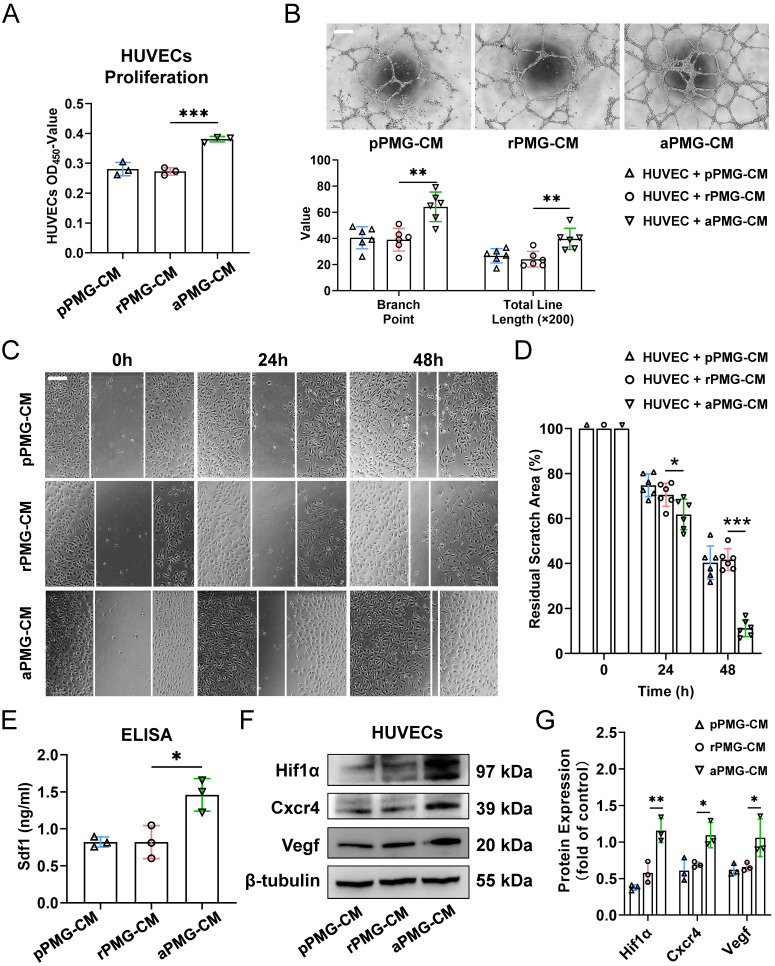
图4A:pPMG-CM、 rPMG-CM或aPMG-CM处理后,CCK8检测HUVECs增殖情况,与pPMG-CM或rPMG-CM处理的细胞相比,aPMG-CM显著促进HUVECs的增殖。
图4B:Matrigel上具有代表性的管状形成显微图像(上)和分支点和总线路长度的量化(下)结果显示,与pPMG-CM或rPMG-CM处理相比,aPMG-CM处理增加了毛细血管样管和连接的数量。rPMG-CM显著增强了管的形成。
图4C-D:细胞划痕实验评估CM对HUVECs迁移的影响。结果显示aPMG-CM治疗后24小时和48小时光镜下创面残余面积明显减小。
图4E:在治疗24小时后,从HUVECs中提取全蛋白以评估血管生成相关蛋白的表达。ELISA结果显示,与pPMG-CM和rPMG-CM组相比,aPMG-CM组Sdf1的表达显著升高。
图4F-G:Western blot结果显示,与其他组相比,aPMG-CM刺激后HUVECs中Hif1α、Cxcr4和Vegf的蛋白水平升高。
4.体内M1小胶质外泌体促进M1视网膜小胶质细胞的极化
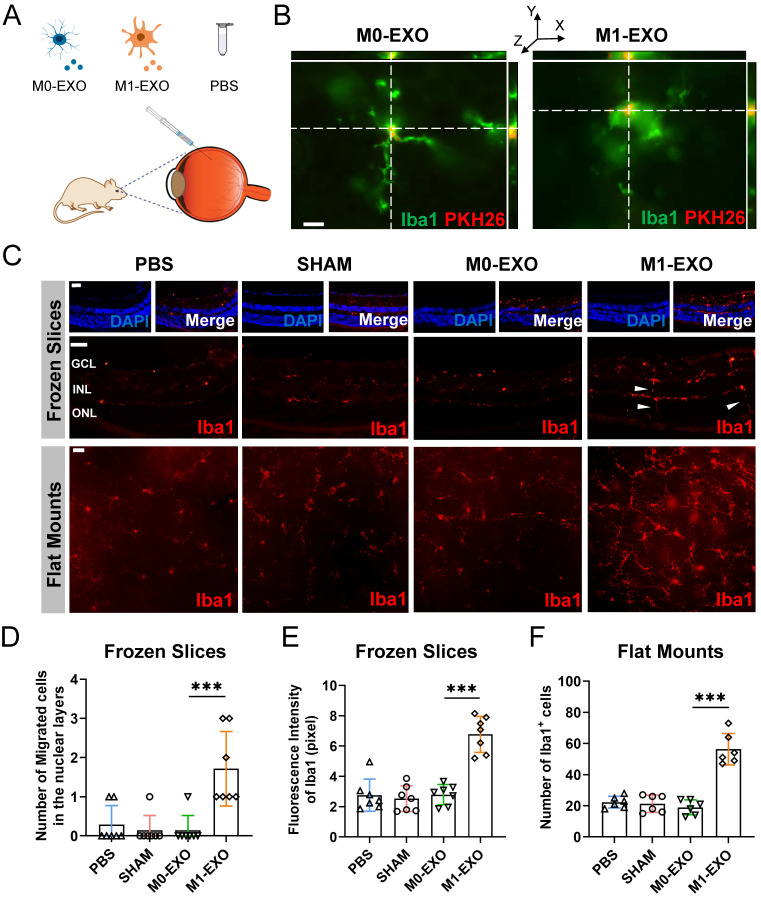
图5A:PBS、M0-EXO、M1-EXO处理的成年小鼠模型示意图。
图5B:玻璃体内注射两天后,通过3D共聚焦图像在小鼠视网膜中检测到pkh26标记的外泌体(红色),外泌体定位在Iba1+小胶质细胞的细胞质中(绿色)。
图5C:注射后6周,冷冻视网膜切成片或呈放射状切入载玻片,然后用iba1阳性抗体(红色)进行染色。
图5D:经M1-EXO处理后,核层内迁移的小胶质细胞数量增加,为活化小胶质细胞的典型细胞特征。
图5E-F:基于冰冻切片的荧光强度(E)和lba1+细胞数量定量,结果显示M1-EXO处理显著提高了小胶质细胞的极化水平,而其他组间差异无统计学意义。
5.M1小胶质外泌体在视网膜小胶质细胞激活后诱导血管生成
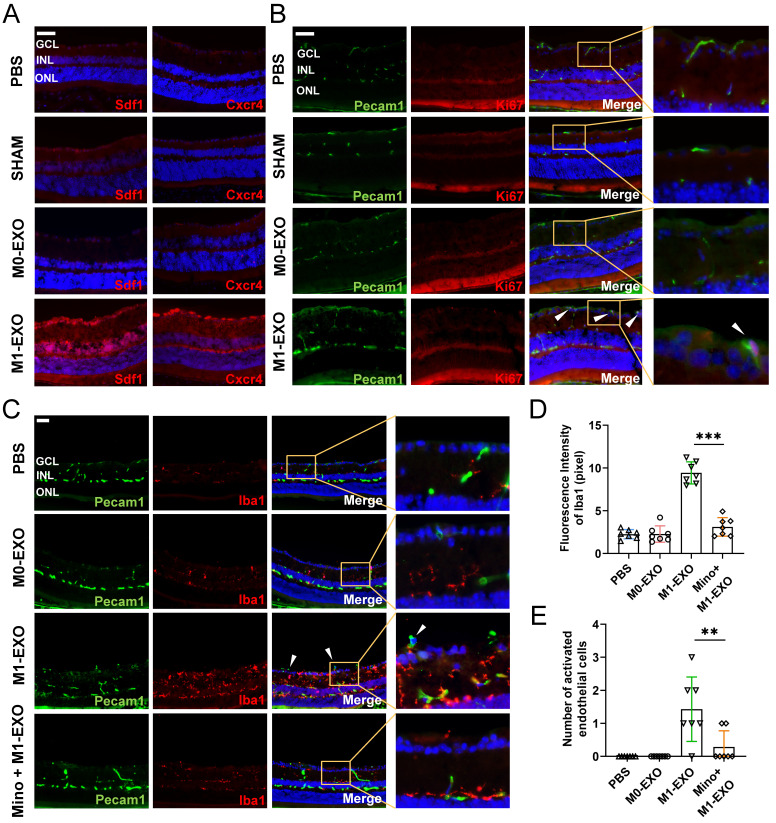
图6A:免疫荧光分析显示,在PBS、SHAM或M0-EXO治疗后,血管生成标志物Cxcr4和Sdf1在视网膜外缘和脉络膜中显示微弱的非特异性染色。相比之下,M1-EXO注射小鼠的切片中,Cxcr4和Sdf1呈强阳性。
图6B:用Pecam1和Ki67抗体对视网膜组织切片进行双染,前者是血管内皮细胞的标记物,后者是增殖细胞的标记物。在对Ki67-和Pecam1阳性细胞进行计数后,与其他三组相比M1-EXO处理组仅观察到内皮细胞增殖。
图6C:PBS注射、M0-EXO、M1-EXO或米诺环素加M1-EXO组Pecam1(绿色)和Iba1(红色)的双染。在M1-EXO给药前米诺环素治疗可有效抑制M1-EXO诱导的小胶质细胞活化和异常EC增殖。
图6D:荧光强度定量显示,M1-EXO诱导小胶质细胞活化,米诺环素预处理可缓解这种上调。
图6E:各组异常EC数量定量分析。
6.M1小胶质外泌体通过外泌体miR-155-5p诱导静息小胶质激活
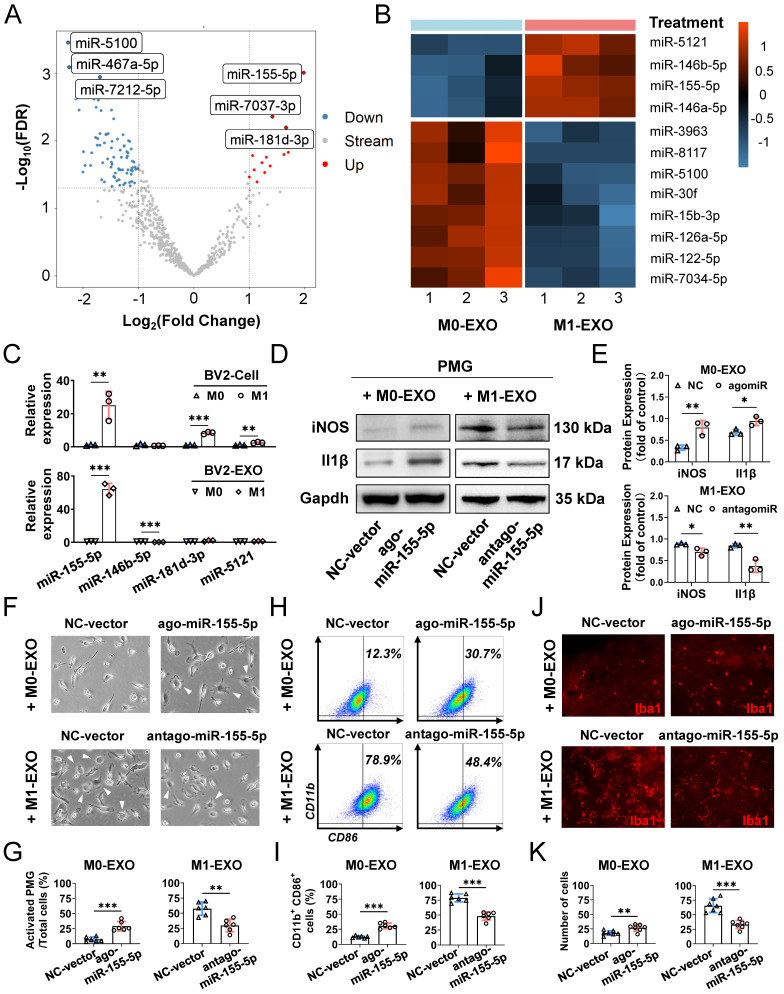
图7A:火山图显示了M0-EXO和M1-EXO之间miRNA表达的变化。热图中的红色表示上调;蓝色表示下调。
图7B:热图显示了miRNA测序后静息和活化小胶质细胞外泌体miRNA的差异。
图7C:qRT-PCR检测激活前后BV2小胶质细胞和外泌体中miR-155-5p、miR-146b-5p、miR-181d-3p、miR-5121表达水平。
图7D-E:Western blot检测M0-EXO、转染agomir-155-5p的M0-EXO、M1-EXO和转染antagomir-155-5p的M1-EXO处理后PMGs中iNOS和il1β蛋白表达水平。
图7F:显微镜图像显示PMGs在转染M0-EXO、转染agomir-155-5p的M0-EXO、M1-EXO和转染antagomir-155-5p的M1-EXO后的形态学变化。
图7G:定量分析活化PMGs百分比。
图7H:四组CD11b+ CD86+ PMGs的百分比。
图7I:PMGs中CD11b-和CD86-阳性细胞百分比的统计分析
图7J:不同处理组Iba1染色的代表性平载图像。
图7K:不同处理组细胞定量。
7.外泌体miR-155-5p通过调节Socs1/NFκB通路参与小胶质细胞激活
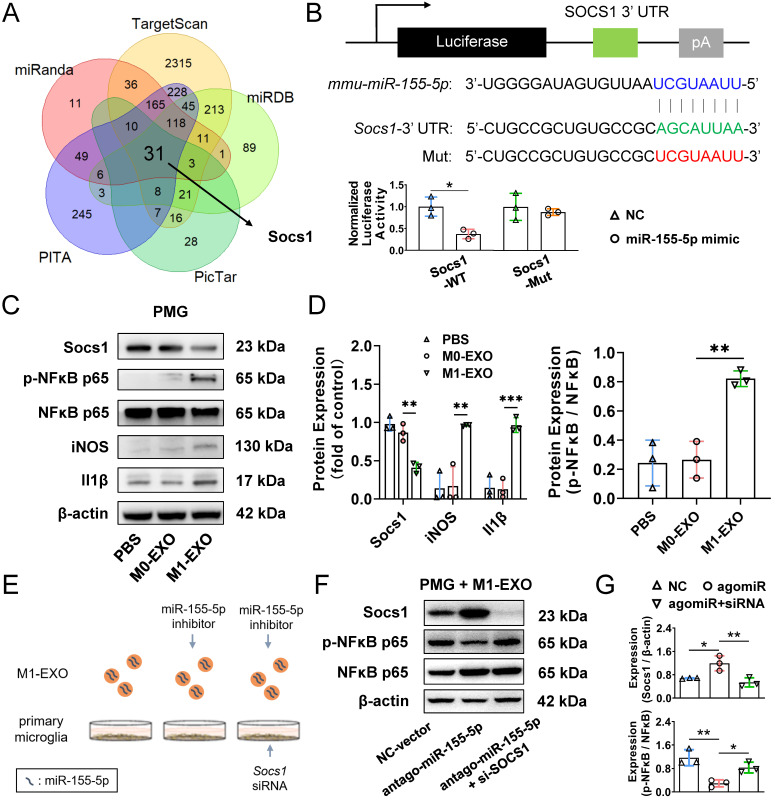
图8A:维恩图显示来自五个miRNA数据库的数据的重叠。
图8B:双荧光素酶报告基因检测证实了miR-155-5p与Socs1之间的直接相互作用。。
图8C-D:Western blot结果显示,M1-EXO处理下调了Socs1的表达,随后上调了PMGs中磷酸化的NFκB和M1激活的标记基因的表达。
图8E:功能缺失示意图。用M1-EXO、agomir-155-5p转染M1-EXO或转染的M1-EXO结合Socs1基因敲低处理PMGs36小时。
图8F-G:Western blot结果显示,在anagomir -155-5p转染M1-EXO单独处理和结合Socs1基因的敲除后,Socs1蛋白水平和磷酸化的NFκB发生了变化。
8.转录因子Irf1促进小胶质细胞和外泌体miR-155-5p的表达
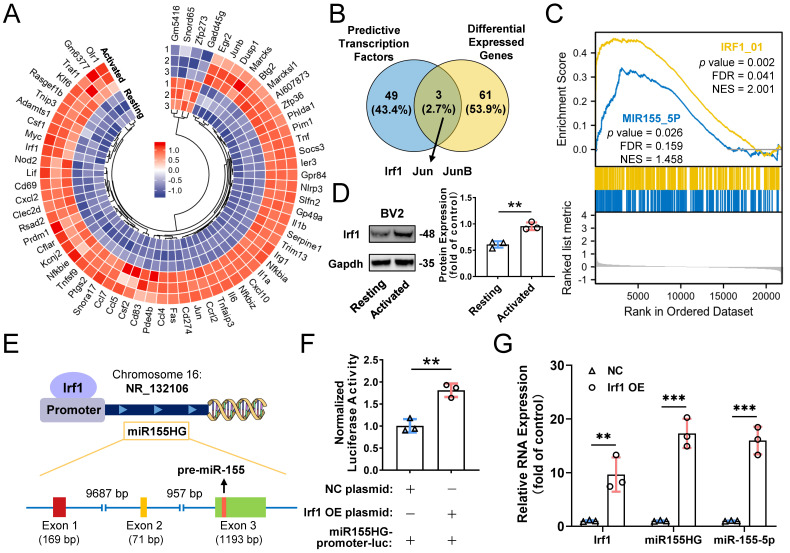
图9A:基于mRNA测序的静息和M1激活的BV2细胞mRNA差异热图。
图9B:JASPAR数据库预测miR-155-5p mRNA测序差异mRNA与潜在直接转录因子之间的重叠结果。
图9C:静息和活化小胶质细胞之间Irf1和miR-155-5p相关信号的基因集富集分析。
图9D:代表性凝胶图像及Irf1密度测定定量,结果显示与静止的BV2小胶质细胞相比,激活的BV2小胶质细胞中Irf1的蛋白表达显著增加。
图9E-F:Irf1在miR-155-5p (miR155HG)宿主基因特定序列中的结合位点。Irf1过表达或阴性对照质粒与miR-155-5p启动子荧光素酶质粒共转染后BV2细胞中miR155HG(含miR-155-5p启动子)的相对荧光素酶活性。
图9G:qRT-PCR检测Irf1 OE组和阴性对照组中Irf1、miR155HG和miR-155-5p的RNA水平。
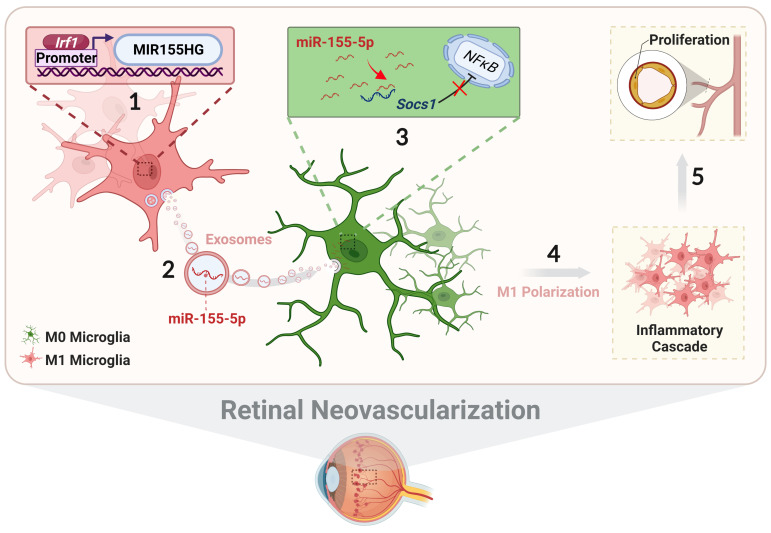
结论
在本研究中作者系统地阐述了外泌体miR-155-5p、小胶质细胞极化和新生血管形成之间的关系,包括血管生成过程中复杂视网膜微环境中各种类型小胶质细胞之间的细胞间通讯。如图10所示,激活的小胶质细胞来源的外泌体通过转移miR-155-5p将极化能力传递给静息的小胶质细胞。升高miR-155-5p可抑制Socs1激活NFκB通路,最终促进小胶质细胞活化和血管内皮细胞异常增殖。此外,Irf1被上调,有效地驱动了miR-155-5p在活化的小胶质细胞中的表达,从而导致miR-155-5p被外泌体包封的趋势增加。因此,来自M1小胶质细胞的外泌体miR-155-5p可能对视网膜炎症产生级联和放大效应,并作为视网膜新生血管的间接驱动因素。本研究不仅阐明了视网膜新生血管形成的机制,为临床视网膜新生血管形成提供了新的、有针对性的、潜在的治疗策略,而且还建立了一种新的病理动物模型。