研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【MedComm】 9.9分,M1巨噬细胞来源外泌体通过向肝细胞转移LncRNA H19促进自身免疫性肝损伤
1167 人阅读发布时间:2023-09-20 17:32
自身免疫性肝炎(AIH)是一种病因不明的慢性免疫细胞介导的肝脏疾病。尽管肝细胞凋亡在AIH进展中起关键作用,但细胞死亡调控的确切机制仍知之甚少。刀豆蛋白A (ConA)已被广泛认为是免疫介导的小鼠肝损伤的合适模型。湾湾今天分享的是发表在【MedComm】上题为“M1 macrophage‐derived exosomes promote autoimmune liver injury by transferring long noncoding RNA H19 to hepatocytes”的文章,本研究中,作者旨在研究lncRNA H19和外泌体是否在ConA诱导的肝炎中起关键作用。研究中作者发现在ConA治疗后肝脏中H19和外泌体的水平升高。外泌体抑制剂GW4869抑制H19的上调。H19主要在M1中表达。更重要的是,作者发现H19通过外泌体从M1转运到肝细胞,并激活HIF - 1α-p53信号通路,从而导致肝细胞凋亡。作者的研究结果揭示了巨噬细胞在AIH中的作用,表明M1来源的外泌体H19参与AIH,可能是AIH的新靶点。

研究结果
1.lncRNA H19和外泌体在ConA诱导的肝炎中均升高
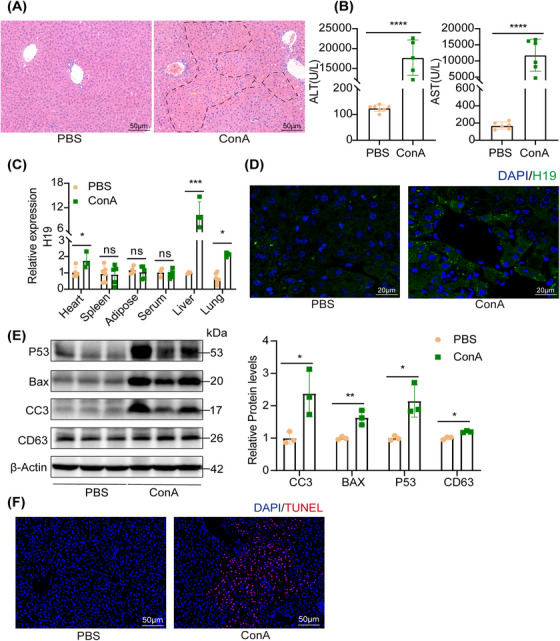
图1A:肝组织切片代表性H&E染色,虚线为坏死区域。
图1B:注射ConA后血清ALT、AST水平。
图1C:采用RT - PCR方法分析不同组织中H19 mRNA水平。
图1D:肝脏中靶向H19的原位杂交(FISH)代表图像,H19确实存在于肝细胞中,在胚胎肝脏中高表达,而在成人肝脏中表达水平较低。
图1E:Western blot检测注射ConA的小鼠肝脏中CD63和凋亡蛋白(CC3、BAX和p53)的表达水平。
图1F:TUNEL染色结果显示ConA‐处理小鼠的TUNEL阳性细胞和凋亡蛋白的数量有所增加。
2.肝脏特异性过表达H19加重ConA诱导肝炎
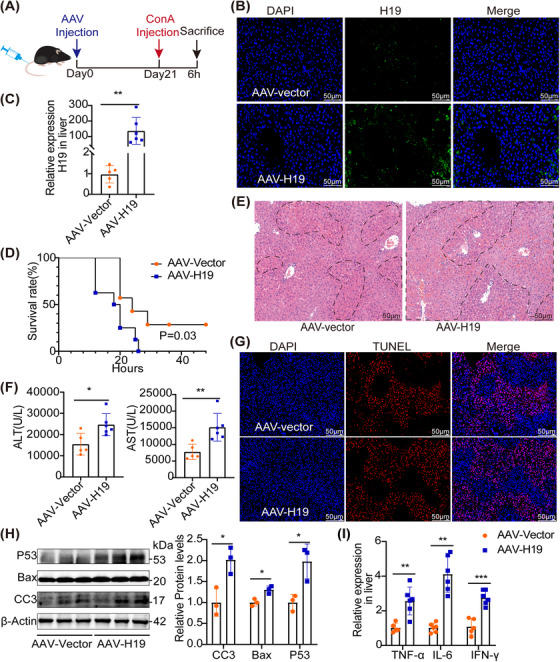
图2A:小鼠在ConA治疗前经尾静脉注射AAV并处死。
图2B-C:H19表达的FISH代表性图像和RT - PCR结果显示,与用AAV- H19载体处理的对照组相比,用AAV - H19载体递送的小鼠肝脏中H19的表达显著增加。
图2D:致死剂量ConA处理后AAV-H19小鼠和AAV -载体对照小鼠的存活率,结果显示AAV-H19小鼠有更高的死亡率,表明AAV-H19小鼠更容易感染ConA诱导的肝炎。
图2E-F:肝损伤的代表性图像(E)和注射AAV- Vector或AAV- H19的ConA处理小鼠的血清ALT和AST水平(F)。
图2G:TUNEL染色显示肝脏内肝细胞凋亡。
图2H:Western blot检测肝组织中凋亡蛋白的表达,H19‐过表达的肝脏显著增加的肝细胞凋亡水平。
图2I:RT-PCR结果显示炎症标志物IL-6、TNF-α和IFN-γ表达水平升高。
3.外泌体抑制剂GW4869可减轻ConA诱导的肝炎
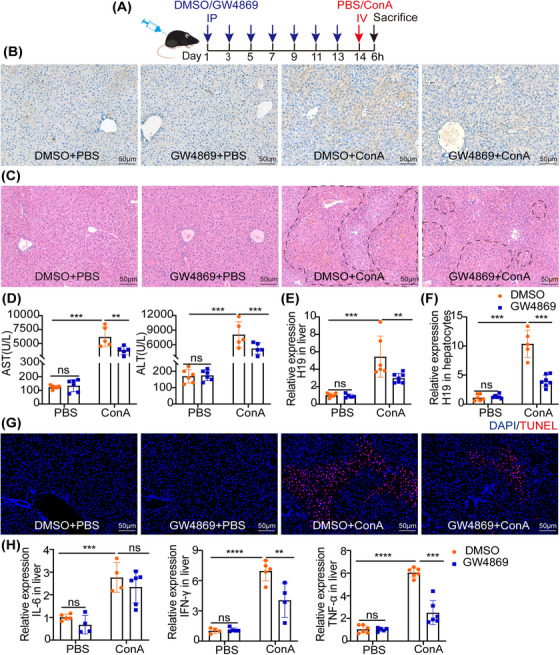
图3A:GW4869对ConA诱导肝损伤作用的实验过程示意图。
图3B:免疫组化结果显示CD63水平显著下降,表明肝脏外泌体被成功地耗尽。
图3C-D:组织学肝损伤的代表性图像(C)和RT-PCR检测是否注射GW4869的ConA后血清ALT和AST水平(D),结果表明GW4869显著改善了ConA诱导的肝损伤。
图3E-F:RT-PCR分析含或不含GW4869的ConA小鼠肝脏和肝细胞的H19水平,结果表明GW4869治疗降低了ConA处理的肝脏(E)和肝细胞(F)中H19的上调,这与对照组相当。
图3G:TUNEL染色结果显示,GW4869处理降低了ConA处理小鼠肝脏中的TUNEL阳性数量。
图3H:RT-PCR检测炎症标志物IL-6、TNF-α和IFN-γ表达水平,结果表明GW4869处理降低了ConA处理小鼠肝脏中的炎症细胞因子水平。
4.H19主要在M1巨噬细胞中表达
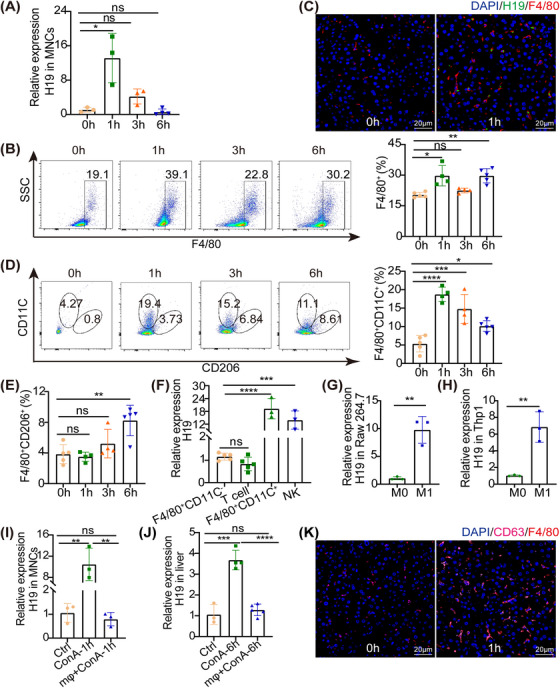
图4A:RT‐PCR结果显示,从ConA处理小鼠肝脏中分离的MNCs的H19发生了倍数变化。
图4B:流式细胞术分析ConA处理小鼠MNCs中F4/80+,结果显示,ConA处理小鼠MNCs中F4/80+细胞百分比增加。
图4C: ConA处理1 h后肝脏中F4/80(红色)和H19(绿色)的共定位,获得了巨噬细胞特异性标记物F4/80。
图4D-E:流式细胞术分析ConA处理小鼠单核细胞F4/80+CD11C+和F4/80+CD206+,结果显示注射ConA后1 h CD11c+F4/80+百分比增加,而CD206+F4/80+百分比未增加。
图4F:RT-PCR检测损伤肝脏NK细胞、T细胞和巨噬细胞中H19的表达水平,结果表明H19主要在CD11c+F4/80+中表达,在T细胞、NK细胞和CD11c−F4/80+中的表达水平相对较低。
图4G-H:用IFN-γ和 LPS同时刺激RAW264.7巨噬细胞和THP-1细胞24 H后,通过RT-PCR检测,结果显示H19在小鼠RAW246.7巨噬细胞和人THP‐1中扩增。
图4I:通过RT-PCR检测MNCs用或不用Clodronate liposomes处理ConA后 1小时的肝脏中H19水平。
图4J:通过RT- PCR 检测小鼠在用活不用Clodronate liposomes处理ConA后6小时的肝脏中H19水平。
图4K:ConA处理1小时后肝脏中F4/80(红色)和CD63(粉红色)的共定位,结果显示巨噬细胞的外泌体分泌CD63显著增加。
5.M1分泌外泌体H19
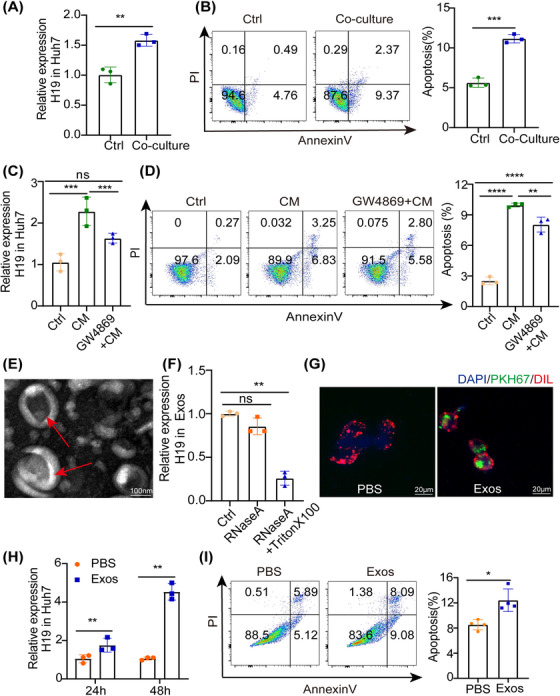
图5A:LPS/IFN‐γ同时刺激THP‐1,并与Huh7细胞在0.4 μm的孔板中共培养。通过RT-PCR检测结果显示,Huh7中H19的水平上调,有少量增加。
图5B:用Annexin V-PI检测结果显示共培养后Huh7细胞的凋亡增加。
图5C-D:用M1衍生的条件培养基(CM)或用外泌体抑制剂(GW4869)预处理的CM共培养24小时。通过RT-PCR检测结果显示GW4869抑制了H19的上调(C);通过流式分析结果显示GW4869降低了Huh7的凋亡率(D)。
图5E:透射电子显微镜(TEM)检测M1来源的CM中分离外泌体,显示直径约100nm的杯状囊泡。
图5F:通过RT-PCR检测结果显示外泌体中的H19表达在单独使用RNase时没有变化,在同时使用RNase A和Triton X‐100处理后显著降低。
图5G:共聚焦荧光显微镜图像显示,M1来源的外泌体与Huh7共培养12小时后,PKH67标记的外泌体被内化。
图5H-I:RT- PCR检测H19在Huh7中的表达,结果显示增加几倍(H); Annexin V‐PI分析Exos或PBS处理后Huh7细胞的凋亡情况(I)。
6.M1分泌的外泌体通过肝细胞凋亡加剧了ConA诱导的肝炎
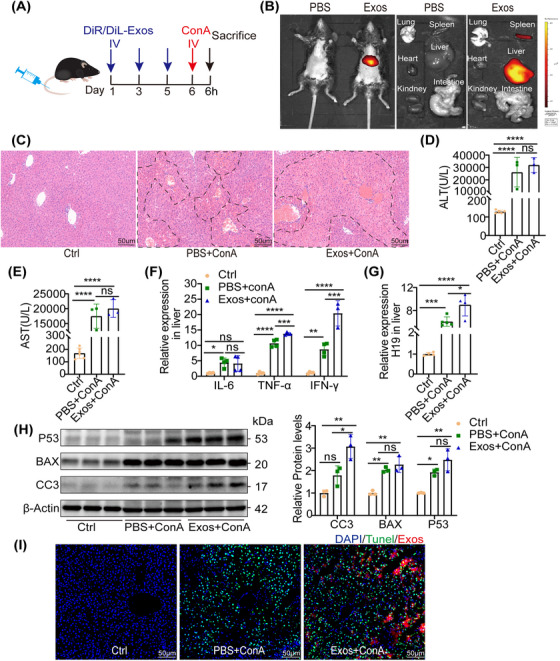
图6A:实验过程示意图,为分析M1衍生外泌体对ConA诱导的小鼠肝损伤的影响,从RAW264.7中分离出外泌体,同时用LPS和IFN‐γ刺激,小鼠通过尾静脉注射每天2次,共3次,每次约200μg外泌体或200μl PBS。
图6B:为了评估M1衍生外泌体的分布,在Dir标记外泌体或注射PBS后4hr,用IVIS光谱系统进行体内和体外荧光成像。结果显示,体内和离体荧光信号均在肝脏中积累。
图6C:HE染色结果显示更多坏死区域和广泛出血。
图6D-E:注射PBS或外泌体的ConA处理小鼠血清ALT和AST水平检测,结果显示外泌体移植后血清ALT和AST水平也较单独给药ConA略有升高。
图6F:通过RT-PCR检测炎症细胞因子IL- 6,、TNF -α、IFN-γ表达水平,结果显示外泌体处理后的炎症细胞因子水平升高。
图6G:转染外泌体后,通过RT - PCR检测结果显示,ConA处理小鼠肝脏中H19的表达升高。
图6H:Western blot检测凋亡蛋白Caspase-3、 BAX、p53表达水平,结果显示外泌体处理导致促凋亡蛋白升高。
图6I:肝脏TUNEL染色结果显示,DiL标记的外泌体在TUNEL阳性细胞中积累。
7.H19通过HIF‐1α-p53信号通路诱导肝细胞凋亡
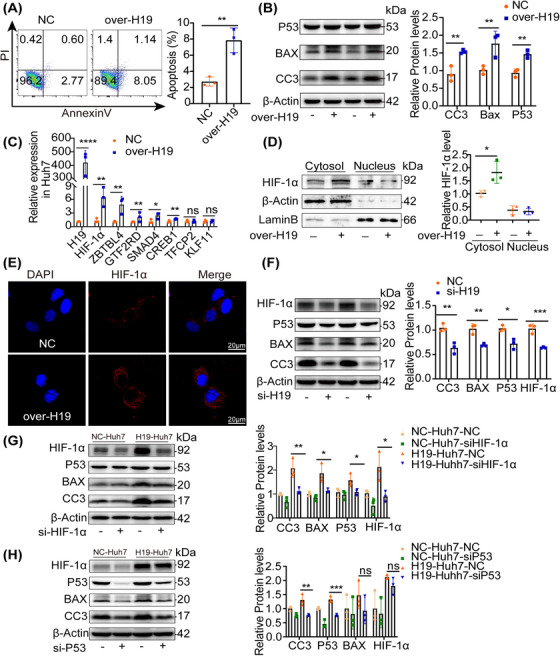
图7A:流式细胞术分析转染H19或scramble后Huh7细胞的凋亡,过表达H19显著增加了Huh7。
图7B:免疫印迹分析结果显示,在scramble和过表达H19的Huh7细胞中,过表达H19显著增加了促凋亡蛋白p53、Caspase-3、BAX表达水平。
图7C:RT-PCR检测转录因子在scramble和over-H19 Huh7细胞中的表达水平,结果显示HIF‐1α是最受差异调节的因子。
图7D-E:通过免疫荧光(E)和western blot检测(D)HIF‐1α在Huh7中的亚细胞定位,发现H19过表达后HIF‐1α在细胞质中积累。
图7F:免疫印迹分析转染siH19的Huh7细胞中HIF-1α、p53和Caspase - 3的表达,结果显示H19在Huh7中沉默,显示细胞凋亡和HIF‐1α水平显著降低。
图7G-H:免疫印迹分析转染siHIF- 1α或sip53的NC/H19 Huh7细胞中p53和CC3的表达,结果显示,在HIF-1α被敲除后,p53在过表达H19 Huh7中的表达减少,以及细胞凋亡,而对H19没有反应(G);在过表达H19 Huh7中沉默的p53减少了细胞凋亡,而HIF‐1α的表达保持不变(H)。
结论
在本研究中,作者发现H19在M1衍生的外泌体中表达,但是作者不能确定M1衍生的外泌体H19在肝脏注射后被转运到肝细胞中。尽管ConA已被广泛用于模拟小鼠免疫介导的肝损伤,模拟人类AIH的临床特征,但AIH的机制仍有待确定。
总而言之,作者确定了H19在ConA诱导的肝炎中的作用,它来源于M1并通过外泌体转运到肝细胞,通过HIF1α‐p53信号通路促进肝细胞凋亡。这些发现代表了一种新的ConA诱导肝炎的机制。






