研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Biomater Res】11.3+,过表达mir-214-3p间充质干细胞外泌体促进心肌修复
1422 人阅读发布时间:2023-09-27 11:44
急性心肌梗死(Acute myocardial infarction, AMI)不可逆地引起心肌细胞死亡和心肌重构,导致缺血性心脏病。目前,手术干预和溶栓是重要的治疗方法,手术过程中及手术后可能引起心肌细胞死亡、微血管损伤等再灌注损伤。所以,有必要开发有效的补充疗法来减少心肌细胞的损失,湾湾今天分享的一篇发表在【Biomater Res】上的题为“Exosomes derived from mir-214-3p overexpressing mesenchymal stem cells promote myocardial repair”的研究中,作者首先从转基因间充质干细胞中分离出富含miRNA -214的外泌体(miR - 214e -exo),然后通过心肌内注射将这些miR-214外泌体递送到心脏组织,以促进心功能恢复。表明外泌体介导的特异性miRNA递送可能对AMI的治疗有影响。

研究结果
1.huMSCs及其衍生外泌体的表征
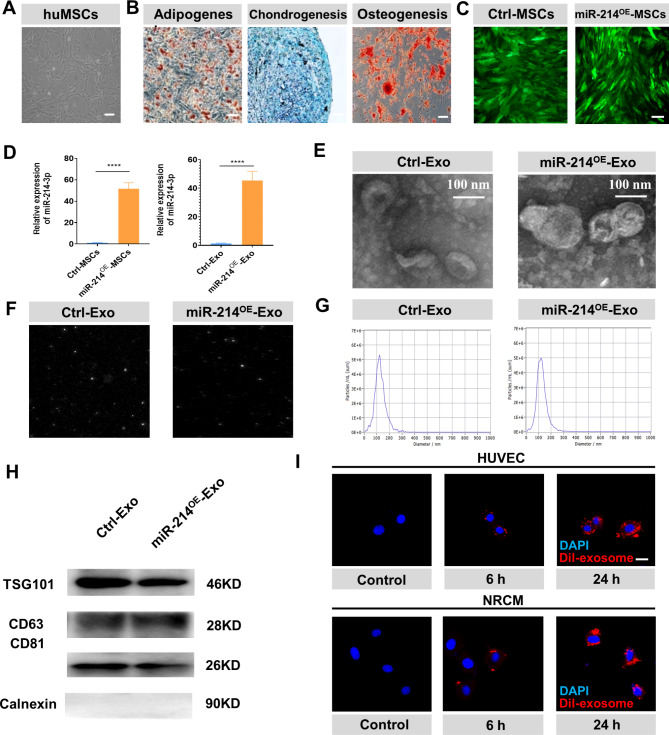
图1A:huMSCs的形态学图像。
图1B:油红染色、阿利新蓝染色和茜素红染色证实huMSCs在脂肪形成、软骨形成和成骨方面的多向分化潜力。
图1C:荧光显微镜检测绿色荧光,证实了miR-214- mscs(用含有miR-214的慢病毒转染的huMSCs)和Ctrl-MSCs(用含有miR-214阴性对照的慢病毒转染的huMSCs)的慢病毒修饰。
图1D:RT-PCR检测miR-214-3p在细胞和外泌体中的表达,结果显示与Ctrl-MSC组相比,miR-214-MSC组细胞和外泌体中的miR-214-3p表达升高。
图1E:TEM结果显示纯化的Ctrl-Exo和miR-214OE- Exo的杯状形态均为圆形或盘状。
图1F-G:纳米颗粒跟踪分析Ctrl-Exo和miR-214OE-Exo的粒径大小,大多数约为30-150 nm。
图1H:Western Blot结果显示,Ctrl-Exo和mir-214e-exo组中TSG101、CD63和CD81的外泌体蛋白标记物呈阳性表达,Calnexin不表达。
图1I: Dil标记外泌体的共聚焦图像显示,在孵育后6和24 h分别被HUVECs和nrcms摄取。
2.在体外H/SD条件下,miR-214OE-Exo对HUVECs和nrcms的保护作用优于 Ctrl-Exo
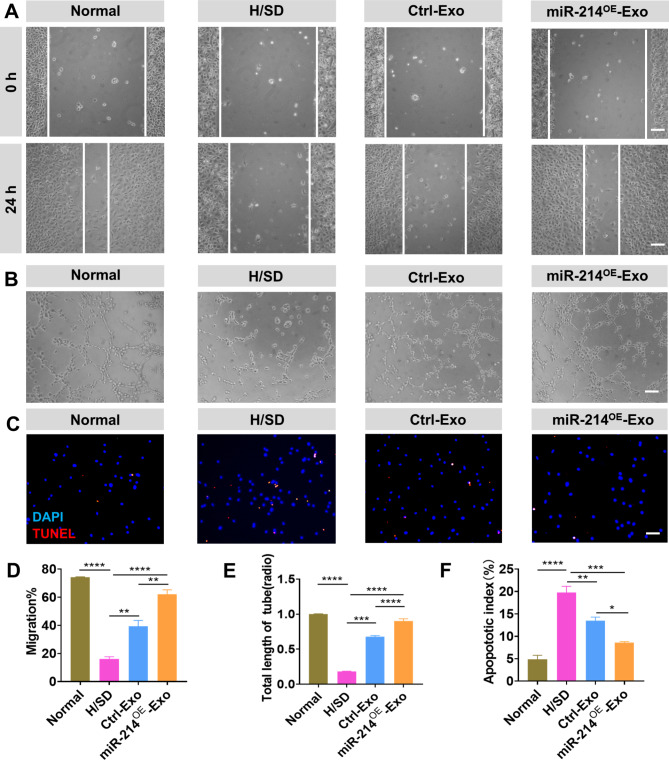
图2A、D:PBS、Ctrl-Exo和miR- 214OE -Exo培养的HUVECs迁移情况,结果显示与PBS和Ctrl-Exo组相比,miR-214OE-Exo组HUVECs的迁移率明显提高。
图2B、E:PBS、Ctrl-Exo和miR-214OE-Exo孵育HUVECs成管及定量分析,结果显示与PBS和Ctrl-Exo组相比,miR-214OE-Exo组HUVECs的管状形成也显著增加。
图2C、F:不同组间nrcms细胞凋亡的TUNEL染色代表图像及不同组间nrcms细胞凋亡百分比的定量分析,结果显示与PBS和Ctrl -Exo组相比,miR-214OE-Exo组中NRCMs的凋亡减少。
3.miR-214OE-Exo有效地保护了心肌梗死模型大鼠的心功能
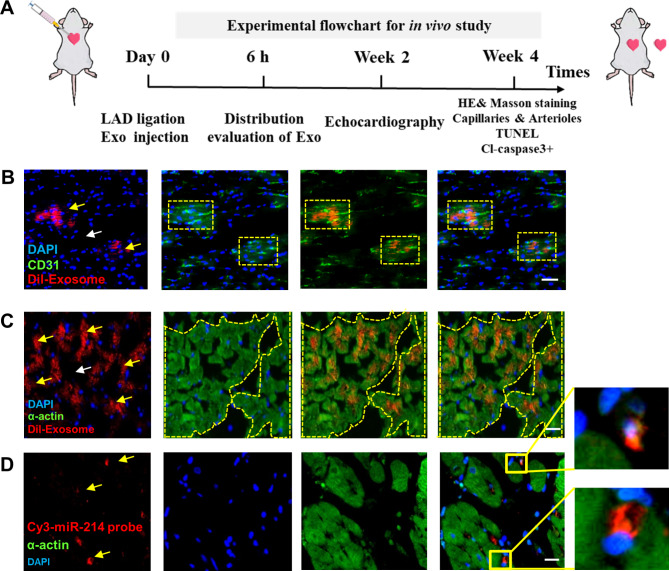
图3A:体内实验设计流程图,将MiR-214OE-Exo、Ctrl -Exo或PBS (AMI对照组)注射到梗死心脏边缘区域。
图3B-C:免疫荧光法检测心肌内注射Dil标记外泌体6 h后CD31 (B)和α-actin(C)的表达水平,结果显示在上皮细胞附近(B)和心肌中(C)存在较大的dil标记阳性区域,表明miR-214OE-Exo在梗死心脏的心肌细胞和内皮细胞中有效存在。
图3D:SD大鼠左室心肌梗死的FISH分析。使用Cy3-miR-214探针检测miR-214,结果显示miR-214在注射后6小时集中,主要集中在心肌的核周区域。
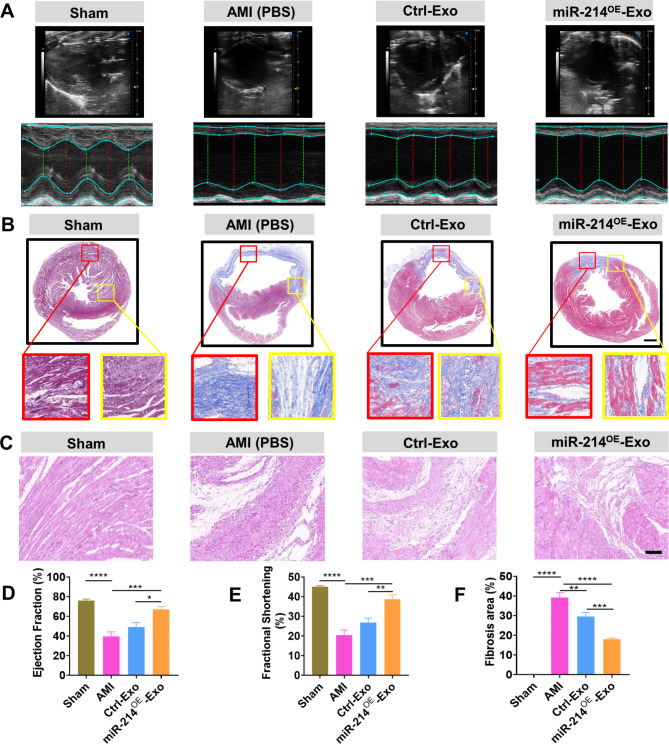
图4A:不同组心肌梗死后28天超声心动图的代表性图像。
图4B:具有代表性的Masson染色心肌横断面。心肌梗死后4周注射PBS、Ctrl-Exo和miR-214OE-Exo。
图4C:心肌梗死后28天边界区HE染色,结果显示与Ctrl -Exo和AMI组相比,miR-214OE-Exo组的炎症细胞浸润明显减少。
图4D-E:心肌梗死后28天超声心动图测量左室射血分数(LVEF)和左室缩短分数(LVFS),结果显示与PBS组和Ctrl-Exo组相比,miR-214OE-Exo组的LVEF和LVFS明显改善。
图4F:各组间心脏纤维化定量分析,结果显示miR-214OE-Exo组的纤维化面积与PBS组和Ctrl-Exo组相比明显减少。
4.miR-214OE-Exo促进心肌梗死心脏血管生成和心肌细胞存活
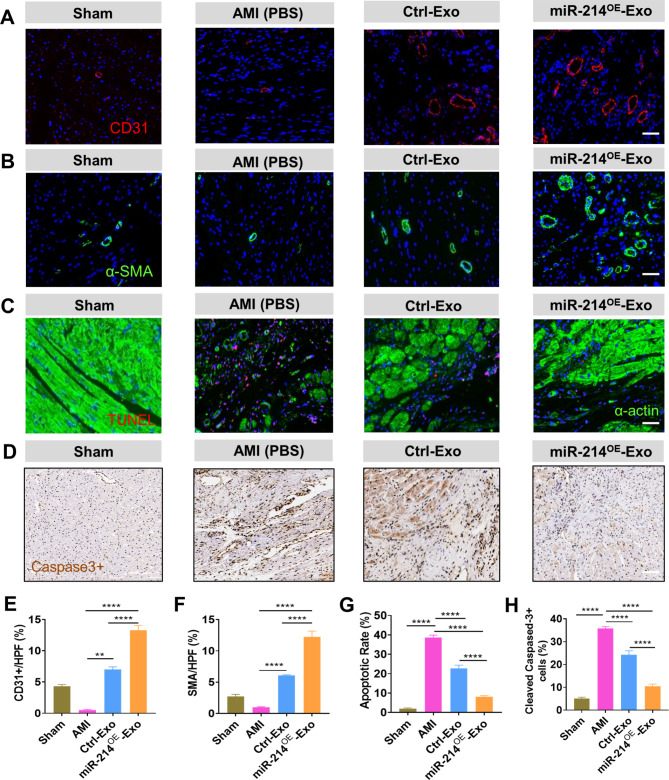
图5A-B和E-F:采用CD31和α-SMA抗体对毛细血管和小动脉进行免疫荧光染色,结果显示,4周梗死后,miR-214OE-Exo组毛细血管密度显著高于Ctrl -Exo组和AMI组(图5A、E),毛细血管密度和小动脉密度的变化趋势相同(图5B、F)。。
图5C-D和G-H:梗死4周大鼠心脏的TUNEL和Cleaved Caspase-3染色,结果显示,与PBS相比,外泌体处理后梗死心肌边缘区凋亡细胞数量明显减少。
此外,在mir - 214e - exo组中,TUNEL+和Cleaved Caspase-3 +细胞最少。
5.外泌体mir-214-3p通过靶向PTEN调控p-AKT减轻心肌细胞损伤
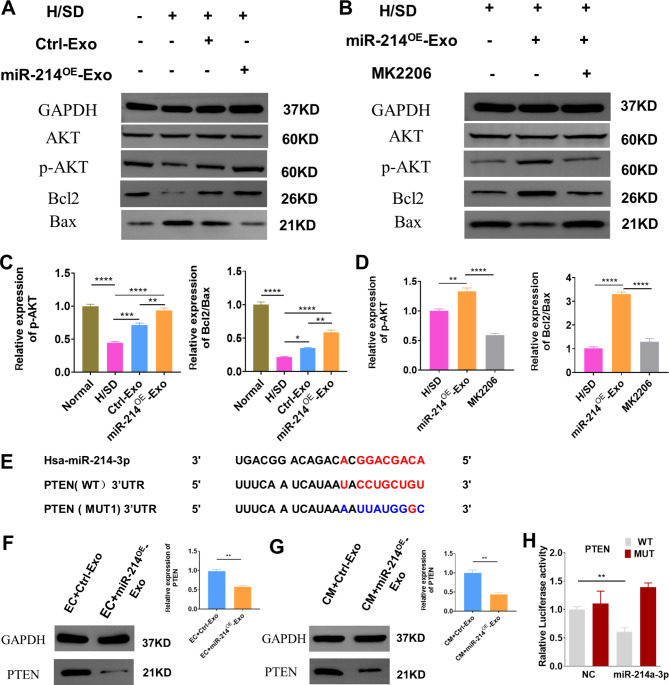
图6A:Western blot分析显示各组间p-AKT、AKT、Bcl2和Bax的表达水平。
图6B:用miR-214OE-Exo或miR-214OE-Exo + MK2206处理新生大鼠心肌细胞(NRCMs),然后暴露于H/SD。Western blot分析显示各组间p-AKT、AKT、Bcl2和Bax的表达水平。
图6C:各组间p-AKT、AKT、Bcl2、Bax水平的定量分析,结果显示,与Ctrl -Exo和AMI组相比,Bcl2/Bax蛋白水平显著升高。
图6D:用miR-214OE-Exo或miR-214OE-Exo + MK2206处理NRCMs后,不同组间p-AKT、AKT、Bcl2和Bax水平的定量分析,结果显示,MK2206显著抑制miR-214OE-Exo诱导的p-AKT,且逆转了mir - 214e - exo诱导的BCL2/Bax蛋白水平。
图6E: PTEN 3 ' -UTR中预测的miR-214靶向序列。
图6F: Western blot分析显示给药Ctrl-Exo或miR-214OE-Exo后在HUVECs中PTEN的水平。
图6G:Western blot分析给药Ctrl-Exo或mir - 214ee - exo后在NRCMs中PTEN的水平。
图6H:荧光素酶报告基因实验确认miR-214的靶基因,结果显示,当miR-214-3p mimic与Wt-PTEN共转染时,相对荧光素酶活性降低,而与Mut- PTEN共转染时则没有。
6.miR-214OE-Exo通过靶向PTEN促进迁移、管形成和细胞凋亡抑制
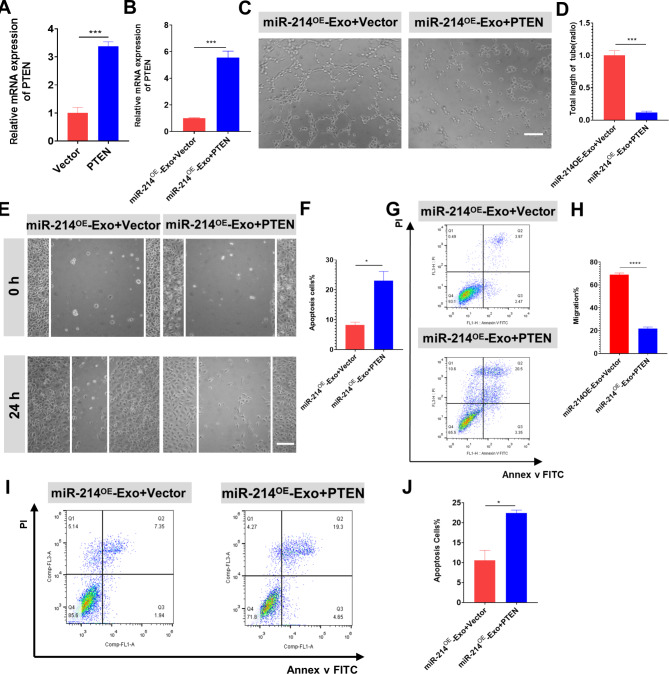
图7A:含载体或PTEN质粒转染HUVECs后PTEN的表达水平。
图7B:转染Vector或PTEN后给药miR-214OE-Exo后HUVECs中PTEN的表达水平,结果表明,与miR-214OE-Exo相比,转染Vector的HUVECs的PTEN表达显著降低。
图7C-D:管形成实验验证PTEN在HUVECs血管生成中的功能作用,结果表明在管形成实验中,PTEN的过表达与miR-214OE-Exo共给药时抑制了血管生成。
图7E-F:划痕实验验证PTEN对HUVECs迁移的功能影响,结果表明,PTEN的过表达消除了miR-214OE-Exo对HUVECs迁移的积极作用。
图7G-H:采用Annexin V/FITC/PI双染色流式细胞术检测转染含Vector或PTEN质粒后给药miR-214OE-Exo的HUVECs的凋亡率,结果显示PTEN的表达可以有效逆转miR-214OE-Exo诱导的抗凋亡保护作用。
图7I-J:采用Annexin V/FITC/PI双染色流式细胞术检测转染含有Vector或PTEN的质粒后给药miR-214OE-Exo的NRCMs的凋亡率,结果显示与miR-214OE-Exo和Vector相比,miR-214OE-Exo和PTEN孵育可以显著降低miR-214OE-Exo在NRCMs中抗凋亡的作用。
结论
本研究表明,miR-214OE-Exo在H/SD下促进HUVECs或NRCMs的迁移,抑制细胞凋亡,改善管状结构的形成。此外,作者发现miR-214OE-Exo在保护心功能和抑制纤维化方面优于Ctrl-Exo。miR-214OE-Exo的保护作用至少部分通过Akt信号通路介导。
目前的研究还存在着一些局限性。首先,使用心肌内注射将外泌体递送到目标部位。但这可能导致心脏损伤和注射外泌体渗漏。其次,miR-214OE-Exo是非靶向性药物,也可以被其他细胞吸收。应探索新的靶向给药方法,以避免这些脱靶效应。第三,PTEN可能不是miR-214OE-Exo调节p-AKT信号通路的wei一受体,在miR-214OE-Exo成为临床有希望的无细胞心脏修复疗法之前,还需要进一步的研究来验证其安全性和有效性。






