研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Mol Cancer】37+,外泌体介导的miR-144-3p通过调节ZEB1促进铁死亡抑制骨肉瘤的增殖、迁移和侵袭
810 人阅读发布时间:2023-10-12 14:30
骨肉瘤(Osteosarcoma, OS)是最常见的骨科恶性肿瘤,预后较差。患者骨肉瘤细胞的高铁吸收率提示铁死亡可能与骨肉瘤的进展有关,但其潜在的分子调控作用尚不清楚。基于与外泌体偶联以靶向传递信号的能力,外泌体衍生的微核糖核酸(miRNAs)有可能作为OS的诊断生物标志物。湾湾今天分享一篇发表在【Mol Cancer】上题为“Exosome-mediated miR-144-3p promotes ferroptosis to inhibit osteosarcoma proliferation, migration, and invasion through regulating ZEB1”的研究。在本研究中,作者以外泌体作为miRNA-144-3p的载体,确定miR-144-3p过表达和敲低在调控铁死亡机制中的作用,探讨miR-144-3p与OS铁死亡相关特征的关系,从而研究其具体机制。

研究结果
1.miR-144-3p作为OS关键调控因子及ZEB1作为miR-144-3p下游靶点的鉴定和验证
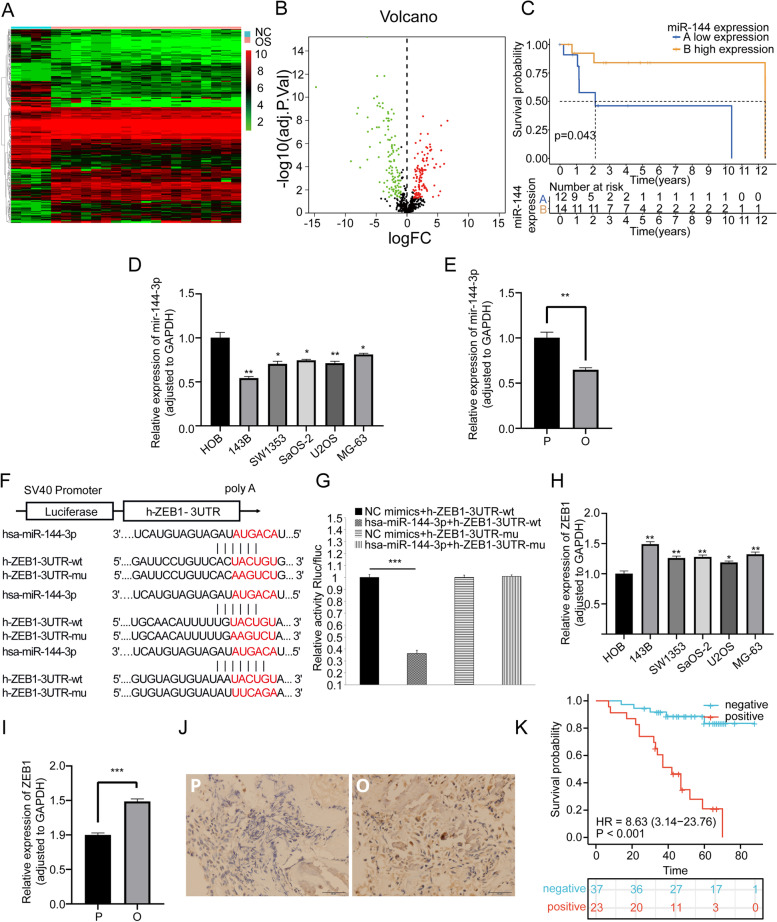
图1A-B:热图和火山图显示基于数据集GSE28425的OS背景下差异表达基因的概况,结果显示miR-144-3p在OS中异常低表达。
图1C:基于miR-144-3p表达水平进行生存分析,结果显示,与miR-144-3p表达水平高的患者相比,miR-144-3p水平低的患者与较差的生存时间密切相关,这表明miR-144-3p是OS有价值的预后生物标志物。
图1D-E:RT-qPCR检测5个OS细胞系和1个成骨细胞系,以及个人OS组织和癌旁组织样本的关键miRNAs,结果证实了miR-144-3p在OS中的下调,表明miR-144-3p可以被认为是OS中的关键调节因子。
图1F :miR-144-3p与ZEB1结合位点序列。
图1G:双荧光素酶测定表明miR-144-3p可以结合ZEB1。
图1H-I:RT-qPCR检测5个OS细胞系和1个成骨细胞系以及1个人OS组织和癌旁组织样本的关键mRNAs,结果显示,ZEB1在OS中异常高表达。
图1J:IHC检测60个组织切片的显微镜拍照结果显示,ZEB1在OS中异常高表达。
图1K:根据60例患者对应组织切片的临床资料绘制ZEB1 Kaplan-Meier图。
2.OS介导的外泌体中miR-144-3p的提取验证及miR-144-3p/ZEB1轴的转染与验证
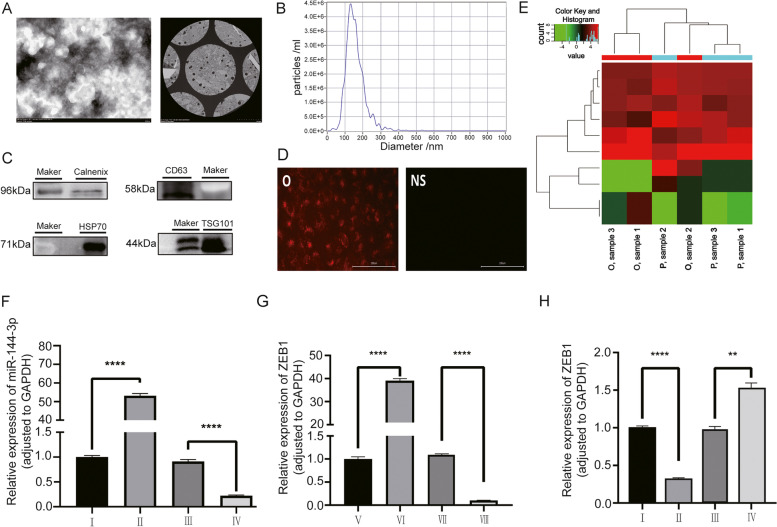
图2A-C:透射电镜检测外泌体的形态图片;NTA检测外泌体的粒径大小和和浓度;Western blot检测外泌体标志物CD63、HSP70、TSG101和calnexin的表达情况,结果均符合外泌体特征。
图2D:共培养实验中,可以在OS细胞中观察到明显的红色荧光染色,证实了外泌体可以作为载体将生物分子运输到细胞中。
图2E外泌体芯片热图显示,与癌旁组织相比,来自人OS组织的外泌体中miR-144-3p的表达显著降低。
图2F-G:RT-qPCR验证I-IV组转染miR-144-3p, V-VIII组转染 ZEB1,结果显示转染效果显著。
图2H:为了验证miR-144-3p对ZEB1的调控作用,通过RT-qPCR检测miR-144-3p过表达组、miR-144-3p敲低组和相应的NC组中ZEB1的表达水平。结果显示,ZEB1的表达与miR-144-3p呈负相关。
3.MiR-144-3p抑制OS增殖、侵袭和迁移
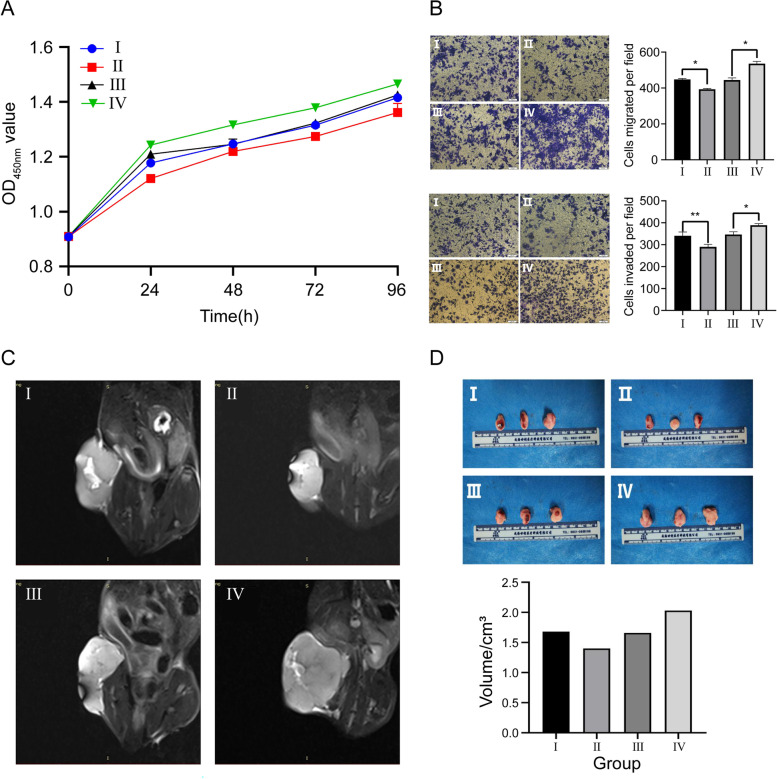
图3A:CCK-8法检测OS细胞的体外生存能力。发现miR-144-3p过表达可导致OS活力水平下降。
图3B:通过transwell实验探讨miR-144-3p对体外OS细胞迁移和侵袭的影响,结果表明h143B细胞中miR-144-3p水平越高,迁移和侵袭倾向越低。
图3C-D:通过MRI评估不同转染组的OS体积,发现miR-144-3p过表达组衍生的OS体积小于相应NC组衍生的OS,这与大体解剖的肿瘤结果相似。
4.MiR-144-3p正调控细胞内铁死亡机制
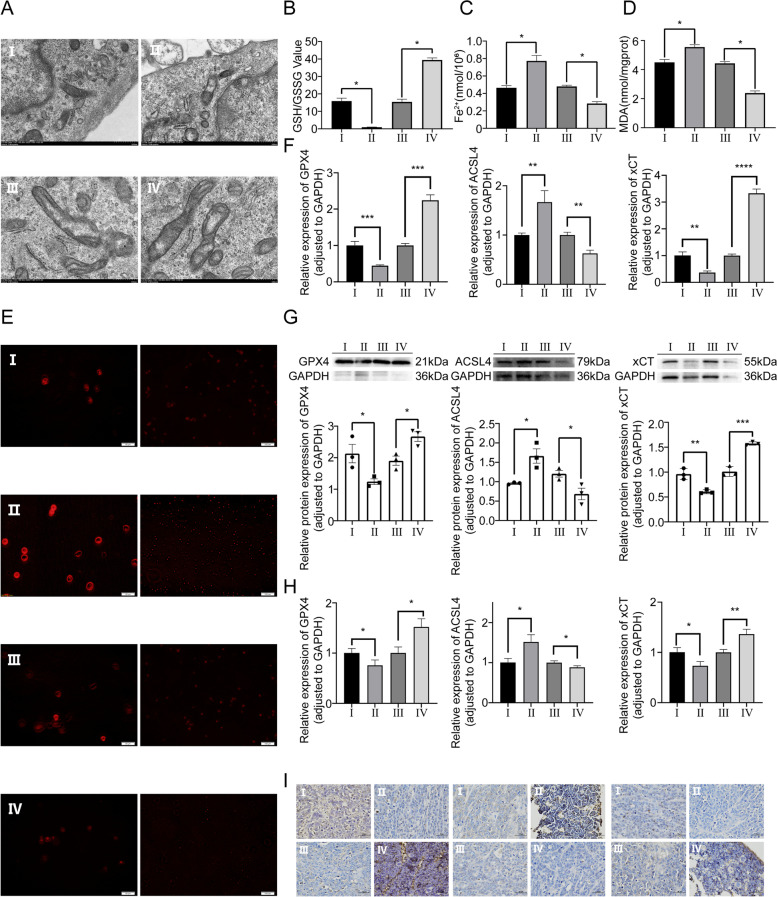
图4A:通过透射电镜观察细胞内形态学改变,结果显示,miR-144-3p水平较高的OS细胞线粒体形态与其他转染组相比,表现出更明显的凋亡相关异常。
图4B:通过GSH实验观察到与相应的NC组相比,过表达miR-144-3p的OS细胞中GSH/GSSG比例较低。
图4C:通过Fe2+水平测定来确定铁转移稳态与miR-144-3p表达之间的关系,结果表明miR-144-3p可以正向调节OS细胞中的Fe2+水平。
图4D:通过MDA实验观察到相对于NC组,miR-144-3p水平升高,OS细胞的相对MDA水平更为突出。
图4E:通过ROS测定OS细胞内的过氧化应激,miR-144-3p可以显著提高细胞内ROS水平。
图4F-G:通过体外实验的RT-qPCR和Western blot检测转染的OS细胞中凋亡相关分子GPX4、ACSL4和xCT的水平。结果显示miR-144-3p的表达与铁死亡分子ACSL4呈正相关,而抗铁死亡分子xCT和GPX4与miR-144-3p的表达水平呈负相关。
图4H-I:通过体内实验的RT-qPCR和IHC检测铁死亡相关分子GPX4、ACSL4和xCT的水平,结果与体外实验一致。
5.ZEB1正调控OS在体内和体外的增殖、迁移和侵袭
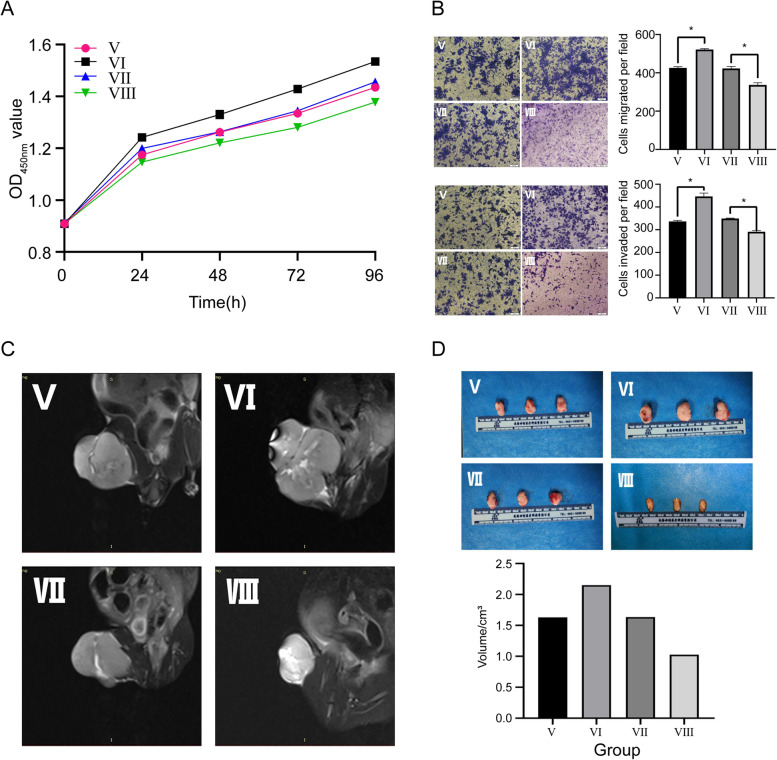
图5A-B:通过CCK-8和transwell检测不同转染组h143B细胞的活力、迁移和侵袭性。结果显示,与NC组相比,ZEB1过表达组OS细胞的活力、迁移和侵袭能力更为突出,表明ZEB1可以正向调节OS细胞的促癌表型。
图5C-D:通过测量基于MRI的体积和基于大体样本的肿瘤大小可以观察到,与匹配的NC组相比,高表达ZEB1的h143B细胞衍生的OS在MRI图像上的体积更突出,大体样本中肿瘤大小更大。
6.ZEB1的表达与细胞内铁死亡水平呈负相关
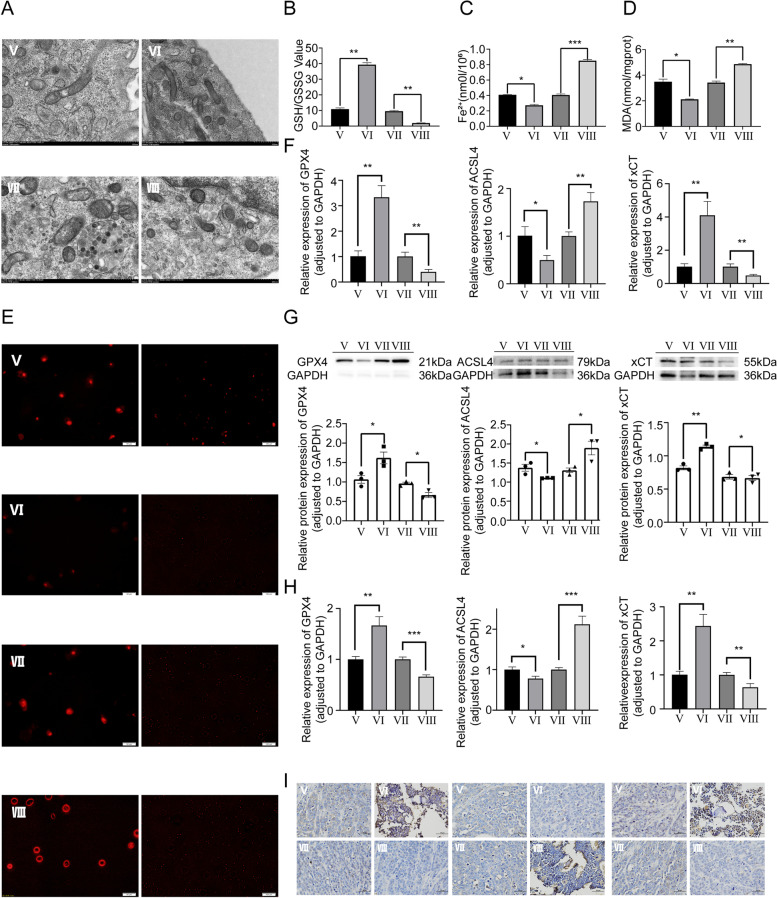
图6A:通过透射电镜观察到,相对于其他转染组,ZEB1敲低组的线粒体发生了更实质性的铁死亡特异性形态学改变。
图6B:通过GSH实验观察结果显示GSH/GSSG比值与ZEB1表达水平呈正相关。
图6C-E:通过Fe2+水平测定、MDA和ROS水平测定,观察到与NC组相比,ZEB1过表达组细胞内上述铁死亡相关指标水平均显著降低,说明ZEB1通过影响谷氨酰胺代谢及Fe2+、MDA和ROS水平抑制铁死亡。
图6F-G:通过体外实验的RT-qPCR和Western blot检测基于不同转染组的OS细胞,对铁死亡相关分子GPX4、ACSL4和xCT水平,结果显示,过表达ZEB1导致ACSL4表达水平降低,xCT和GPX4表达水平升高。
图6H-I:基于CDTX模型体内实验的RT-qPCR和免疫组化实验与上述体外实验一致。
7.ZEB1通过调节铁死亡来缓解miR-144-3p对OS的影响
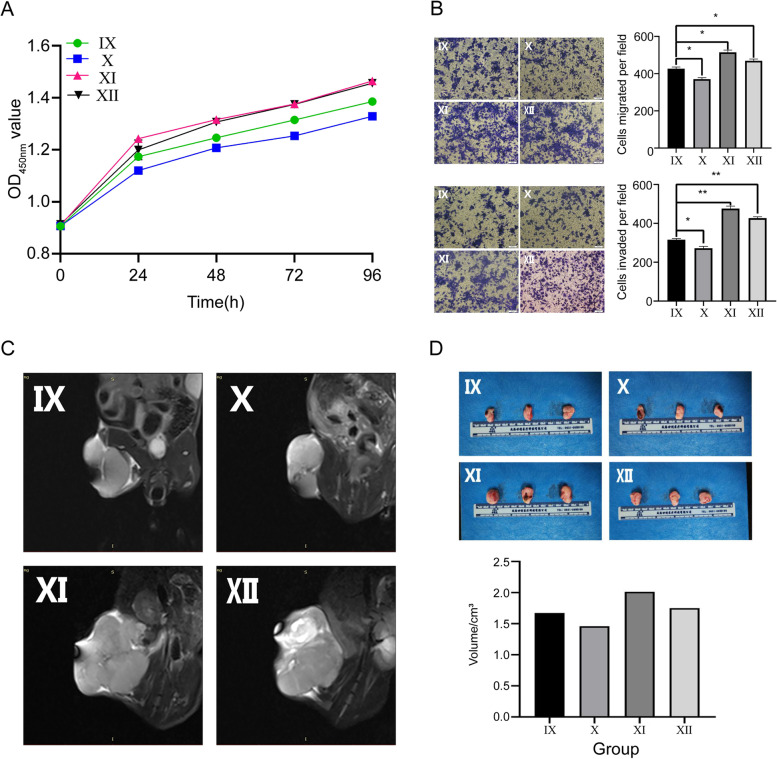
图7 A-B:CCK-8和transwell实验结果表明,过表达ZEB1可以挽救miR-144-3p的抑瘤作用,从而促进OS细胞的增殖、迁移和侵袭倾向。
图7C-D:体内实验表明,miR-144-3p的表达增加可以通过调节ZEB1来抑制OS的生长。
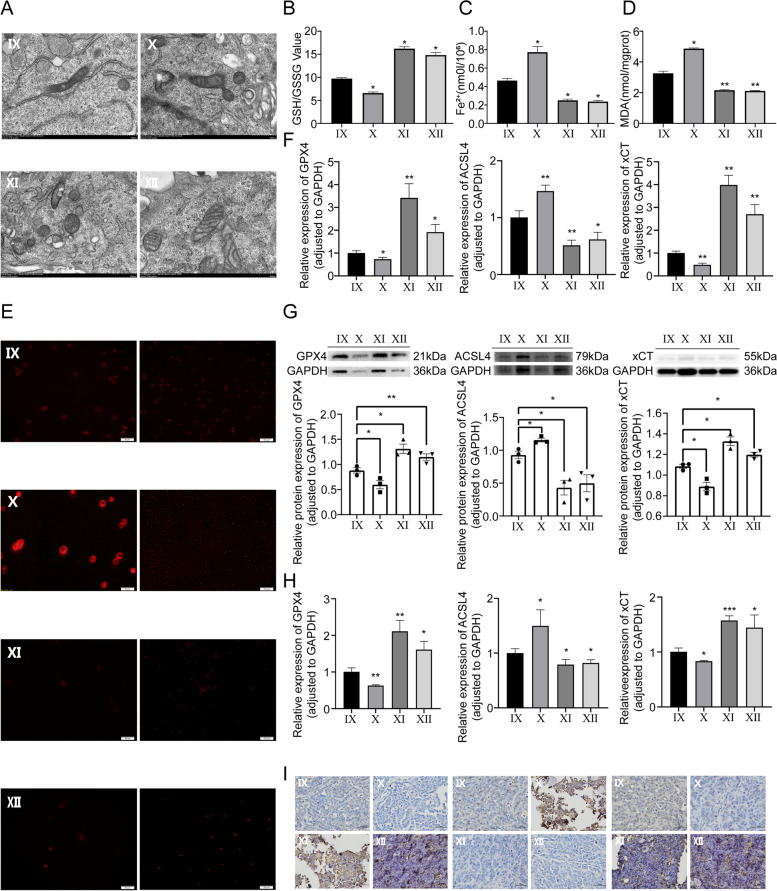
图9A-E:通过透射电镜观察线粒体形态,通过测定细胞内GSH/GSSG比值、Fe2+水平、MDA水平和ROS水平。结果显示,ZEB1可以恢复miR-144-3p对铁凋亡相关通路的作用。
图9F-I:在体外和体内实验中,通过RT-qPCR、Western blot和IHC法检测不同转染组的OS细胞和CDTX组织的铁死亡相关分子GPX4、ACSL4和xCT,结果进一步验证了ZEB1可以通过调节铁死亡来挽救miR-144-3p对OS的影响。
结论
本研究证明,外泌体中的miR-144-3p和ZEB1可以通过调节铁死亡机制来调控OS的发展,并且有以下几个优势:首先,采用CDTX模型进行体内实验,可以对生理状况进行近似模拟,从而得出具有坚实临床价值的结论;其次,从OS组织中提取外泌体进行测序,与血清外泌体相比,来自肿瘤局部组织的外泌体能更准确地反映肿瘤微环境的组成,便于进一步研究肿瘤细胞间的通讯及对周围其他细胞的影响;第三,分别上调和下调miR-144-3p和ZEB1,充分验证了铁死亡的多种可能途径,并进行了功能挽救实验,验证了miR-144-3p/ZEB1轴在铁死亡机制中的作用。综上所述,这些发现有助于进一步了解OS的发病机制,并证实了铁死亡相关miRNAs作为抗癌治疗靶点或诊断生物标志物的潜力巨大。此外,随着研究的深入,外泌体不仅可以作为预后标志物,还可以作为治疗OS的治疗工具,这些都需要不断的研究和探索。






