研载生物科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
一区9分,外泌体circTGFBR2通过增强ATG5介导的保护性自噬促进肝细胞癌的进展
664 人阅读发布时间:2023-10-19 13:39
外泌体在肿瘤细胞和正常细胞之间的通讯中起着重要作用。得益于其稳定的结构,环状rna (circRNAs)被认为在外泌体介导的细胞间通讯中起着重要作用。在一篇发表在【Cell Death&Disease】上的题为“Exosomal circTGFBR2 promotes hepatocellular carcinoma progression via enhancing ATG5 mediated protective autophagy”的研究中,作者观察到来自饥饿应激THLE-2细胞(Exo-Ts)的外泌体可以增强HCC细胞系Hep3B和Huh -7的保护性自噬,因此专门研究了外泌体含量对肝细胞癌进展的影响,并研究了外泌体含量促进HCC进展的调控靶点和机制。为此,作者进一步对THLE-2细胞及其外泌体进行了高通量测序,发现circTGFBR2 在Exo-Ts中显著过表达。通过体外和体内实验进一步证实了circTGFBR2是Exo-Ts增强HCC细胞保护性自噬抵抗饥饿应激的主要因子。在机制上,circTGFBR2经外泌体递送至HCC细胞后,可通过海绵和诱导miR-205-5p的降解,提高自噬相关蛋白ATG5的表达,从而增强ATG5介导的保护性自噬,促进HCC细胞的进展。circTGFBR2/miR-205-5p/ATG5轴可能成为HCC治疗中有希望的治疗靶点。

研究结果
1.来自饥饿应激THLE-2细胞外泌体增强体外HCC细胞的保护性自噬
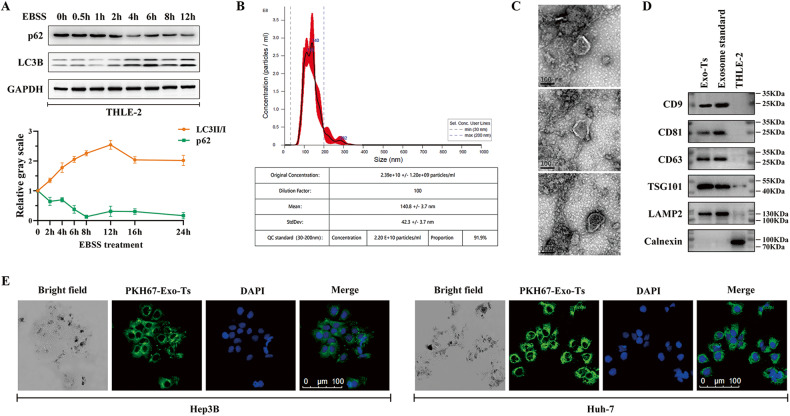
图1A:利用EBSS建立THLE-2细胞饥饿应激模型,并通过western blot检测自噬相关蛋白LC3B和p62来评估细胞的自噬强度
图1B-D:通过外泌体表征鉴定来自饥饿应激THLE-2细胞(Exo-Ts)和正常THLE-2细胞(Exo-T)分泌的外泌体。NTA结果显示粒径大小在30-200nm,透射电镜可观察到典型的外泌体结构,Western blot检测结果显示存在CD9、CD63、CD81、LAMP2和TSG101标志物,不存在calnexin。以上结果均符合外泌体表征,表明从THLE-2细胞系中成功分离到了外泌体(Exo-Ts和Exo-T)。
图1E:PKH67标记Exo-Ts后与Hep3B和Huh-7细胞共培养24h,共聚焦结果显示Hep3B和Huh-7细胞中均捕捉到PKH67的荧光信号,表示外泌体被HCC细胞摄取。
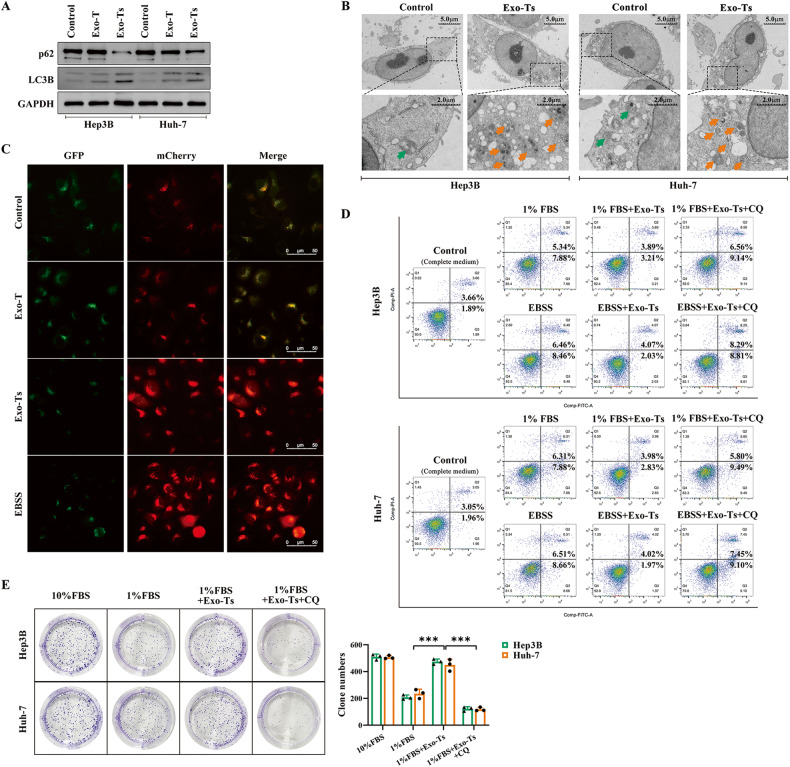
图2A:Western blot分析Hep3B和Huh-7细胞分别与正常THLE-2细胞(Exo-T)和饥饿应激THLE-2细胞(Exo-Ts)衍生的外泌体共培养后LC3B和p62的表达情况。结果显示,与Exo-Ts共培养可显著增加Hep3B和Huh -7细胞的LC3B脂化,减少p62的积累,表明饥饿THLE-2细胞的外泌体能够增强其靶HCC细胞的自噬。
图2B:通过透射电镜观察结果显示,Exo-Ts显著增加了HCC细胞中双膜液泡的数量,达到较高水平,表明细胞自噬被激活。
图2C:通过显微镜观察转染Ad-mCherry-GFP-LC3腺病毒后肝癌细胞的自噬通量,结果显示,与Exo-T相比,Exo-Ts显著增加了Hep3B和Huh-7细胞中黄色(自噬体)和红色(自噬体)点的数量,显示出对自噬的促进作用。
图2D:采用流式细胞术Annexin V PI/FITC检测肝细胞凋亡率。结果表明,Exo-Ts显著减少饥饿应激下Hep3B和Huh-7细胞的凋亡,而氯喹(CQ)逆转了这一现象,显著提高了HCC细胞的凋亡率。
图2E:与Exo-Ts单独或与氯喹(CQ)联合共培养后,通过克隆形成试验评估低血清浓度下HCC细胞的增殖。结果显示,与Exo-Ts共培养的HCC细胞形成的菌落数量明显大于对照组的细胞,而CQ能够逆转Exo-Ts的这种作用。
2.环hsa_circ_0005224在Exo-Ts中显著上调,可能是HCC细胞外泌体增强自噬的原因
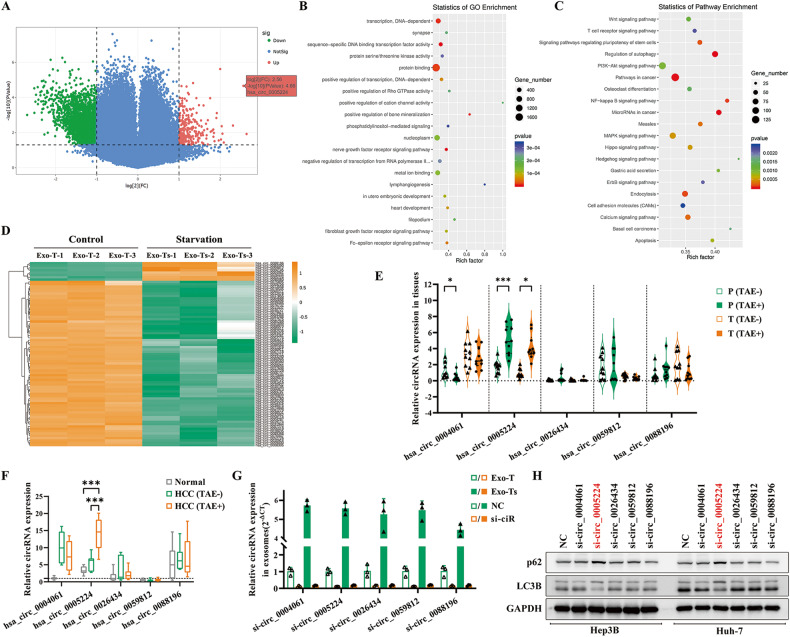
图3A:火山图显示Exo-Ts与Exo-T两组间显著差异表达的circRNAs。
图3B-C:外泌体中差异表达circRNAs的GO和KEGG分析
图3D:层次聚类分析显示,在截断标准|log2FC | > 2.0和P < 0.05下,差异表达的circRNAs。
图3E:采用qRT-PCR检测术前或未术前TAE患者的HCC肿瘤组织和匹配的瘤周肝组织中候选circRNAs的表达。结果表明,术前接受TAE治疗的患者与未接受TAE治疗的患者相比,hsa_circ_0005224在肿瘤组织和瘤周正常组织中的表达均显著上调。
图3F:采用qRT-PCR检测从血液样本中分离的循环外泌体中候选circRNAs的含量。结果显示,HCC (TAE+)组循环外泌体中hsa_circ_0005224 (circTGFBR2)的水平明显高于正常组和HCC (TAE-)组,表明circTGFBR2可能通过外泌体在HCC患者中传播,特别是在接受TAE治疗的HCC患者中传播。
图3G:设计目标circRNAs剪接序列的siRNAs,并将其转染到THLE-2细胞中,采用qRT-PCR检测候选circRNAs在Exo-T和Exo-Ts中的相对表达变化,结果显示外泌体中相应的circRNAs表达显著下调。
图3H:Western blot分析Hep3B和Huh-7细胞与si-ciRs处理的THLE-2细胞外泌体共培养后LC3B和p62的表达情况,检测结果显示,Exo-Ts中hsa_circ_0005224的敲低消除了其增强HCC细胞自噬的能力。
3.Hsa_circ_0005224 (circTGFBR2)是Exo-Ts增强HCC细胞保护性自噬的关键效应载体

图4A:线性TGFBR2产生的反向剪接转录物示意图,Sanger测序进一步验证了连接位点周围的序列与RNA-seq和CircInteractome数据库的结果一致。
图4B:采用qRT-PCR检测circTGFBR2在与Exo-Ts共培养的HCC细胞中的相对表达变化,结果显示,饥饿应激THLE-2细胞中circTGFBR2的相对表达量显著上调,且远高于HCC细胞,而Exo-Ts显著增加了HCC细胞中circTGFBR2的含量。
图4C:采用qRT-PCR法评估RNA对RNase R的抗性,结果表明,circTGFBR2对RNase R的抗性明显高于TGFBR2和GAPDH。
图4D:采用qRT-PCR法评估ActD(1μg/ml)处理后THLE-2细胞中circTGFBR2和TGFBR2的稳定性,结果显示,当将ActD添加到THLE-2细胞中指定的时间段时,circTGFBR2比其线性对应物稳定得多。
图4E:采用circTGFBR2的收敛引物和发散引物进行扩增,琼脂糖凝胶电泳产物显示,circTGFBR2条带仅在cDNA样品中观察到,而在gDNA中未观察到。
图4F:构建包含前后环形框架的circTGFBR2过表达载体(oe-ciR)。在HCC细胞系中进行的qRT-PCR分析表明,oe- ciR可以准确表达circTGFBR2,但不能表达线性TGFBR2。
图4G:western blot评估细胞的自噬状态,结果显示,Hep3B和Huh-7细胞中过表达circTGFBR2可显著增加LC3脂化,降低p62积累,与Exo-Ts共培养相似,表明HCC细胞自噬激活。
图4H:荧光显微镜观察Hep3B细胞自噬情况,测定结果显示,oe-ciR和Exo-Ts均能增加靶细胞中自噬小体(黄色点)和自噬小体(红色点)的数量,表明自噬通量增强。
图4I:流式细胞术检测Hep3B和Huh-7细胞与指定外泌体单独共培养或与e- ciR共转染的凋亡情况,结果显示,肝癌细胞与Exo-Ts共培养或过表达circTGFBR2可显著抑制饥饿应激下的细胞凋亡。
图4J:采用克隆形成实验评估饥饿应激下HCC细胞的增殖能力,结果证实,在低血清浓度下,circTGFBR2在促进肝癌细胞增殖的Exo-Ts中起着至关重要的作用,在HCC细胞中过表达circTGFBR2可显著促进饥饿应激下肝癌细胞的增殖,有效地挽救了Exo-Ts中circTGFBR2缺乏的作用。
4.CircTGFBR2作为miR-205-5p的海绵
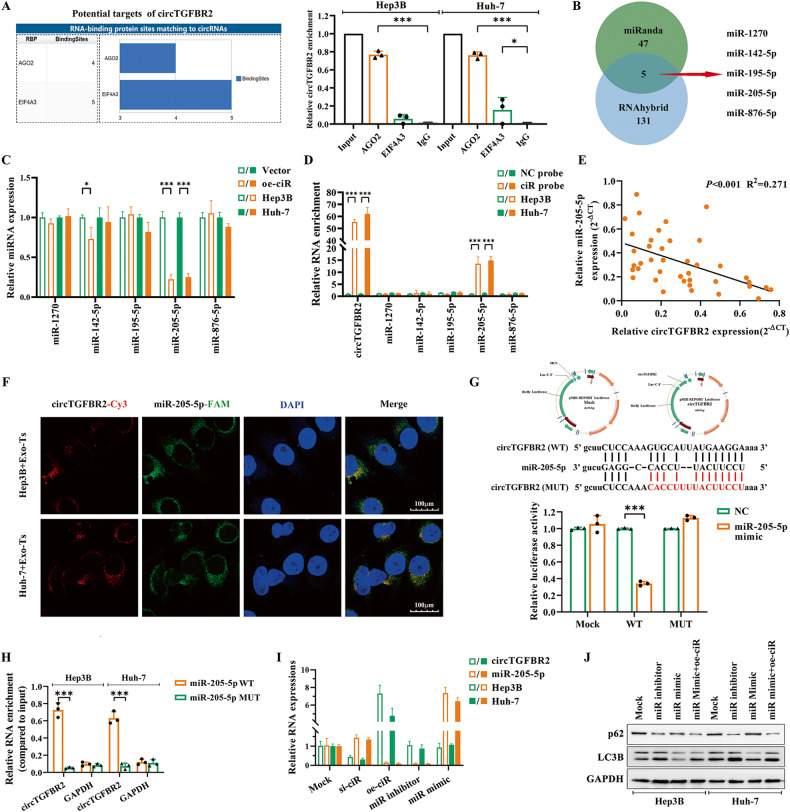
图5A:通过CircInteractome数据库对circTGFBR2与RBPs相互作用进行预测分析,并通过RIP实验验证circTGFBR2与AGO2在HCC细胞中的物理相互作用。结果显示,在AGO2富集的样品中,circTGFBR2的相对水平远高于EIF4A3或IgG富集的样品,这表明circTGFBR2可能通过AGO2蛋白发挥miRNA海绵的作用。
图5B:维恩图显示了从miRanda和RNAhybrid数据库之间的重叠中鉴定出的5个候选miRNAs。
图5C:采用qRT-PCR检测候选miRNAs在HCC细胞中的相对表达量,oe-ciR显著下调miR-205-5p的表达。
图5D:利用横跨circTGFBR2连接位点的反义探针(ciR探针)进行RNA pulldown实验,以确定circTGFBR2与候选miRNAs之间的相互作用。结果证实,miR-205-5p而非其他候选miRNAs在ciR探针的pulldown富集水平上与NC探针相比存在显著差异。
图5E:通过Spearman相关分析,circTGFBR2和miR-205-5p在HCC肿瘤和瘤周正常组织中的表达呈负相关。
图5F:RNA-FISH检测证实了circTGFBR2和miR-205-5p在细胞质中的共定位,表明它们之间存在相互作用。
图5G:双荧光素酶报告试验分析表明,与NC模拟组相比,miR-205-5p模拟物显著降低了circTGFBR2-miR-205-5p野生型组的相对荧光素酶活性,而circTGFBR2-miR-205-5p突变组的荧光素酶活性无显著变化。
图5H:RNA pulldown实验证实,生物素化的miR-205-5p野生型组比其突变型组可以显著富集HCC细胞中过表达的circTGFBR2。
图5I:qRT-PCR结果显示,HCC细胞中miR-205-5p的含量在circTGFBR2过表达或抑制时与circTGFBR2的表达呈负相关,而circTGFBR2的含量与miR-205-5p表达变化无显著相关性。
图5J:western blot评估miR-205-5p在调节HCC细胞自噬中的功能作用,结果显示,HCC细胞的自噬被miR-205-5p inhibitor激活,而被miR-205-5p mimic抑制。
5.外泌体circTGFBR2结合miR-205-5p上调ATG5的转录活性,增强HCC细胞的保护性自噬
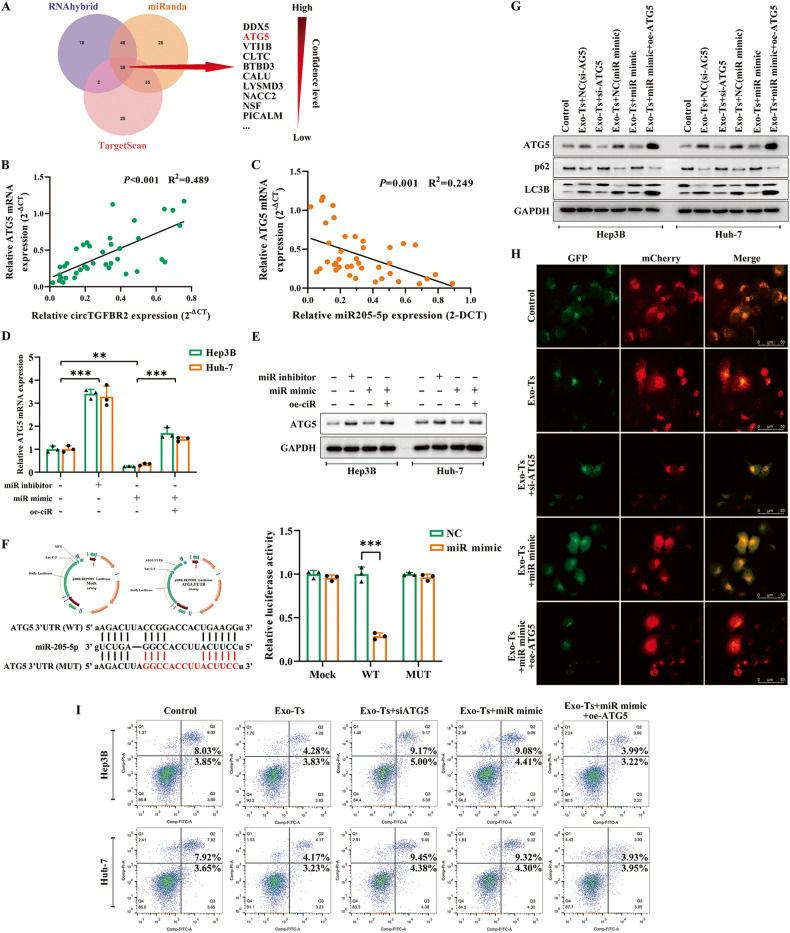
图6A:维恩图显示利用RNAhybrid、miRanda和TargetScan三个数据库预测HCC细胞中miR-205-5p的潜在靶基因,并进一步检测自噬相关的ATG5基因。
图6B-C:通过Spearman相关分析证实HCC肿瘤和瘤周正常组织中circTGFBR2与ATG5 mRNA呈正相关,miR-205-5p与ATG5 mRNA表达呈负相关。
图6D-E:qRT-PCR和western blot检测miR-205-5p对HCC细胞中ATG5转录和翻译的调控作用。结果表明,肝癌细胞中Hep3B和hh -7细胞中ATG5 mRNA和蛋白的表达与miR-205-5p的含量呈负相关,而miR-205-5p模拟物诱导的这种下调可以通过circTGFBR2的过表达而逆转。
图6F:双荧光素酶活性分析结果显示,miR-205-5p mimic和ATG5 3’UTR野生型载体共转染293 T细胞后,荧光素酶的相对活性显著降低,而突变载体不存在,说明miR-205-5p可以直接结合ATG5 3’UTR并抑制其活性。
图6G-H:western blot检测Hep3B和Huh -7细胞中自噬标记蛋白(ATG5、LC3II/I和p62)的水平,荧光显微镜观察Hep3B细胞在指定处理后自噬情况,结果显示,ATG5的敲低阻断了肝癌细胞中Exo -Ts增强的自噬,miR-205-5p mimic也是如此,而ATG5的过表达能够挽救miR-205-5pmimic对Exo -Ts增强的自噬的阻断作用。
图6I:流式细胞术Hep3B和Huh-7细胞在指定处理后的凋亡情况,结果显示,ATG5过表达可以弥补miR-205-5p mimic阻断Exo-Ts的作用,从而增强HCC细胞的饥饿抵抗能力。
6.CircTGFBR2在体内显著促进HCC进展和肿瘤细胞自噬
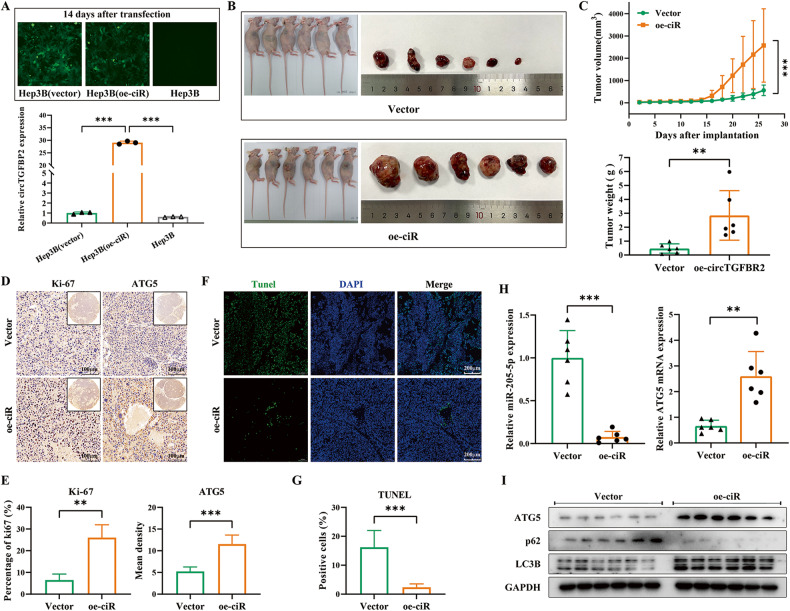
图7A:通过将慢病毒转染Hep3B细胞,构建了稳定过表达circTGFBR2的Hep3B (o-ciR)细胞系。
图7B-C:将Hep3B(oe-ciR)细胞(oe-ciR组)和Hep3B(载体组)细胞(载体组,为阴性对照)皮下注射到BALB/c裸鼠右侧。严密监测小鼠肿瘤生长情况26天后处死,称重肿瘤。结果显示,Hep3B(e- ciR)细胞衍生的肿瘤体积和肿瘤重量均明显大于Hep3B(载体)细胞衍生的肿瘤。
图7D-E:免疫组化染色检测肿瘤组织中Ki-67(以阳性细胞百分比量化)和ATG5(以平均密度量化)的表达。结果显示,oe-ciR组肿瘤组织中Ki-67和ATG5的表达水平显著升高。
图7F-G:通过TUNEL染色检测肿瘤组织中细胞的凋亡情况,结果显示circTGFBR2在HCC中过表达可显著抑制细胞凋亡。
图7H:通过qRT-PCR研究miR-205-5p和ATG5 mRNA表达的含量。结果显示,e-circTGFBR2组的组织中miR-205-5p的表达显著下调,而ATG5 mRNA的表达显著上调。
图7I:通过western blot检测肿瘤组织中ATG5和自噬相关蛋白LC3B、p62表达情况,结果显示,与载体组相比,oe-ciR组的ATG5蛋白表达和自噬水平增加。
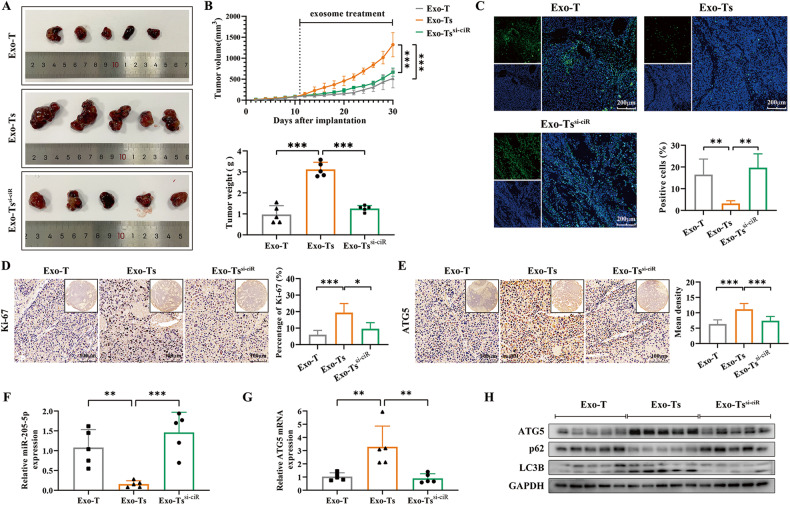
图8A-B:对体内植入Hep3B细胞的小鼠进行腹腔注射外泌体。结果显示,Exo-Ts组的肿瘤生长速度和肿瘤大小明显超过Exo-T组,当Exo-Ts (Exo- Tssi - ciR组)中circTGFBR2被敲低时,这种促进作用就消失了。
图8C-D:通过TUNEL染色和Ki-67 IHC染色,结果显示,Exo-Ts组肿瘤组织的存活和增殖状况明显好于其他两组,表明Exo-Ts可以通过circTGFBR2的递送在体内发挥促肿瘤生长的作用。
图8F-G:采用qRT-PCR检测miR-205-5p和ATG5 mRNA在异种移植肿瘤组织中的表达。结果显示,Exo-Ts组肿瘤组织中miR-205-5p表达下调,但在Exo-Ts中敲低circTGFBR2时,miR-205-5p表达恢复。相应地,注射Exo-Ts后,肿瘤组织中ATG5 mRNA含量显著上调,导致肿瘤组织自噬增强。
图8E、H:通过免疫组化分析异种移植肿瘤组织中ATG5的表达,Western blot分析异种移植肿瘤组织中ATG5和自噬相关蛋白LC3B、p62的表达,结果显示,蛋白水平均上调,导致肿瘤组织自噬增强。
结论
总之,作者的研究结果表明,来自饥饿应激肝细胞的外泌体通过增强保护性自噬诱导HCC细胞对饥饿应激的抵抗。作者还报道了肝细胞外泌体通过外泌体circTGFBR2和circTGFBR2/miR-205-5p/ATG5轴增强HCC细胞保护性自噬的新机制,为肝细胞和HCC细胞之间的串聊提供了新的证据,并为HCC治疗提供了潜在的治疗靶点。






