研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Bioact Mater】18+,经H2S修饰的M2外泌体通过moesin介导的内吞作用促进骨再生
718 人阅读发布时间:2023-10-25 14:21
创伤或肿瘤引起的骨缺损导致患者医疗费用高,生活质量差。基于间充质干细胞(MSCs)的再生医学是一种很有前途的骨再生方法,而局部环境的免疫反应和炎症在骨折的骨再生或愈合中起着关键作用。然而,H2S在外泌体的生物发生和功能中的作用及其对骨再生的影响仍然是未知的。今天湾湾分享的一篇发表在【Bioactive Materials】上题为“M2 exosomes modified by hydrogen sulfide promoted bone regeneration by moesin mediated endocytosis”的研究中,作者使用H2S缓释供体GYY4137刺激巨噬细胞,发现H2S促进M2巨噬细胞极化,促进MSCs体外和体内骨再生。此外,还开发了H2S预处理的M2巨噬细胞外泌体,发现这些外泌体通过重建局部免疫微环境,显著提高了促进颅骨骨缺损骨再生的能力。机械地,H2S处理改变了来自M2巨噬细胞的外泌体的蛋白质谱。H2S刺激显著富集的外泌体蛋白之一moesin蛋白促进外泌体内吞进入MSCs,激活β-catenin信号通路,促进MSCs的成骨分化。综上所述,H2S预处理M2外泌体通过促进MSCs摄取外泌体和激活β-catenin信号通路促进MSCs的骨再生。本研究不仅为促进骨再生提供了新的策略,也为外泌体内化的作用和机制提供了新的见解。

研究结果
1. 1.H2S促进巨噬细胞向M2亚型极化
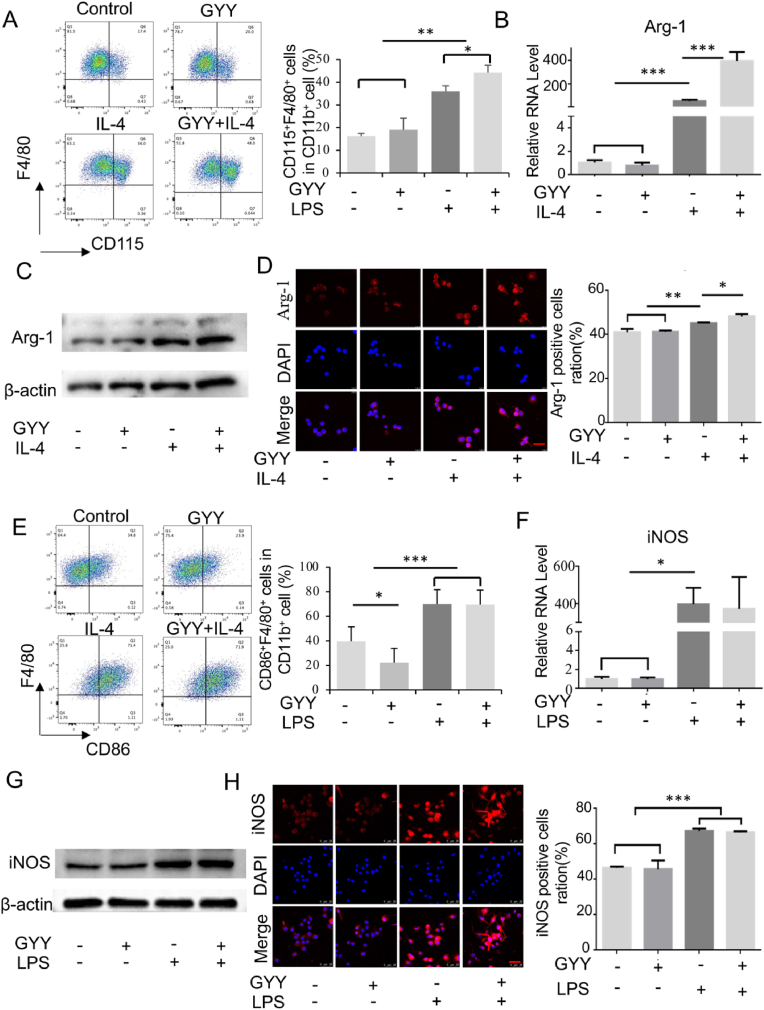
图1A:流式细胞术测定对照组、IL-4 (50 ng/ml)、GYY4137 (50 μM)、IL-4和GYY4137联合处理24h组CD115+F4/80+细胞比例,结果显示,H2S供体GYY4137处理通过增加CD115+F4/80+细胞的比例促进了IL-4诱导条件下M2巨噬细胞的极化。
图1B-D:通过qPCR (B)、western blot (C)和免疫荧光染色(D)检测对照组、IL-4、GYY4137、IL-4和GYY4137联合治疗组中Arg-1的表达情况,结果显示,H2S供体处理增加了Arg-1的表达。
图1E:流式细胞术测定对照组、LPS (50 ng/ml)、GYY4137、LPS与GYY4137联合治疗组CD86+F4/80+细胞比例,结果显示,H2S处理不能改变M1巨噬细胞的极化。
图1F-H:通过qRT-PCR (F)、western blot (G)和免疫荧光染色(H)检测巨噬细胞iNOS在对照组、LPS、GYY4137和LPS与GYY4137联合处理后的表达情况,结果显示,LPS处理能提高iNOS的表达,而H2S处理没有改变iNOS的表达。
以上结果表明,H2S促进巨噬细胞向M2亚型极化,但对M1型巨噬细胞极化无显著影响。
2.H2S刺激巨噬细胞条件培养基促进MSCs成骨分化
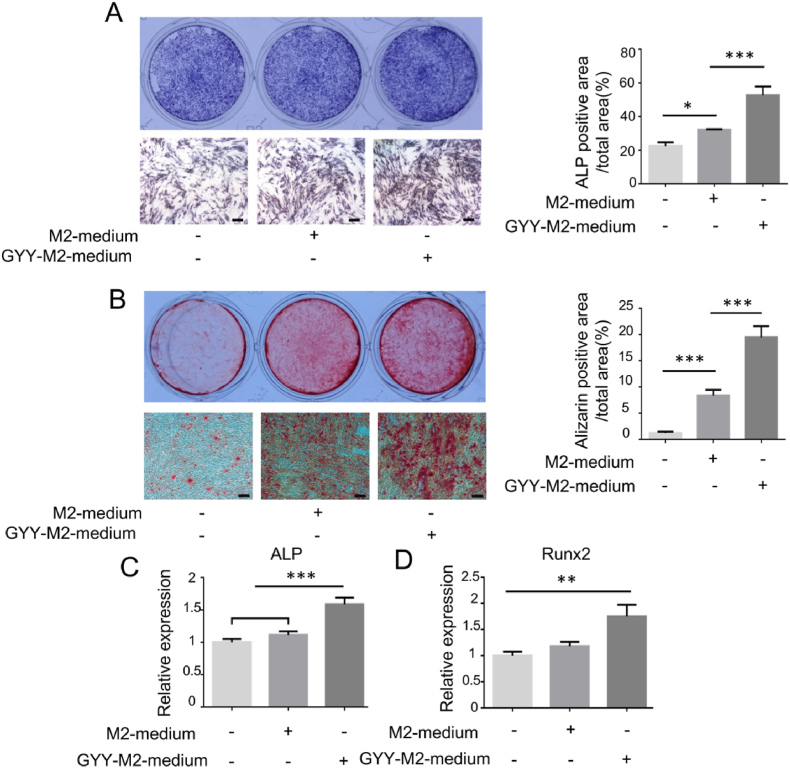
图2A-B:通过碱性磷酸酶染色观察对照组、M2巨噬细胞条件培养基和.H2S预处理M2巨噬细胞条件培养基处理组中ALP阳性的成骨细胞菌落;通过茜素红酯评价M2巨噬细胞条件培养基和H2S预处理的M2巨噬细胞条件培养基处理的MSCs矿化结节形成情况。结果均表明,H2S预处理M2培养基处理后,MSCs的成骨分化增强。
图2C-D:通过qPCR 检测对照组、M2巨噬细胞条件培养基和H2S预处理M2巨噬细胞条件培养基处理组MSCs中ALP和Runx2的表达情况,结果显示,与M2培养基相比,H2S预处理的M2培养基处理后ALP和Runx2的表达显著增加。
以上结果表明H2S调节巨噬细胞旁分泌途径,促进MSCs的成骨分化。
3.H2S处理促进了MSCs的外泌体内吞
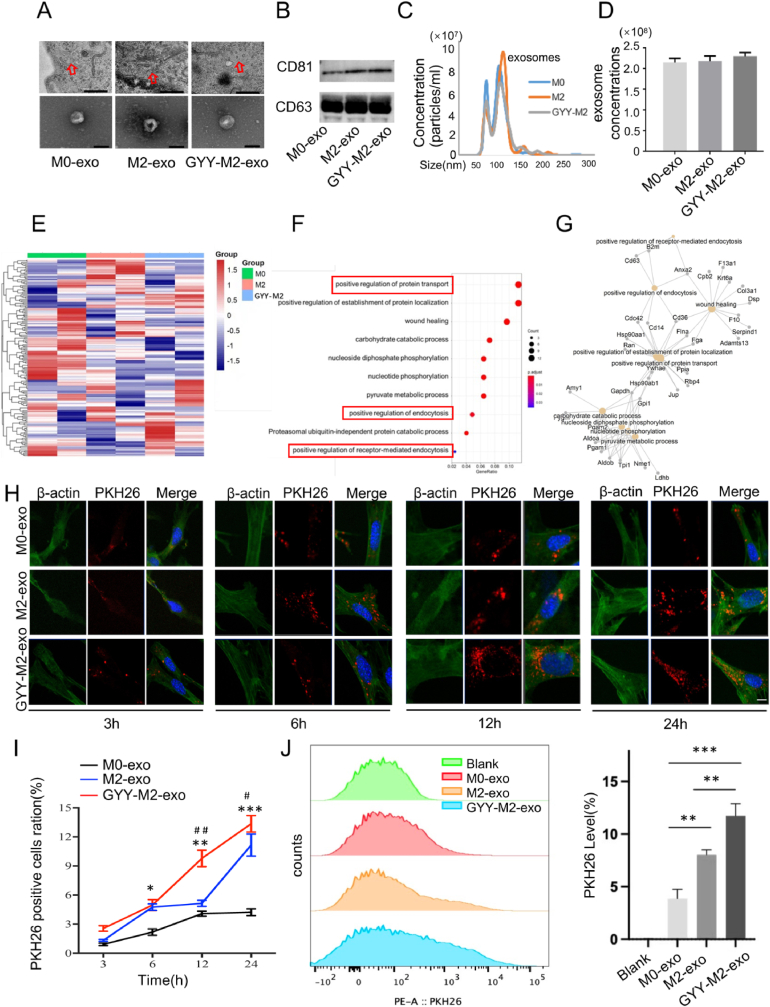
图3A-D:通过纳米颗粒跟踪分析和透射电镜检测 M0、M2和H2S预处理的M2巨噬细胞培养上清纯化的外泌体,Western blot检测外泌体中CD81和CD63的表达,结果显示,不同处理的巨噬细胞衍生的外泌体的数量和直径没有差异。
图3E:利用质谱分析LC-MS分析M0、M2和H2S预处理的M2巨噬细胞外泌体的蛋白质谱,以阐明H2S如何调节外泌体的能力。热图显示了显著的上调和下调蛋白。
图3F-G:利用GO和BP富集分析不同蛋白的功能,结果显示蛋白质转运正调控和内吞作用正调控是前十大富集簇。
图3H-I:免疫荧光染色显示MSCs在3h、6h、12h和24h内吞M0外泌体、M2外泌体和H2S预处理的M2外泌体,结果显示,在H2S预处理组,红色荧光显示的内吞外泌体显著增加,表明H2S促进了MSCs对外泌体的摄取。
图3J:流式细胞术定量测量了12h外泌体的细胞摄取,结果显示MSCs摄取的M2外泌体多于M0外泌体。H2S预处理比M2外泌体更能增强MSCs外泌体的内吞作用。
这些结果表明H2S处理增加了外泌体的内吞作用。
4.H2S预处理外泌体促进间充质干细胞成骨分化
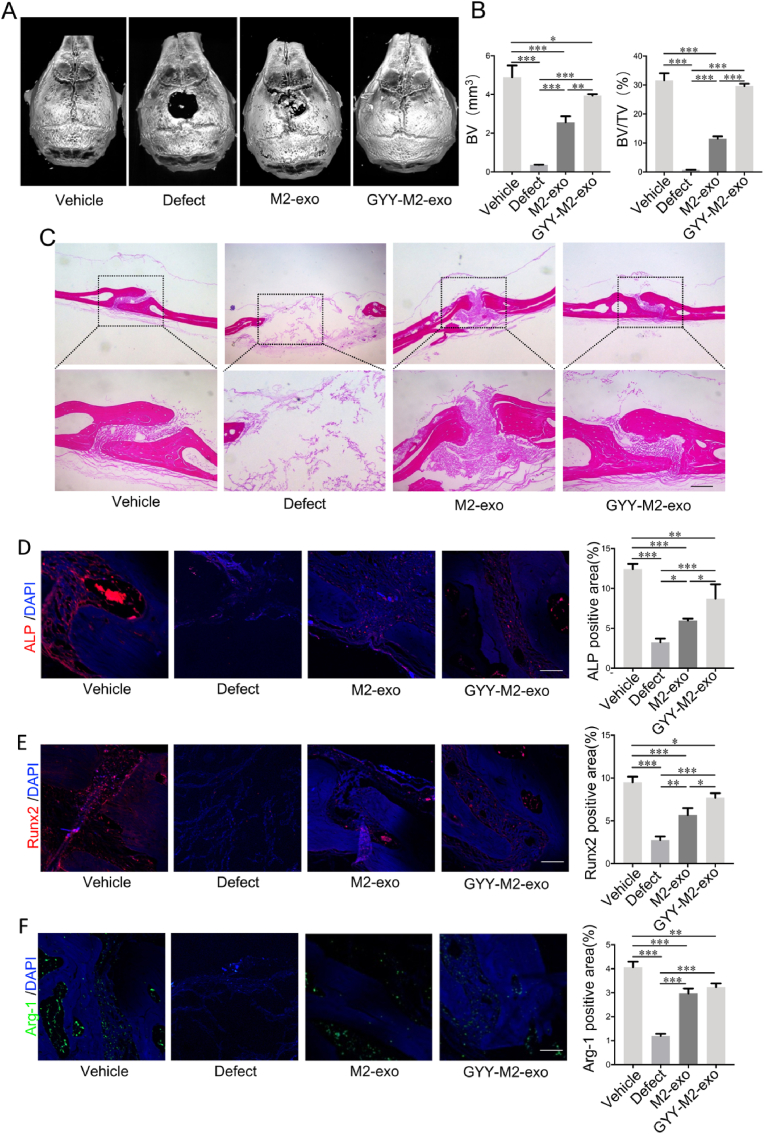
图4A-B:通过ALP染色和茜素红染色评估,H2S预处理的M2外泌体处理组与M2外泌体处理组相比,显示出明显更好的成骨分化能力。
图4C-E:通过qPCR 检测M0巨噬细胞、M2巨噬细胞和H2S预处理M2巨噬细胞外泌体处理MSCs后ALP和Runx2的表达。结果显示,与M2外泌体处理组相比,H2S预处理M2外泌体处理后MSCs中ALP和Runx2的表达显著升高。
图4F: HE染色显示M0巨噬细胞、M2巨噬细胞和H2S预处理M2巨噬细胞处理组外泌体处理后MSCs骨形成情况(上图)。免疫组化染色显示各组外泌体中Arg-1阳性细胞数量(下图)。结果显示,与对照组相比,M2外泌体处理组新生骨形成更多。此外,与M2外泌体处理相比,H2S预处理显著促进了新骨形成,H2S预处理-M2外泌体处理组骨组织形成区Arg-1阳性M2巨噬细胞更多。
图4G-H:免疫荧光染色观察ALP和Runx2的表达,结果显示,H2S预处理- M2外泌体处理组在新骨形成区检测到更多ALP和Runx2阳性细胞。
5.H2S预处理外泌体促进颅骨骨缺损再生

图5A-B:通过Micro-CT分析载体、骨缺损、M2外泌体和H2S修饰M2外泌体处理组颅骨骨形态。结果显示,H2S预处理的M2外泌体组颅骨骨缺损再生明显优于M2外泌体组。
图5C:通过HE染色评价载体、缺损、M2外泌体和H2S修饰M2外泌体处理组颅骨骨组织结构,结果显示,H2S预处理M2外泌体组颅骨骨结构与M2外泌体组相比更规整,与天然骨相似。
图5D-F:通过免疫荧光染色评价载体、缺损、M2外泌体和H2S修饰M2外泌体处理组骨再生区ALP、Runx2和Arg-1阳性细胞的富集情况。结果显示,H2S预处理M2外泌体组ALP和Runx2的表达也明显高于M2外泌体组。H2S预处理M2外泌体组骨再生区富集的Arg-1阳性巨噬细胞比M2外泌体组多。
这些结果证实了H2S预处理外泌体促进骨再生的作用。
6.H2S促进外泌体蛋白moesin的富集及外泌体中Moesin蛋白促进间充质干细胞成骨分化
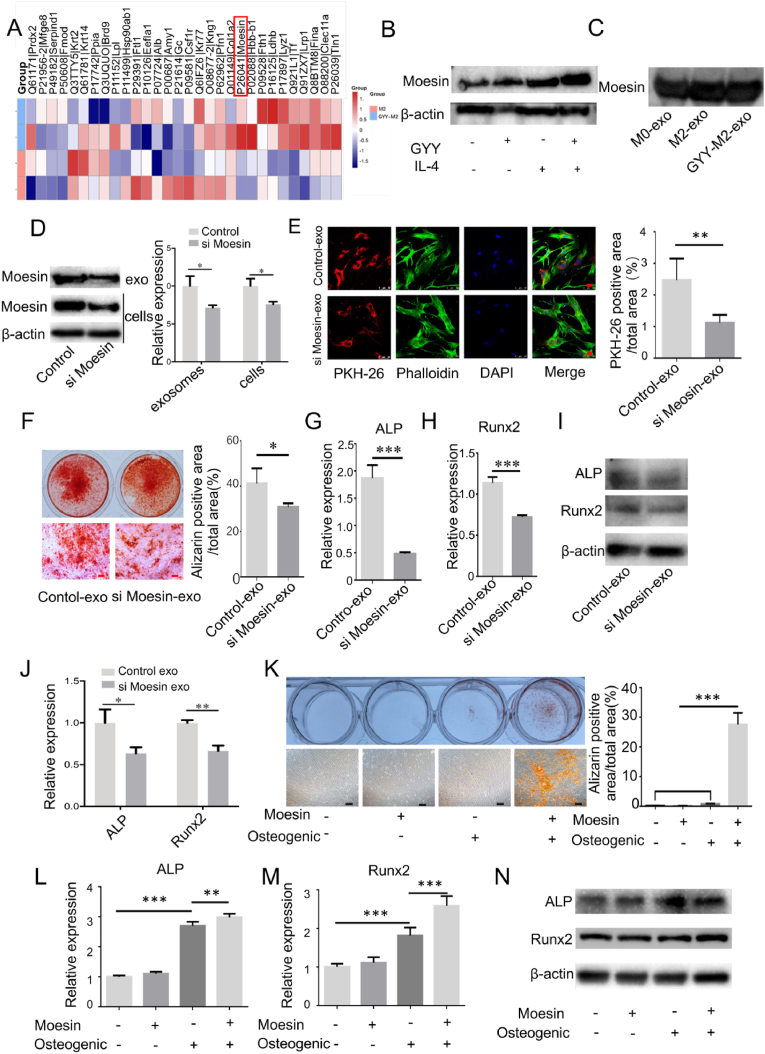
图6A:通过LC-MS分析M2外泌体与H2S预处理的M2外泌体差异蛋白。结果显示,与M2外泌体相比,moesin蛋白是H2S预处理的M2外泌体中富集程度最高的蛋白之一。
图6B-C:通过western blot检测M0、M2和H2S预处理的M2巨噬细胞外泌体中moesin的表达。结果显示,H2S处理促进了巨噬细胞及其外泌体中moesin的表达。
图6D:通过western blot检测有或没有moesin siRNA处理的巨噬细胞和外泌体中meosin的表达。结果显示,siRNA处理的巨噬细胞及其外泌体中moesin蛋白水平显著降低。
图6E:通过免疫荧光染色分析转染或不转染moesin siRNA的巨噬细胞外泌体的内吞作用。结果显示,敲除moesin后,外泌体对MSCs的内吞作用明显减少。
图6F:观察对照或moesin siRNA预处理外泌体刺激MSCs矿化结节形成。通过茜素红S染色结果显示,moesin siRNA处理后外泌体促进MSCs骨再生的能力被抑制。
图6G-J:通过qPCR 分析和western blot检测对照或moesin siRNA预处理外泌体刺激MSCs中ALP和Runx2的表达。结果显示,在moesin siRNA处理组衍生的外泌体中,成骨相关标志物ALP和Runx2的表达也下降。
图6K:观察添加或不添加moesin蛋白处理的MSCs矿化结节形成。通过ALP活性和茜素红染色结果显示,moesin蛋白处理后MSCs的成骨分化增强。
图6L-N:通过qPCR 和western blot检测转染或不转染moesin蛋白的MSCs中ALP和Runx2的表达。结果显示,moesin蛋白处理后,成骨相关标志物ALP和Runx2的表达也增加。
这些结果表明H2S促进巨噬细胞外泌体中moesin蛋白的富集,促进MSCs内吞外泌体,从而促进MSCs的成骨分化。表明moesin蛋白是M2外泌体促进骨再生的介质之一。
7.Moesin激活MSCs中β-catenin信号通路
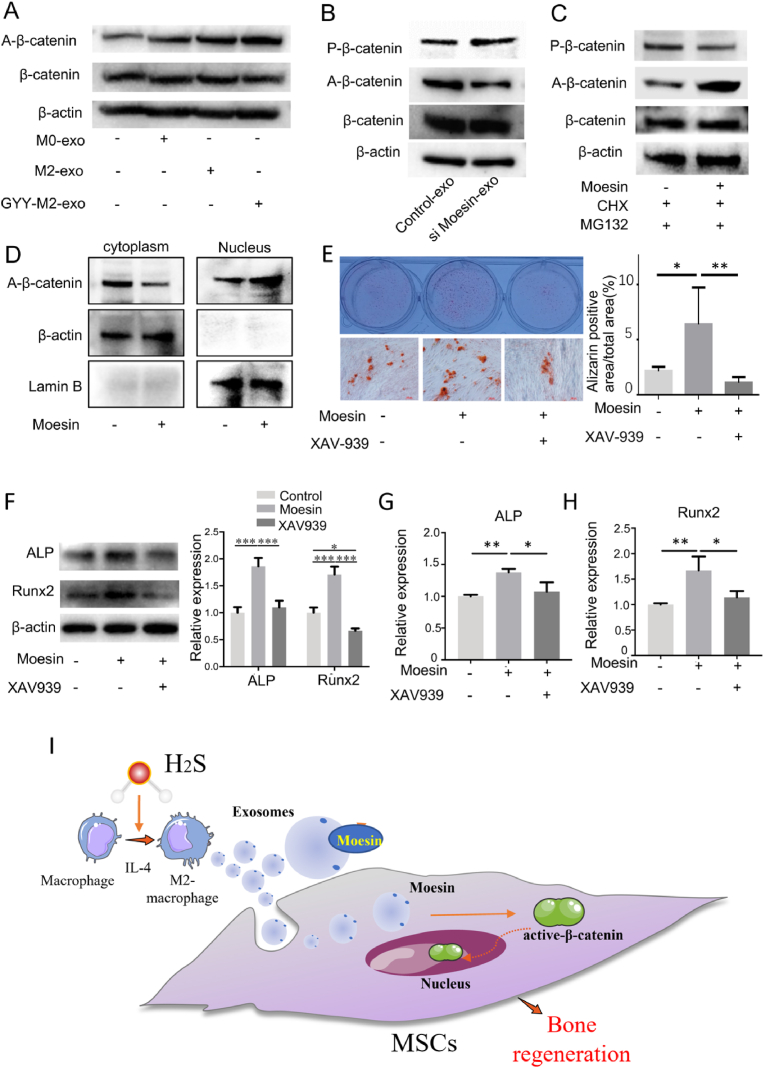
图7A:通过western blot检测β-catenin和活性β-catenin在M0、M2和H2S预处理的M2巨噬细胞外泌体处理的对照MSCs中的表达,结果显示,H2S预处理的M2外泌体促进了MSCs中活性β-catenin的表达。
图7B:通过western blot检测β-catenin和活性β-catenin在对照MSCs或moesin siRNA预处理的外泌体处理MSCs中的表达,结果显示,与对照外泌体处理相比,moesin siRNA处理巨噬细胞衍生的外泌体降低了MSCs中活性β-catenin的表达。
图7C:通过western blot检测CHX 处理10h, MG132处理2h后,对照组和moesin组p-β-catenin、active-β-catenin和β-catenin的蛋白水平,结果显示,moesin通过抑制p-β-catenin促进active-β-catenin的表达。
图7D:通过western blot检测有或没有meosin处理的细胞质和细胞核中active-β-catenin的表达,结果显示,moesin促进了active-β-catenin的核易位。
图7E:矿化结节形成对照,由moesin加或不加XAV-939 (3 μM)处理组刺激。
图7F-H:通过qPCR 分析和western blot检测加或不加XAV-939处理组moesin刺激对照MSCs中ALP和Runx2的表达。
图7I:图式显示H2S通过提高外泌体蛋白moesin水平促进M2巨噬细胞极化,从而促进MSCs对外泌体的摄取。由此可见,H2S预处理的M2巨噬细胞外泌体通过激活β-catenin信号通路促进MSCs骨再生。
结论
总之,作者发现H2S通过操纵M2巨噬细胞外泌体的蛋白质谱来促进M2巨噬细胞极化。富集的M2巨噬细胞外泌体蛋白moesin促进MSCs摄取外泌体,通过β-catenin信号通路促进MSC骨再生。该研究为修饰外泌体促进骨再生和组织工程提供了一种新的策略。






