研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Nanobiotechnology】10+,源自皮下脂肪间充质干细胞的工程外泌体作为miR-199a-3p在骨关节炎中的传递载体促进软骨修复
1435 人阅读发布时间:2023-11-13 09:01

骨关节炎(OA)是一种涉及软骨的退行性关节疾病。来自间充质干细胞(MSCs)的外泌体治疗改善了关节软骨的修复,但皮下脂肪(SC)基质细胞来源的外泌体(MSCsSC-Exos),特别是用于药物递送的工程MSCsSC-Exos在OA治疗中很少报道。湾湾今天分享的是发表在【Journal of Nanobiotechnology】上题为“Engineering exosomes derived from subcutaneous fat MSCs specially promote cartilage repair as miR-199a-3p delivery vehicles in Osteoarthritis”的研究,该研究的目的是阐明MSCsSC-Exos对软骨修复的潜在机制,以及工程MSCsSC-Exos对OA药物输送的治疗作用。
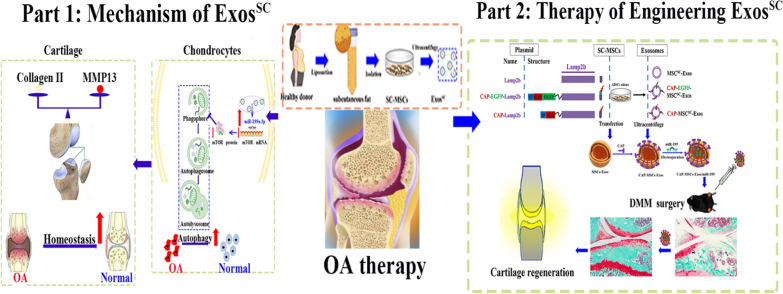
在本研究中,作者旨在探索sc来源的MSCs-Exos对更能代表人类OA的内侧半月板失稳和前交叉韧带横断诱导的OA疾病的治疗潜力,并检验MSCs-Exos向软骨细胞传递miRNA是否在软骨损伤中发挥重要作用。研究结果表明,在OA大鼠模型中,MSCsSC-Exos可以通过mir -199a-3p介导的mtor自噬途径改善软骨病理严重程度。此外,为了获得对损伤软骨的优越治疗效果,设计了来自MSCsSC的工程外泌体,将软骨细胞结合肽CAP与外泌体膜蛋白Lamp 2b融合,以实现miR-199a-3p的软骨靶向递送。关节内注射装载miR-199a-3p的软骨细胞靶向MSCsSC-Exos在DMM诱导的OA小鼠中出现了显著的软骨再生。综上所述,基于MSCsSC衍生的工程外泌体的有价值且高效的无细胞疗法被强烈推荐用于软骨再生和OA治疗。
1. MSCsSC及其衍生外泌体的分离鉴定
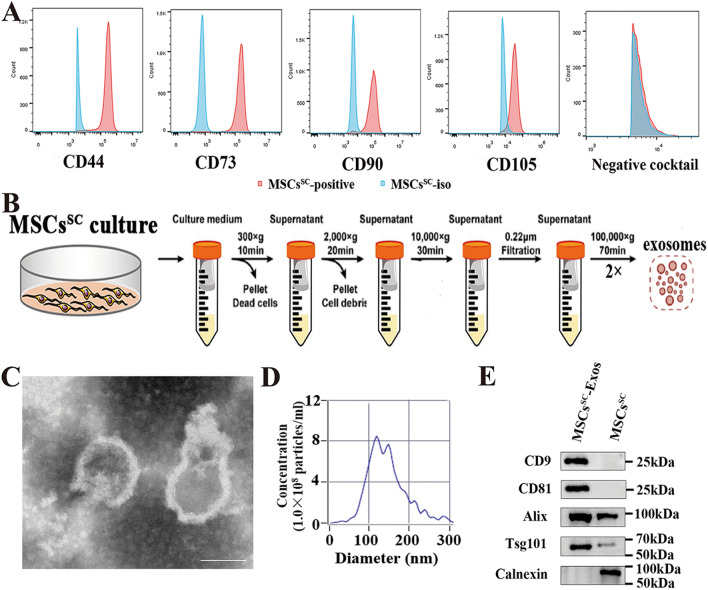
图1A:流式细胞术分析P4-ADSCs中MSCsSC标记物,红色实线代表测量的表面标记物,蓝色实线代表同型对照。
图1B:差速离心分离MSCsSC-Exos示意图。
图1C:透射电镜(TEM)分析MSCsSC-Exos的形态(比尺:100 nm)。
图1D:纳米颗粒跟踪分析(NTA)用于测量MSCsSC-Exos的大小分布和浓度。
图1E:Western blot分析MSCsSC- exos和MSCsSC中CD9、CD81、Alix、Tsg101和Calnexin的表达。
以上结果表明,分离得到的MSCsSC-EVs能够满足外泌体形态、浓度、大小分布和蛋白标记的要求,是高度定量的MSCsSC-Exos。
2. MSCsSC-Exos修复骨性关节炎大鼠关节软骨损伤
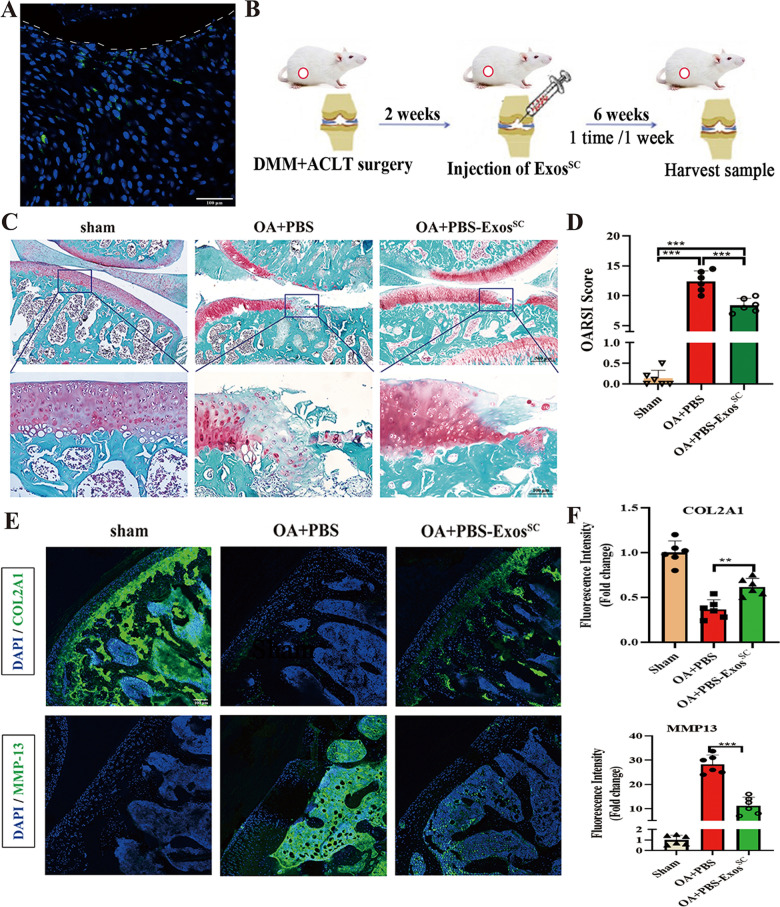
图2A:受损软骨拍摄了DIO标记的MSCsSC-Exos的代表性图像。白色虚线表示关节面,绿色圆点表示DIO标记的MSCsSC-Exos。
图2B: OA大鼠MSCsSC-Exos治疗策略示意图。
图2C:各组大鼠软骨形态红花素O/快绿染色。
图2D : OARSI评分系统量化软骨破坏的严重程度。
图2E-F :OA大鼠关节软骨组织COL2A1和MMP-13的免疫荧光分析。
以上结果表明MSCsSC-Exos可以进入关节软骨损伤区域,促进软骨修复和ECM合成,修复OA大鼠软骨破坏。
3. MSCsSC-Exos通过介导OA大鼠的自噬来预防软骨破坏
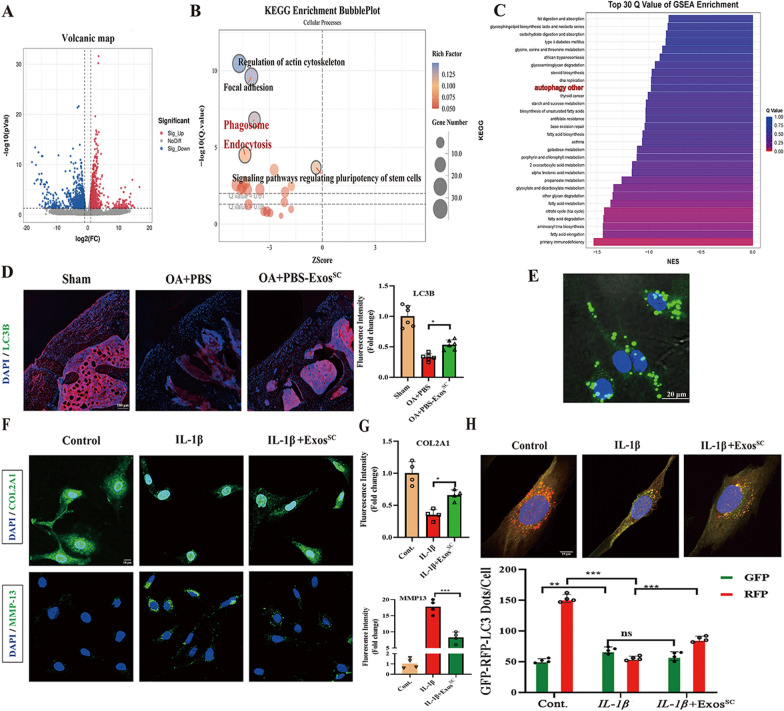
图3A:对照组(pbs处理,n = 2)和MSCsSC-Exos组(ExosSC处理,n = 2) OA大鼠软骨总mRNA进行RNA-Seq分析,得到对照组和ExosSC组不同表达基因(DEGs)的火山图谱。红色点代表上调基因,蓝色点代表下调基因。
图3B:KEGG。
图3C:GSEA富集分析。
图3D:OA大鼠关节软骨组织LC3B的免疫荧光分析。
图3E:DIO标记的ExosSC被大鼠软骨细胞吸收的代表性图像。
图3F-G:OA模型软骨细胞COL2A1和MMP-13的免疫荧光分析。
图3H:用RFP-GFP-LC3腺病毒感染大鼠软骨细胞,观察ExosSC对RFP-GFP-LC3斑点的影响。计算每个细胞中RFP-和GFP-LC3点的数量。
以上结果表明,MSCsSC-Exos治疗增强自噬过程可能是OA模型中受损软骨得到治疗的关键原因。
4.MSCsSC-Exos通过抑制mTOR表达上调自噬过程
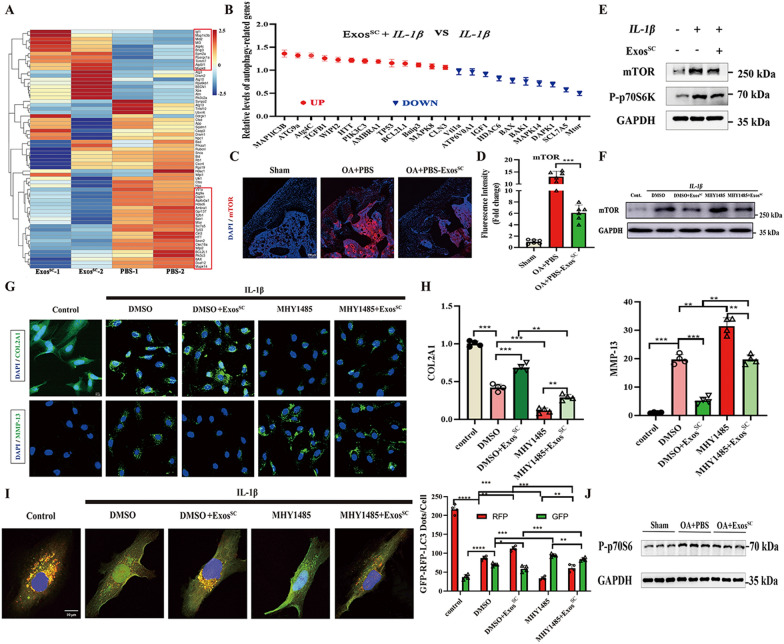
图4A:热图显示经MSCsSC-Exos或PBS处理的OA软骨中差异表达基因的分层簇。
图4B:通过qRT-PCR检测IL-1β和MSCsSC-Exos处理的原代软骨细胞中自噬相关基因的相对表达水平。
图4C-D:OA大鼠关节软骨mTOR的免疫荧光分析。
图4E:western blotting检测IL-1β和MSCsSC-Exos处理的软骨细胞中mTOR和P-p70s6蛋白水平。
图4F:western blotting检测IL-1β、MSCsSC-Exos和MHY1485处理的软骨细胞中mTOR蛋白水平。
图4G-H:经MHY1485处理的OA软骨细胞中COL2A1和MMP-13的免疫荧光分析。
图4I:大鼠软骨细胞感染RFP-GFP-LC3腺病毒及MHY1485对RFP-GFP-LC3斑点的影响。计算每个细胞中RFP-和GFP-LC3点的数量。。
图4J:western blot法检测OA大鼠关节软骨组织中P-p7056蛋白表达水平。
以上结果表明,MSCsSC-Exos通过抑制mTOR信号通路,增强OA软骨和软骨细胞的自噬水平,从而保护OA微环境中的软骨。
5.MSCsSC-Exos转染miR-199a-3p可降低OA模型中mTOR的表达
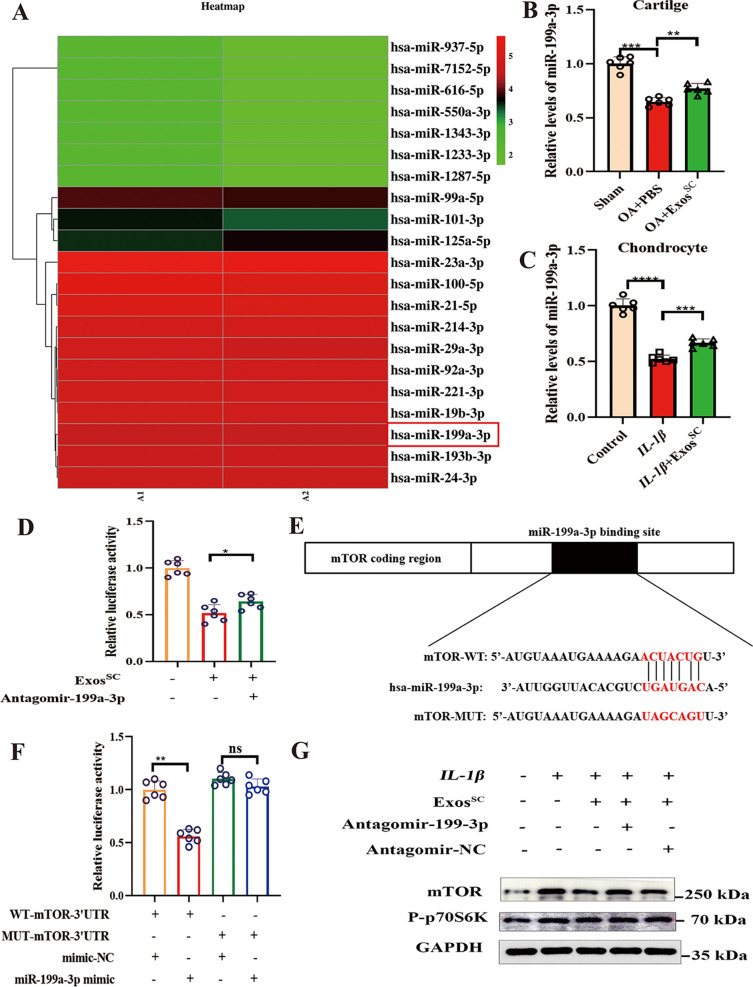
图5A:热图显示了MSCsSC-Exos中差异miRNA表达的分层簇。
图5B:RT-PCR检测miR-199a-3p在MSCsSC-Exos处理的OA软骨中的相对表达量。
图5C:qRT-PCR检测miR-199a-3p在MSCsSC-Exos处理的软骨细胞中的相对表达。
图5D:MSCsSC-Exos和antagomiR-199a-3p对IL -1β诱导的软骨细胞荧光素酶活性的影响。
图5E:mTOR mRNA 3′UTR中miR-199a-3p的预测结合位点示意图,以及mTOR 3′UTR突变体。
图5F:采用双荧光素酶报告系统测定荧光素酶活性。
图5G:western blot检测mTOR和p-p7056蛋白水平。
以上结果表明MSCsSC-Exos下调mTOR表达水平和mTOR信号通路,高度依赖于外泌体miR-199a-3p。
6.AntagomiR-199a-3p消除了MSCsSC-Exos对受损软骨的治疗作用
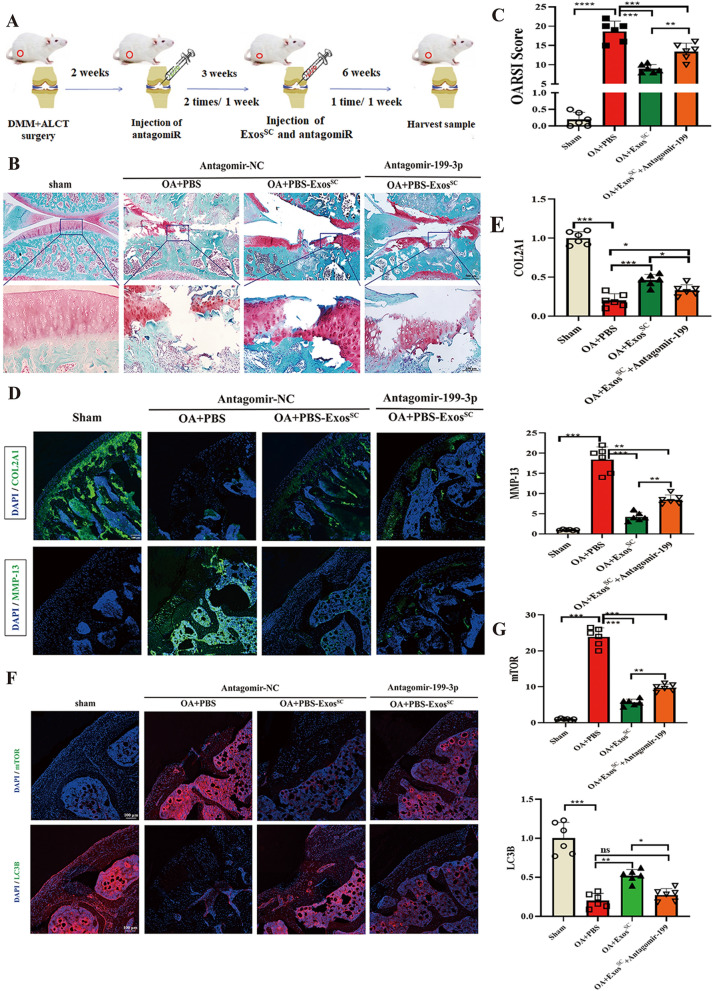
图6A:antagomiR-199a-3p和MSCsSC-Exos对OA大鼠的治疗策略示意图。
图6B:各组大鼠软骨形态红素O/快速绿色染色
图6C:OARSI评分系统量化软骨破坏的严重程度。
图6D-E:骨性关节炎大鼠关节软骨COL2A1和MMP-13免疫荧光分析。
图6F-G:骨性关节炎大鼠关节软骨mTOR和LC3B的免疫荧光分析。
7. 工程化的MSCsSC-Exos介导miR-199a-3p向体外软骨细胞的传递
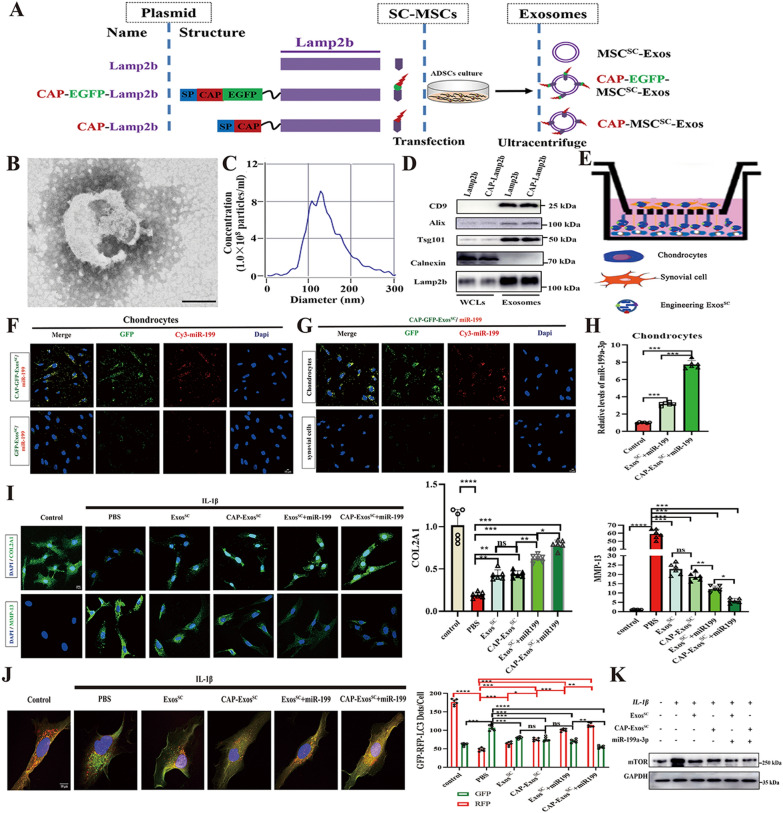
图7A:包含Lamp2b、CAP-EGFP-Lamp2b和CAP-Lamp2b的质粒构建体以及源自MSCsSC的工程外泌体示意图。
图7B:透射电镜(TEM)分析了CAP-MSCsSC-Exos的形态。
图7C:纳米颗粒跟踪分析(NTA)用于测量CAP-MSCsSC-Exos的大小分布和浓度。
图7D:Western blot分析全细胞裂解物(WCLs)和纯化外泌体(包括CAP-MSCsSC-Exos和MSCsSC-Exos)中的蛋白标记CD9、CD81、Alix、Tsg101和Calnexin。
图7E:大鼠软骨细胞和滑膜细胞共培养实验示意图。
图7F:通过CAP-EGFP-MSCsSC-Exos将miR-199a-3p高效递送至软骨细胞。
图7G:CAP-EGFP-MSCsSC-Exos特异性递送至软骨细胞而非滑膜细胞。
图7H:通过RT-PCR检测不同MSCsSC-Exos递送系统处理的软骨细胞中miR-199a-3p的相对表达。
图7I:不同MSCsSC-Exos给药系统处理OA模型软骨细胞COL2A1和MMP-13的免疫荧光分析。每组N = 6。
图7J:研究了RFP-GFP-LC3腺病毒感染大鼠软骨细胞及不同MSCsSC-Exos递送系统对RFP-GFP-LC3点的影响。计算每个细胞中RFP-和GFP-LC3点的数量。每组N = 6。
图7K:western blot检测不同MSCsSC-Exos给药系统处理OA模型软骨细胞mTOR蛋白水平。
以上结果表明,在CAP信号肽的引导下,MSCsSC的工程外泌体显著提高了外泌体miR-199a-3p对软骨细胞的递送效率,并显示出软骨细胞自噬的增强,从而在OA细胞模型中具有治疗潜力。
8.在体内通过工程MSCsSC-Exos介导软骨靶向miR-199a-3p的无细胞OA治疗
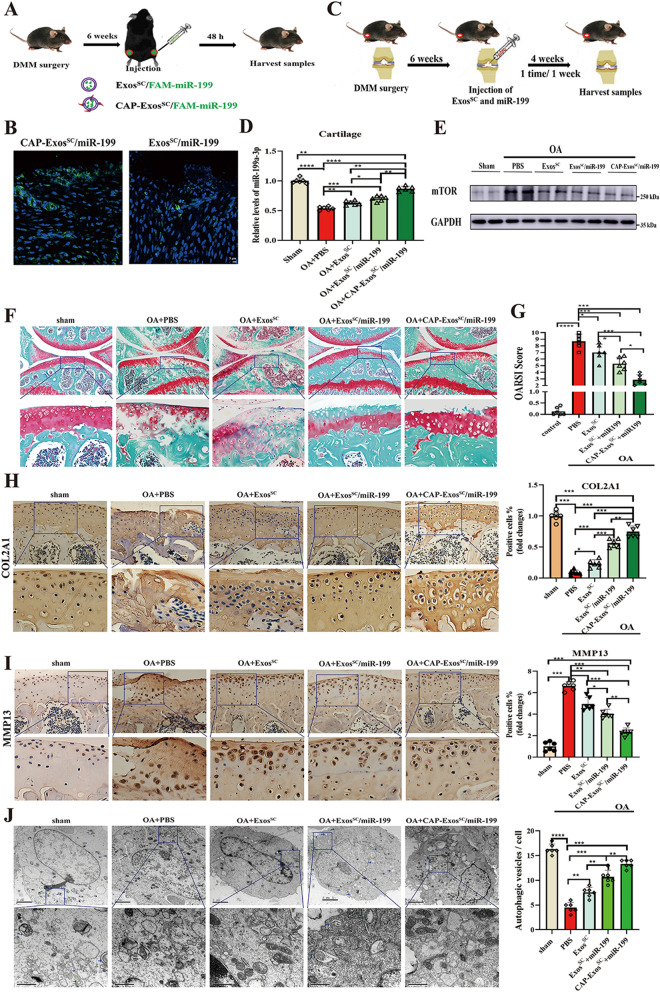
图8A:动物实验过程示意图。将加载FAM-miR-199a-3p的MSCsSC-Exos或CAP-MSCsSC-Exos注射到dmm诱导小鼠的关节内,48h后收集关节样品。
图8B:用FAM-miR-199a-3p加载MSCsSC-Exos或CAP-MSCsSC-Exos处理软骨组织的荧光图像。
图8C:不同MSCsSC-Exos递送系统对dmm诱导的OA小鼠的治疗策略示意图。
图8D:RT-PCR方法检测不同MSCsSC-Exos递送系统处理的OA小鼠软骨组织中miR-199a-3p的相对表达。
图8E:western blot检测不同MSCsSC-Exos递送系统处理的骨性关节炎小鼠软骨组织中mTOR蛋白水平。
图8F:各组小鼠软骨形态红素O/快绿染色。
图8G:OARSI评分系统量化软骨破坏的严重程度。
图8H-I:OA小鼠关节软骨COL2A1和MMP13的免疫组化分析。
图8J:OA小鼠软骨中自噬小泡的透射电镜图像。白色箭头表示自噬囊泡的细胞双层膜结构。
以上结果表明,工程MSCsSC-Exos对损伤软骨的良好作用与降低OA软骨中mTOR蛋白表达和增强自噬水平有关,其中CAP-MSCsSC-Exos/miR-199a-3p的作用最为显著。
结论
综上所述,软骨细胞靶向工程外泌体CAP-ExosSC/miR-199a-3p在OA治疗中对受损软骨表现出优越的效果。首先,阐明了MSCsSC衍生外泌体的机制。MSCsSC-Exos可以富集于敏锐关节软骨中,并将miR-199a-3p传递到软骨细胞中。软骨细胞中miR-199a-3p表达的增强特异性靶向mTOR mRNA的3′UTR区域,导致mTOR蛋白水平及相关下游信号通路的降低。抑制mTOR信号也增加软骨细胞自噬,从而增加OA软骨的合成代谢并抑制分解代谢。MSCsSC-Exos通过miR -199a-3p介导的mTOR自噬途径部分缓解OA动物模型的病理严重程度。然后构建CAP-ExosSC/miR-199a-3p,利用MSCsSC-Exos固有的综合优势,与负载miR-199a-3p协同,通过工程方法增强对OA疾病的治疗效果。由于脂肪组织在临床上很容易获得,作者的研究结果可能为OA治疗提供一种基于MSCsSC-Exos的新技术,并可能在未来导致依赖于MSCsSC-Exos应用于药物递送的前瞻性无细胞治疗。