研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Nanobiotechnology】10.2,人参来源的外泌体样纳米颗粒通过活跃血脑屏障渗透和肿瘤微环境调节抗胶质瘤作用
3611 人阅读发布时间:2023-11-23 17:09
抑制肿瘤生长和调节肿瘤微环境(tumor microenvironment, TME)中的免疫反应是改善肿瘤治疗的关键问题。然而,在神经胶质瘤的治疗中,由于血脑屏障(BBB)的存在,有效的纳米药物进入大脑的途径有限。纳米颗粒(GENs)在体外和体内被证明是胶质瘤治疗的成功候选者,表明其在抑制胶质瘤进展和调节肿瘤相关巨噬细胞(TAMs)方面具有良好的潜力。
最近,从胡萝卜、苹果、西兰花、生姜、葡萄、葡萄柚和卷心菜中提取的植物源性外泌体样纳米颗粒(PENs)被开发出来,并对其特性、成分、功能和治疗效果进行了评估。
人参作为一种传统草药已被使用了数千年,据报道,人参对心血管疾病、神经疾病和癌症具有多种药理作用。此外,人们还发现它在缓解压力、高血压、帕金森病、阿尔茨海默病等神经系统疾病以及对胶质瘤有抗癌作用具有很大的潜力。

在【J Nanobiotechnology】上发表的一篇题为“Anti-glioma effect of ginseng-derived exosomes-like nanoparticles by active blood–brain-barrier penetration and tumor microenvironment modulation”的研究中,作者利用一种简单而环保的方法开发了GENs,鉴定了它们的成分,包括基因、脂质、蛋白质和代谢物,并在体内评估了它们对脑肿瘤的治疗效果。观察到携带各种化学货物的纳米级GENs通过血脑屏障对C6胶质瘤细胞的靶向作用得到改善。此外,还分析了GENs的组成,发现GENs主要由磷脂酰胆碱(PC)组成,并含有98种miRNA和86种与人参相似的蛋白质。GENs表现出很高的稳定性,注射后通过血脑屏障被脑肿瘤吸收。作者还发现ptc- miR396f介导的靶向GENs中凋亡相关基因对c-MYC具有显著的基因沉默作用,从而抑制胶质瘤小鼠体内肿瘤生长,延长存活时间。作者观察到TMEs中促肿瘤细胞因子的下调,T细胞的诱导,调节性T细胞(Tregs)的抑制,以及TMEs对CAFs的精心激活。
总的来说,本研究的发现阐明了GENs抑制胶质瘤的机制,并强调了它们在调节TMEs方面的治疗潜力。
研究结果
1.GENs的分离、鉴定和稳定性
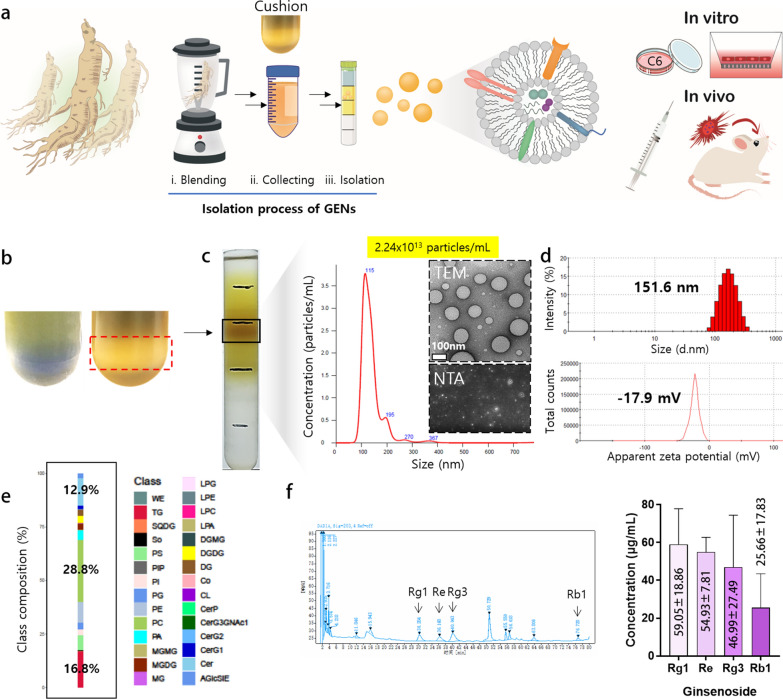
图1a:鲜人参中GENs的分离过程示意图。对人参汁进行了高速和低速离心分离。采用蔗糖缓冲法,以68%和27%的浓度分层蔗糖。采用密度梯度法,以1.13 ~ 1.19 g/mL的浮力密度纯化GENs。纯化后,通过体外和体内分析评价GENs的细胞毒性和治疗效果。
图1b:蔗糖缓冲法防止细胞外囊泡(EVs)的破坏和在离心过程中过多的EVs聚集引起的污染物(右)。
图1c:通过纳米颗粒跟踪分析(NTA),通过对GENs的连续稀释,获得了8 ~ 30%蔗糖的特定层,浓度为2.24 × 10.13颗粒/mL,并确定了其大小分布。透射电镜(TEM)观察了GENs的圆形形态。
图1d:采用动态光散射法(DLS)在37℃下测定了GENs的大小和zeta电位。
图1e:脂质组学分析的图表被报道为GENs的脂质成分的百分比。
图1f:采用高效液相色谱法测定人参皂苷的含量。
这些结果表明,可以使用一种简单且环保的方法大规模获得同质GENs。
2.GENs对胶质瘤细胞体外凋亡的影响
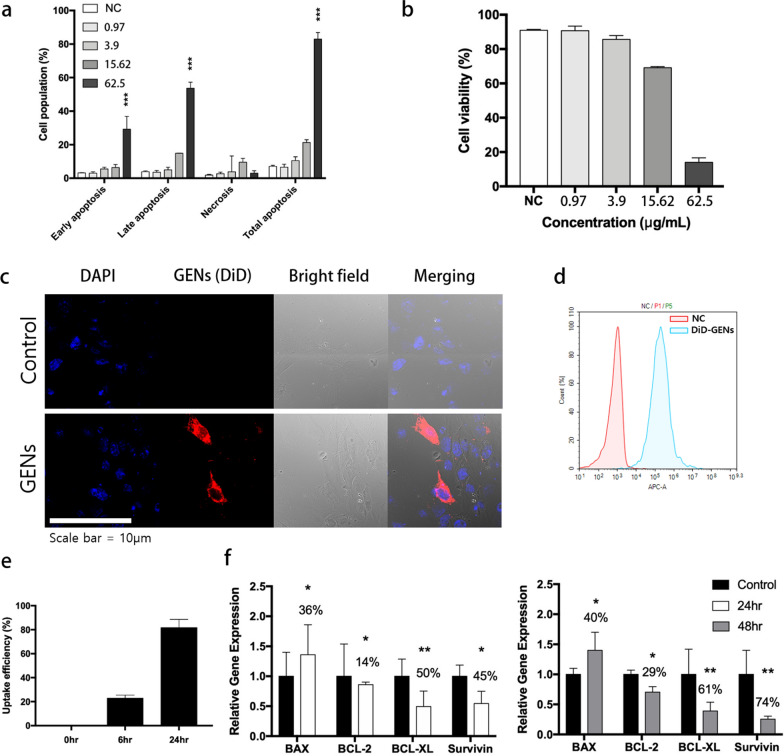
图2a:用浓度为0.975 ~ 62.5 μg/mL的GENs处理C6胶质瘤细胞24 h后,Annexin V/PI检测细胞凋亡(浓度采用Bradford法测定)。
图2b:以指定浓度的GENs处理后的细胞活力以对照组细胞的百分比表示(三个独立实验)。
图2c:共聚焦荧光成像显示C6胶质瘤细胞内化了由蛋黄和GENs制成的常规脂质体。用DiD标记的GENs与C6胶质瘤细胞孵育6小时后,评估GENs的分布。核酸和GENs分别用Hoechst染色剂(蓝色)和DiD染色剂(红色)染色。
图2d:孵育6小时后GENs的细胞摄取。
图2e:测定24 h细胞内GENs的摄取效率。
图2f:C6胶质瘤细胞凋亡相关基因mRNA表达的定量PCR分析。50µg/mL的GENs在C6胶质瘤细胞中作用24 h和48 h, mRNA表达水平归一化,与GAPDH(管家基因)的表达水平归一化,并以对照组的比例表达。
这些结果表明,在最高浓度下,GENs主要影响C6胶质瘤细胞的凋亡。
3.GENs抑制胶质瘤细胞、成纤维细胞和内皮细胞的细胞生长
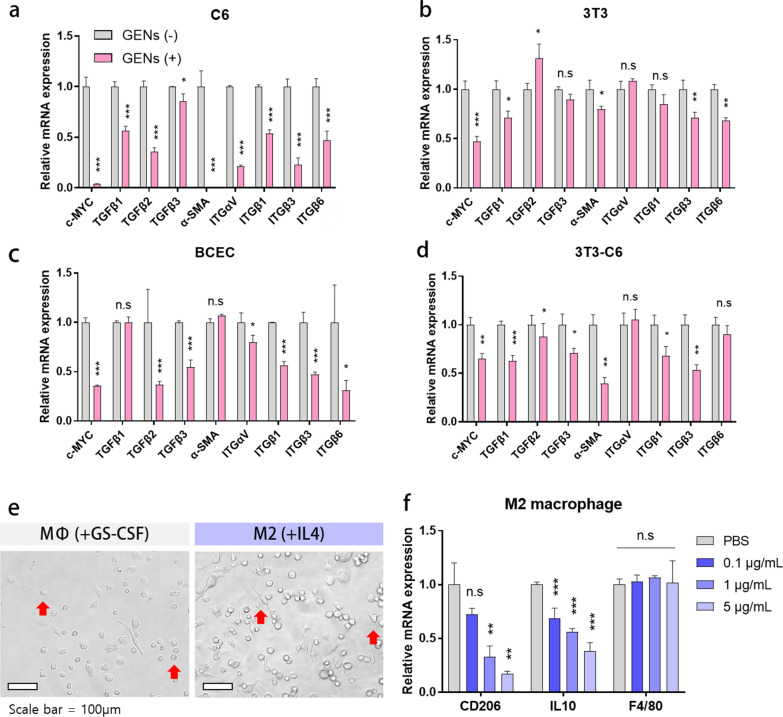
图3a-d:采用qPCR检测C6、3T3、BCEC和3T3-C6共培养中c-MYC原癌基因、TGFβ1、2、3、整合素αVβ1、3、6和α-SMA的基因表达水平。
图3e:显微镜观察到的BMMs的形态。GS-CSF刺激BMMs 7天,IL- 4刺激BMMs 3天。
图3f:连续稀释GENs后M2巨噬细胞mRNA表达水平。
这些结果表明,在体外,GENs通常有效地抑制细胞生长因子、CAFs和CAFs标记物。
4.GENs在体内的靶向作用
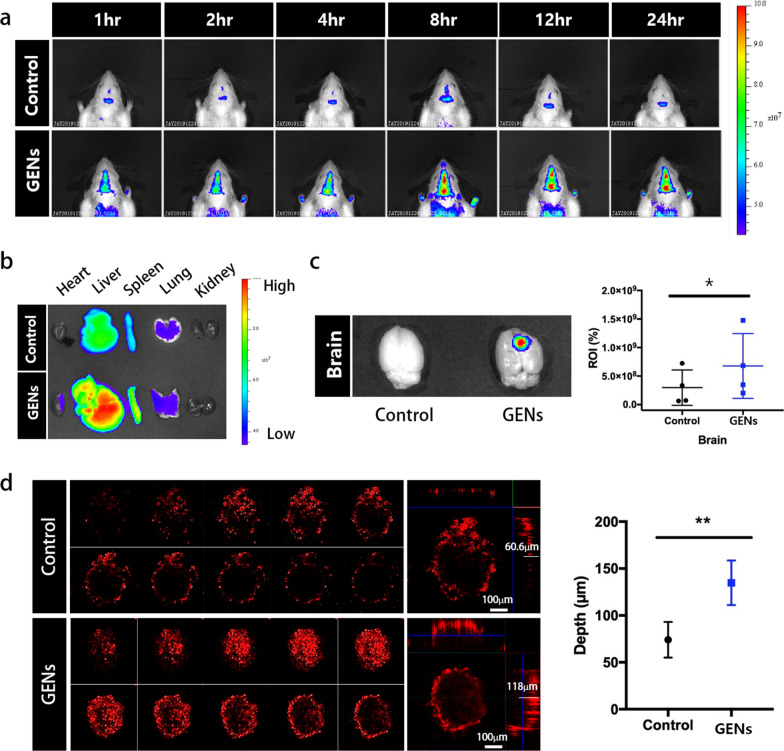
图4a:DiD标记的GENs的体内荧光成像。以传统的蛋黄脂质体为对照。静脉注射DiD标记的GENs后,在不同时间点进行荧光成像。
图4b:静脉注射DiD标记的GENs 24 h后解剖器官的离体荧光成像。与对照组相比,在GENs中观察到更高的大脑荧光强度。
图4c:脑样品中荧光强度的相对感兴趣区(ROI)。以ROI作为衡量标准,该图显示,GENs的荧光强度平均比对照组高出近2.26倍。
图4d:GENs和常规脂质体在三维肿瘤球体中的渗透。
这些数据表明,GENs表现出合适的生理和化学特性,能够增强肿瘤内积聚和快速渗透血脑屏障。
5.GENs在体内的抗肿瘤作用
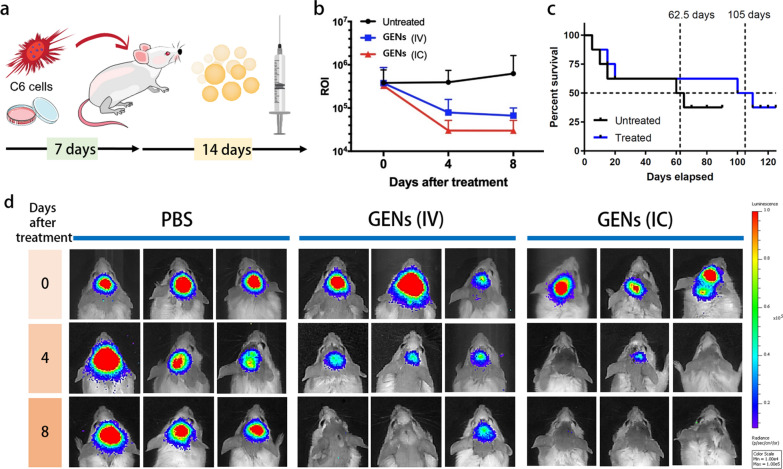
图5a:Balb/C小鼠原位模型示意图。C6胶质瘤细胞植入脑后,每隔一天注射一次GENs,连续14天。
图5b:在治疗后指定天数(0至8天)后,与对照组相比的感兴趣区域(ROI)发光强度。
图5c:与对照组相比,经GENs处理的荷瘤小鼠的存活率(N= 8)。
图5d:原位处理后,通过体内成像系统测量C6细胞(表达荧光素酶)的发光强度。治疗后第8天,与对照组相比,GENs治疗组C6胶质瘤的发光强度显著降低(N= 8)。
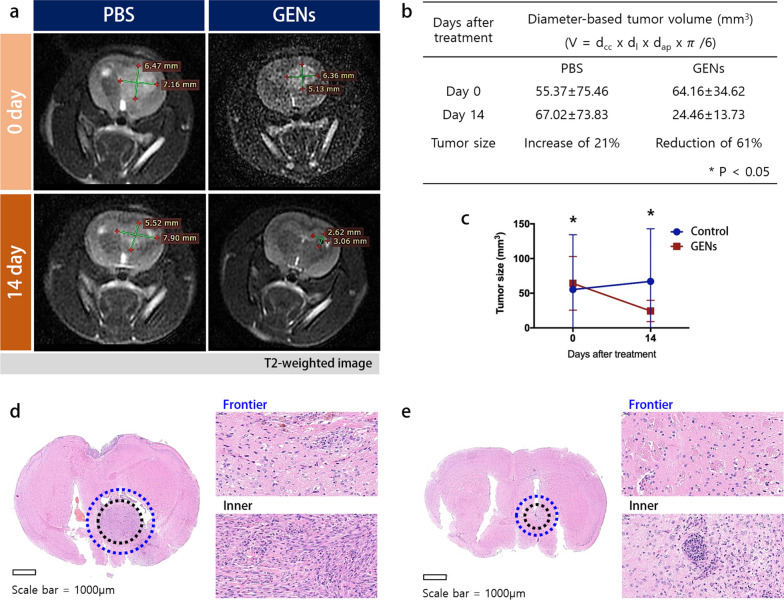
图6a:a GENs治疗14天后,通过MRI成像测量肿瘤体积。
图6b-c:基于直径的肿瘤体积的表格和图表。在用GENs治疗后的第14天,肿瘤体积减少了61%,而对照组的肿瘤体积增加了21%。
图6d-e:对照肿瘤和治疗肿瘤脑组织的HE染色。
6.CAFs的调控导致肿瘤相关巨噬细胞(TAMs)的产生
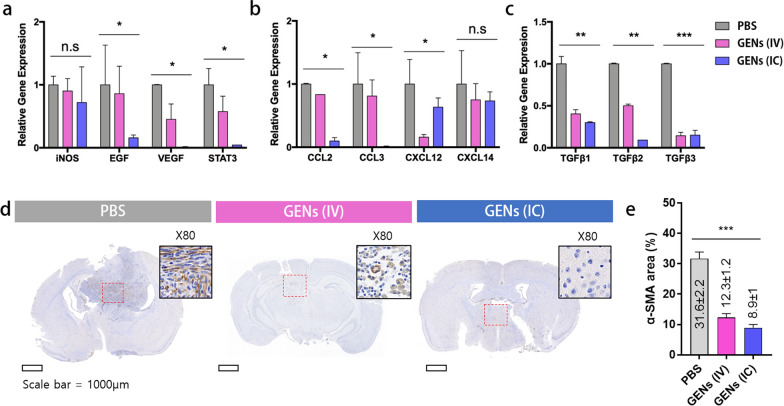
图7a:治疗组CAFs相关基因mRNA表达降低。
图7b:趋化因子基因表达降低。
图7c:治疗组TGFβ家族基因表达降低。灰色,PBS;粉红色,静脉注射;蓝色,颅内(IC)给药。
图7d-e:经GENs处理后脑组织α-SMA免疫组化染色(棕色)。
这些结果表明,在脑瘤小鼠中,用GENs治疗可以有效抑制CAFs,表明GENs可以作为一种有希望的治疗方法来提高癌症治疗的有效性和改善预后。
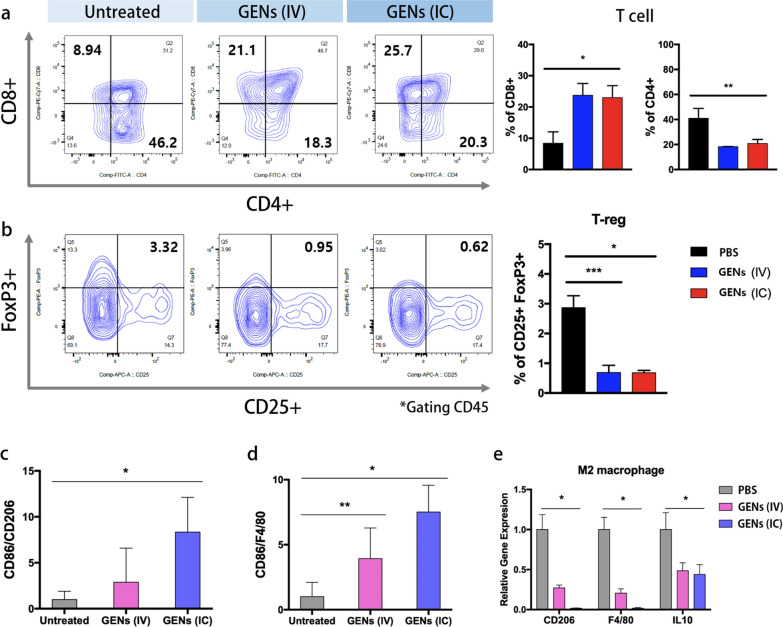
图8a:T细胞的调控分析。使用荧光偶联的抗CD8、CD4和CD45单克隆抗体分析T细胞。与PBS组相比,GENs治疗组T细胞CD8、CD45的丰度增加,而CD4的丰度降低。
图8b:用荧光偶联的抗foxp3、CD25和CD45单克隆抗体分析Tregs。通过FACS分析评估Tregs细胞群。在GENs治疗组中,Tregs的丰度降低。
图8c-e:M1与M2基因相对表达量之比。
这些结果表明,在GENs治疗组中,通过促进巨噬细胞增殖和调节免疫系统(包括参与血管生成调节的T细胞和Tregs)来抑制肿瘤。
7.ptc-miR396f对c-MYC的基因沉默作用
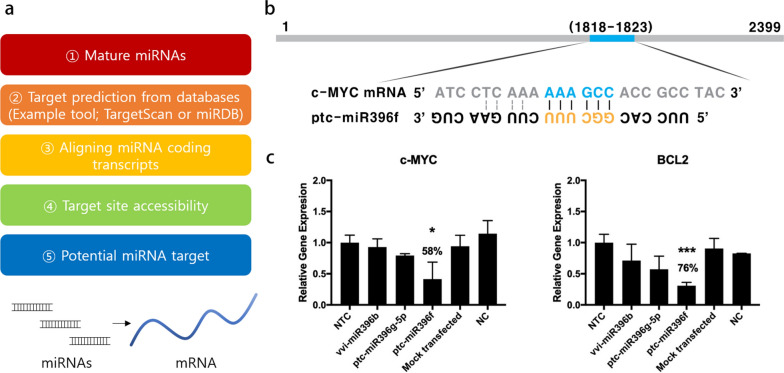
图9a:使用基于序列的miRNA靶标预测工具预测miRNA靶标。
图9b:ptc-miR396f在c-MYC mRNA中的结合位点。
图9c:c-MYC和BCL2与miRNA的相对基因表达水平。与模拟转染组和对照组相比,基因沉默效果显著,后者归一化为非靶向对照组(NTC)。
总结
在本研究中,作者评估了GENs的抗癌活性和对胶质瘤的调节作用。研究了与细胞凋亡或细胞增殖相关的各种信号通路中涉及的各种miRNA。本研究结果证实了GENs通过诱导肿瘤细胞凋亡,调控巨噬细胞和TAMs,以及通过外泌体发挥基因沉默作用,从而抑制肿瘤生长。这些结果突出了GENs在治疗胶质瘤方面的巨大潜力。
总之,在治疗应用方面,作者认为GENs是一种潜在的纳米药物,具有治疗癌症的潜力。预计未来的研究将深入研究GENs与常规药物的联合作用,探索GENs的其他应用,并研究可能的修饰以增强其靶向能力。






