研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Cell Death Disease】9分,看外泌体如何调节NFATc1 m6A甲基化水平纠正破骨细胞诱导的骨吸收
871 人阅读发布时间:2023-12-08 16:05
骨质疏松症对公众健康有着深远的影响。一线双lin酸盐经常引起颌骨骨坏死,同时抑制破骨细胞。因此,开发有效的治疗方法非常重要。湾湾今天分享一篇发表在【Cell Death Disease】上题为“Exosome-targeted delivery of METTL14 regulates NFATc1 m6A methylation levels to correct osteoclast-induced bone resorption”的研究,本研究结果显示,以4249A为功能位点的唑来lin酸(ZOL)引起的NFATc1 m6A甲基化水平升高与破骨细胞骨吸收减少高度相关。上游,METTL14通过NFATc1的甲基化功能位点调节破骨细胞骨吸收。下游,METTL14上调m6A甲基化水平后,YTHDF1和YTHDF2对NFATc1的转录后调控表现出拮抗作用。重要的是,本研究表明外泌体释放的METTL14可以提高NFATc1的m6A甲基化水平,抑制破骨细胞,帮助绝经后骨质疏松症患者保持骨量,避免引发颌骨骨坏死,成为治疗骨质疏松症的新型生物活性分子。

研究结果
1.高通量测序和差异表达基因
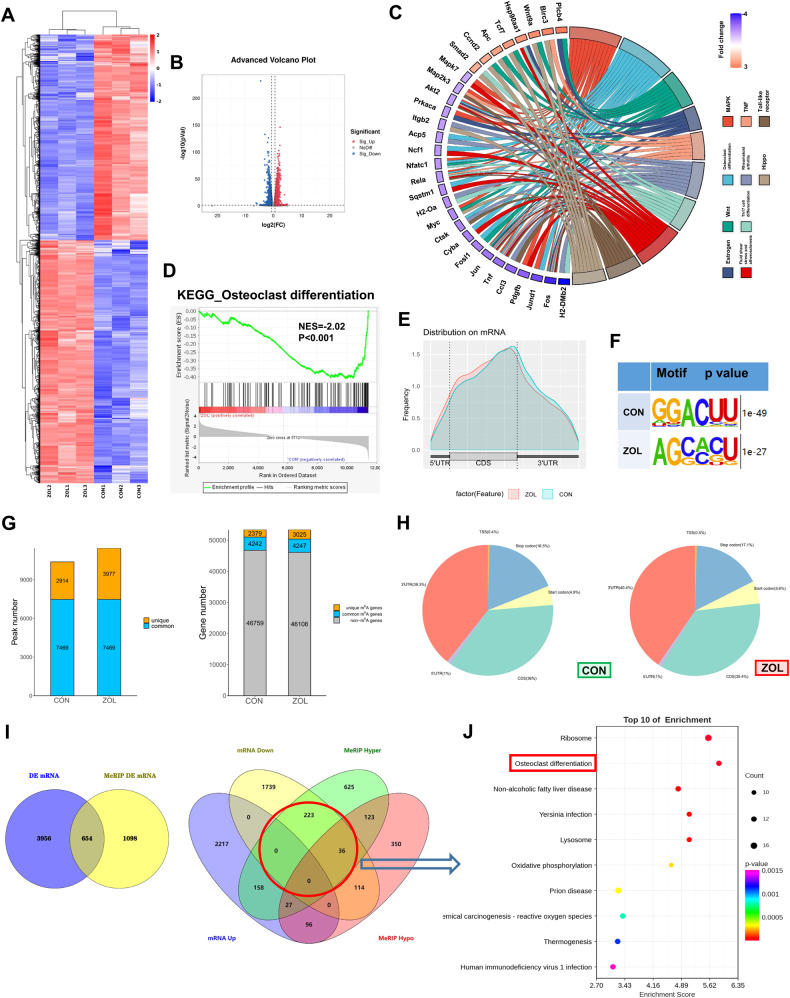
图1A-B:热图和火山图显示CON和ZOL组之间mRNAs的差异表达。
图1C:KEGG在和弦图中可视化。
图1D:基因集富集分析(GSEA)图利用RNA序列数据评估破骨细胞分化过程的变化。
图1E:两组mRNA转录组中m6A富集谱。
图1F:主要共识基序确定了两组的m6A序列峰。
图1G:CON组和ZOL组m6A序列中m6A峰数和m6A修饰基因数。
图1H:两组的m6A峰分布图显示了总m6A峰的比例。
图1I:维恩图显示了两组中654个具有差异表达和差异m6a甲基化的交叉基因(左)。根据mRNA和m6A甲基化水平对差异表达基因进行分类(右)。
图1J:通过交叉基因获得的差异表达基因,显示感兴趣的生物过程富集的气泡图。
2.ZOL对成骨细胞和破骨细胞的影响
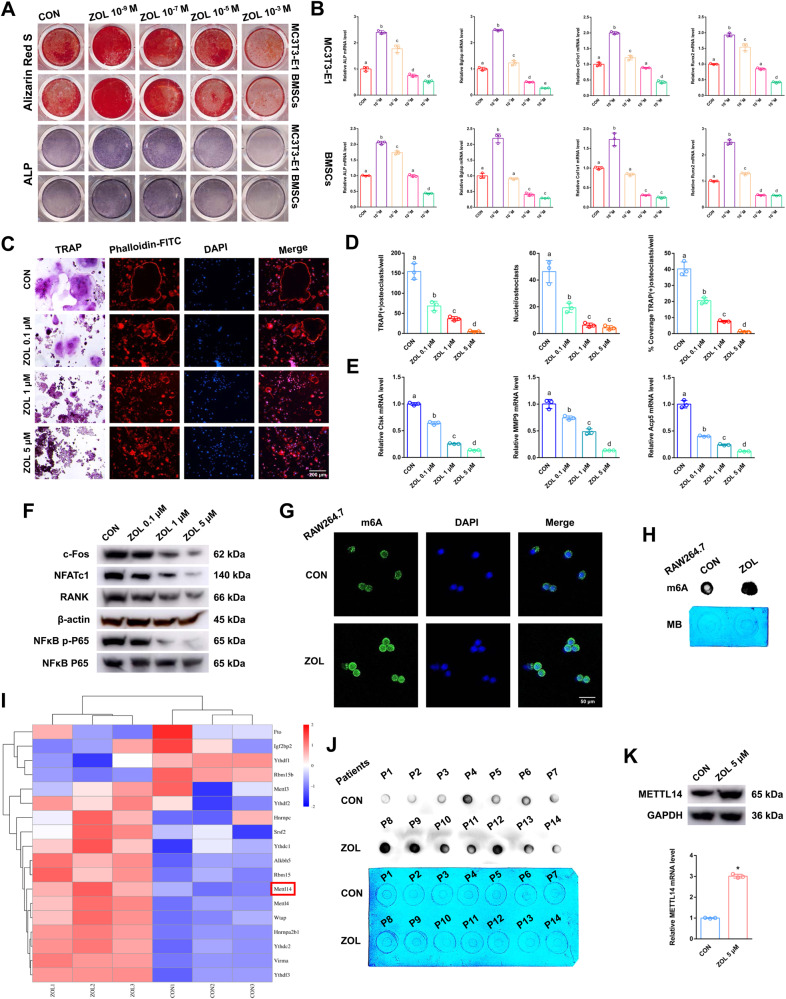
图2A:加入不同浓度的ZOL后,在成骨诱导21天和7天后对MC3T3-E1细胞和BMSCs进行茜素红S或ALP染色。
图2B:不同浓度ZOL作用下MC3T3-E1细胞和骨髓间充质干细胞中ALP、Bglap、Col1α1和Runx2的相对表达水平。
图2C:采用TRAP染色和F-actin带染色检测不同浓度ZOL的破骨细胞分化和骨吸收能力。
图2D:不同浓度ZOL下TRAP阳性破骨细胞数量、覆盖率和细胞核的直方图。
图2E:不同ZOL浓度下RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。
图2F:western blot检测不同ZOL浓度RAW264.7细胞裂解物中c-fos、NFATc1、RANK和NFκB p-P65蛋白水平。
图2G-H:免疫荧光图像和m6A点印迹法显示ZOL刺激后RAW264.7细胞的整体m6A水平。
图2I:热图显示ZOL刺激后m6A甲基化相关酶的差异表达。
图2J:ZOL刺激后,分别采用RT-qPCR和western blot检测RAW264.7细胞中METTL14 mRNA和蛋白的表达水平。
这些结果表明,随着浓度的增加,ZOL对rankl诱导的破骨细胞分化具有抑制作用,当ZOL浓度达到5 μM时,抑制作用最为明显。
3.ZOL或METTL14抑制破骨细胞分化,增加破骨细胞前体细胞m6A甲基化水平
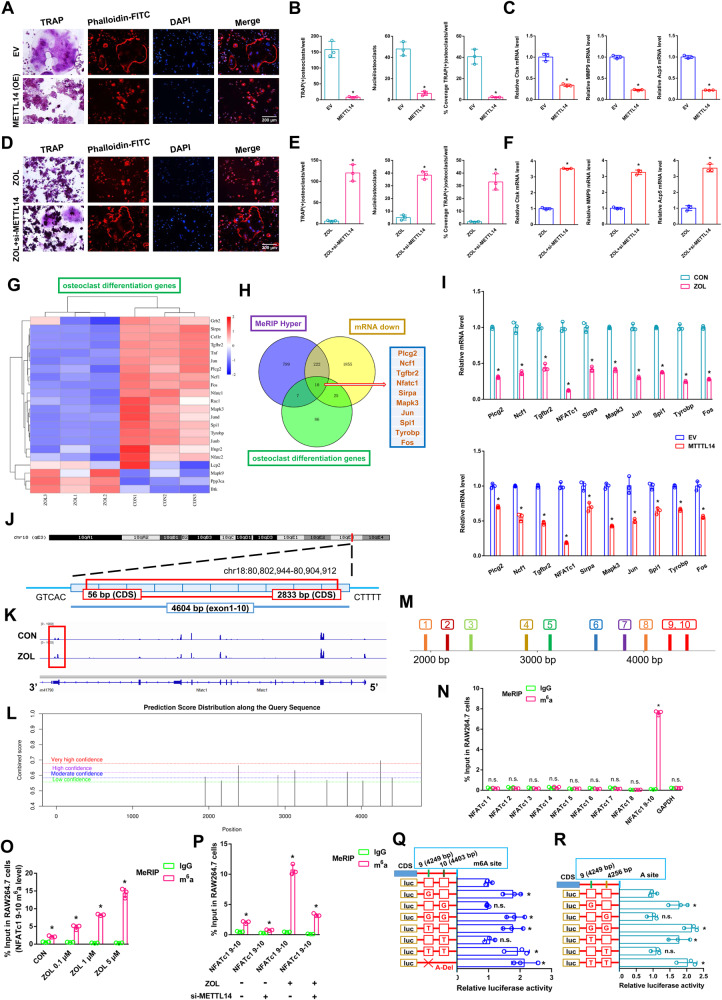
图3A:采用TRAP染色和F-actin带染色检测两组间破骨细胞分化情况。
图3B:两组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图3C:两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。ZOL刺激后,将si-METTL14转染RAW264.7细胞,准备进一步研究。
图3D:采用TRAP染色和F-actin带染色检测两组间破骨细胞分化情况。
图3E:两组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图
图3F:两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。
图3G:热图显示ZOL刺激后破骨细胞分化的差异表达基因。
图3H:KEGG分析揭示了三个交叉点的差异表达基因:破骨细胞分化基因、MeRIP超基因和mRNA下调基因。
图3I:RT-qPCR分析显示ZOL刺激或METTL14过表达后10个差异表达基因的表达水平。
图3J:NFATc1基因组定位示意图。
图3K:在ZOL刺激或不刺激的情况下,NFATc1转录本中meRIP-Seq的K-m6A峰值可视化。m6A峰位于NFATc1的3′UTRs区。
图3L:SRAMP网站上NFATc1潜在的m6A甲基化位点。
图3M:根据潜在的m6A甲基化位点,将NFATc1分为9个片段。
图3N:采用m6A-RT-qPCR检测ZOL刺激后抗m6A组与抗IgG组之间9段NFATc1的富集情况。
图3O:采用m6A-RT-qPCR检测ZOL浓度增加时NFATc1-9,10片段的富集情况。
图3P:采用m6A-RT-qPCR检测ZOL或si-METTL14刺激下NFATc1-9,10片段的富集情况。
图3Q-R:通过逐步突变荧光素酶报告基因来验证两个m6A修饰位点。
这些结果表明,METTL14在RANKL诱导的破骨细胞分化过程中起关键作用。它的作用与ZOL类似。
4.NFATc1基因参与了METT14抑制破骨细胞分化的过程,只有NFATc1 - 9片段显示出高水平的m6A甲基化
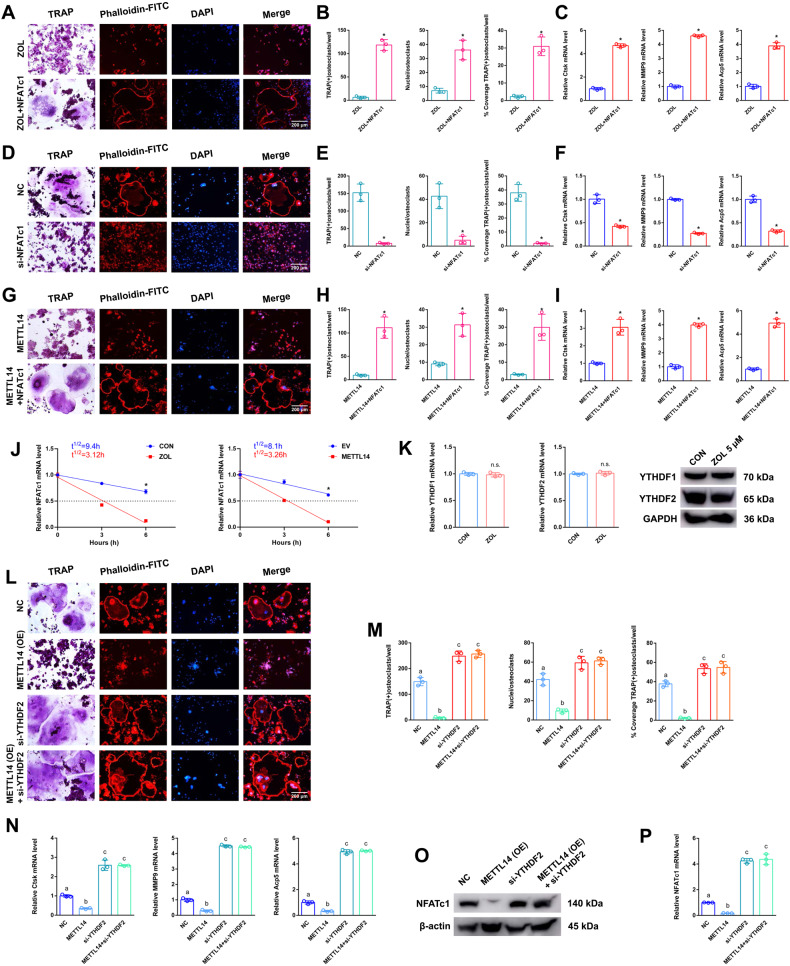
图4A:采用TRAP染色和F-actin带染色检测两组间破骨细胞分化情况。
图4B:两组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图4C:两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。接下来,将si-NFATc1转染RAW264.7细胞,准备进一步研究。
图4D:采用DTRAP染色和F-actin带染色检测两组间破骨细胞分化情况。
图4E:两组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图4F:两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。接下来,将NFATc1或METTL14按不同组分别或同时转染RAW264.7细胞,为进一步研究做准备。
图4G:TRAP染色和F-actin带染色检测两组间破骨细胞分化情况。
图4H:两组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图4I:两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
图4J:在ZOL或METTL14刺激下,根据线性回归分析估计NFATc1 mRNA半衰期。
图4K:ZOL刺激后,分别采用RT-qPCR和western blotting检测RAW264.7细胞中YTHDF1和YTHDF2 mRNA和蛋白表达水平。接下来,将si-YTHDF2或METTL14根据不同的组分别或同时转染到RAW264.7细胞中,准备进一步的研究。
图4L:采用TRAP染色和F-actin带染色检测各组间破骨细胞分化情况。
图4M:四组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图4N:四组RAW264.7细胞中Ctsk、MMP9、Acp5的相对表达量。
图4O-P:采用RT-qPCR和Western blot分别分析四组RAW264.7细胞中NFATc1 mRNA和蛋白的表达水平。
5.在METTL14甲基化水平升高后,YTHDF2对NFATc1的转录后调控有负面影响
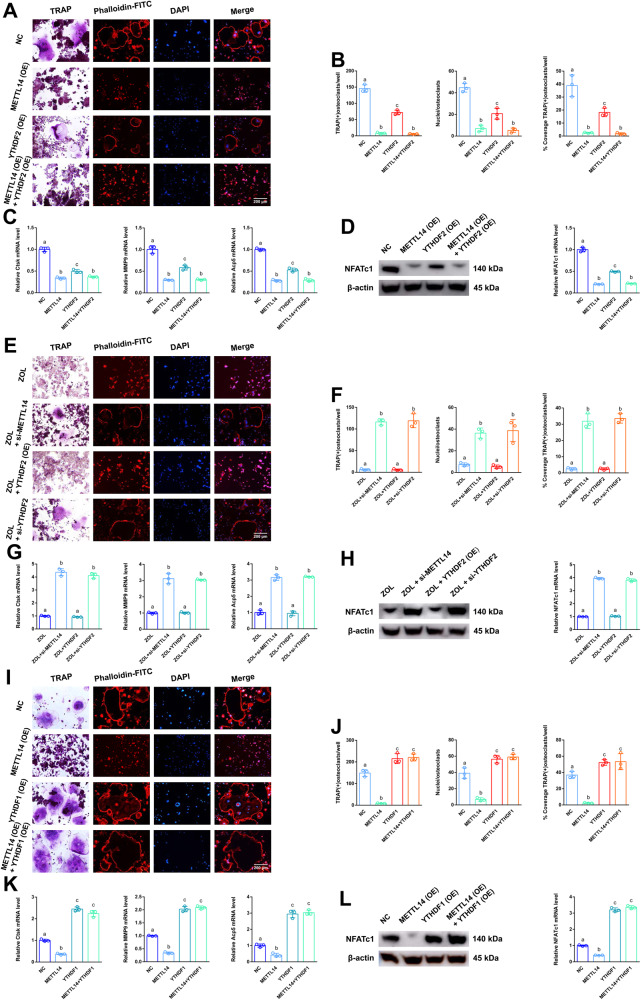
图5A:采用TRAP染色和F-actin带染色检测各组间破骨细胞分化情况。
图5B:四组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图5C:四组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。
图5D:采用RT-qPCR和western blot分别分析四组RAW264.7细胞中NFATc1 mRNA和蛋白的表达水平。ZOL刺激后,将YTHDF2、si-YTHDF2或si-METTL14按不同组分别转染RAW264.7细胞,准备进一步研究。
图5E:采用TRAP染色和F-actin带染色检测各组间破骨细胞分化情况。
图5F:四组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图5G:四组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。
图5H:采用RT-qPCR和western blot分别分析四组RAW264.7细胞中NFATc1 mRNA和蛋白的表达水平。接下来,根据不同组分别或同时将YTHDF1或METTL14转染到RAW264.7细胞中,为进一步研究做准备。
图5I:采用TRAP染色和F-actin带染色检测各组间破骨细胞分化情况。
图5J:四组间TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
图5K:四组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达量。
图5L:采用RT-qPCR和western blot分别分析四组RAW264.7细胞中NFATc1 mRNA和蛋白的表达水平。
6.METTL14升高甲基化水平后,YTHDF1和YTHDF2对NFATc1的转录后调控具有拮抗作用
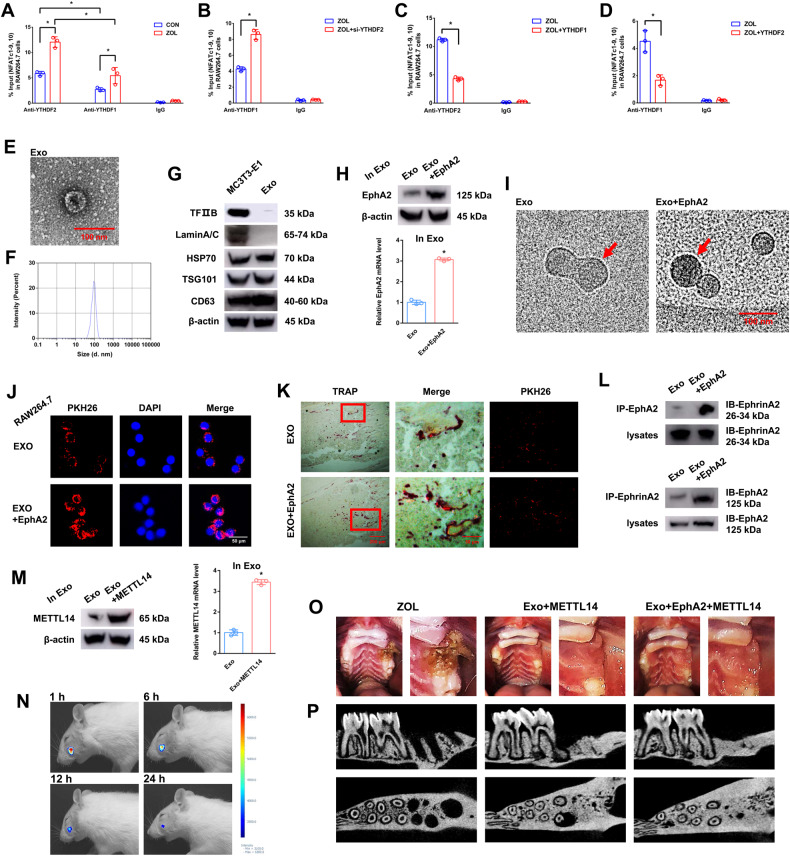
图6A-D:采用RIP法检测不同条件下nfatc1 - 9,10片段的富集率。
图6E:外泌体的电镜图像。
图6F:MC3T3-1细胞分泌外泌体的大小分布。
图6G:Western blotting分析MC3T3-E1细胞裂解物或MC3T3-E1细胞分泌外泌体中TFIIB、Lamin A/C、HSP70、TSG101和CD63蛋白水平。
图6H:EphA2转染ME3T3-E1细胞后,分别采用RT-qPCR和western blotting检测EphA2外泌体mRNA和蛋白的表达水平。
图6I:外泌体的低温透射电镜图像。红色箭头表示纳米金探针(1.4 nm)与EphA2受体结合。
图6J:MC3T3-E1细胞外泌体进入RAW264.7细胞的免疫荧光图像。
图6K:荧光显微镜和TRAP染色分析显示pkh26标记的外泌体注射到骨髓中。红框表示外泌体被破骨细胞吸收。
图6L:免疫共沉淀(co-IP)分析显示EphA2-EphrinA2和EphrinA2-EphA2的结合作用。
图6M:ME3T3-E1细胞转染METTL14后,分别采用RT-qPCR和Western blot检测METTL14外泌体mRNA和蛋白的表达水平。
图6N:大鼠体内成像分析显示,用Cy5.5标记的外泌体特异性定位于左上颌第一磨牙切除后的牙槽内。
图6O:拔牙8周后,大鼠双lin酸盐相关性颌骨骨坏死(BRONJ)及2个外泌体治疗组(Exo+METTL14和Exo+EphA2 +METTL14)的代表性图片。
图6P:注射ZOL或外泌体8周后,应用显微ct观察各组骨组织学变化。
7.外泌体中的METTL14在体内表现出明显的骨丢失修复作用
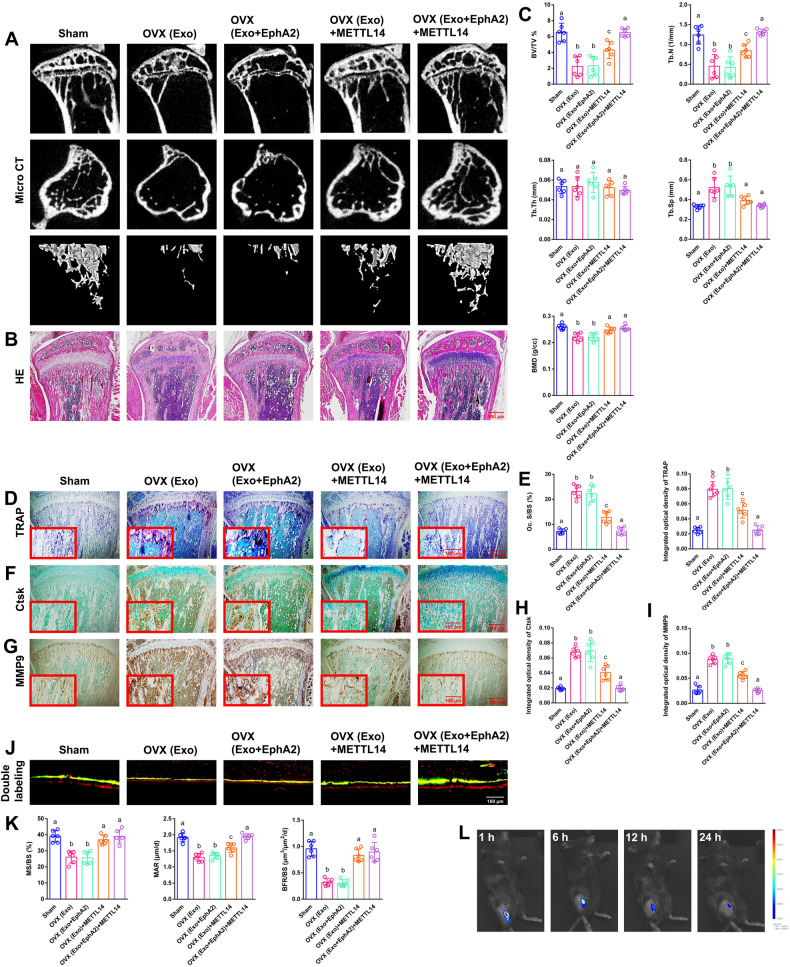
图7A-B:注射外泌体8周后,应用micro-CT和HE染色测定骨组织学参数。
图7C:五组之间BV/TV, Tb.N, Tb.Th, Tb.Sp 和 BMD的直方图。
图7D:采用TRAP染色评价破骨细胞分化和骨吸收能力。
图7E:五组之间破骨细胞Oc. S/BS和TRAP的综合光密度的直方图。
图7F-G:采用Ctsk免疫组化和MMP9染色评价破骨细胞分化和骨吸收能力。
图7H-I:五组间Ctsk和MMP9综合光密度直方图。
图7J-K:皮质骨动态组织形态学代表性图像,MS/BS、MAR和BFR/BS定量。
图7L:小鼠体内成像分析显示,标记Cy5.5的外泌体特异性位于胫骨骨髓中。
结论
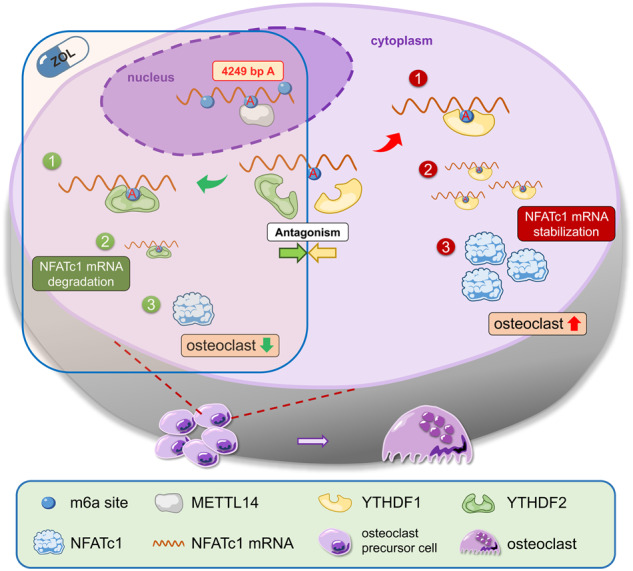
在一项体内研究中,外泌体释放的METTL14增强了NFATc1的m6A甲基化水平,从而抑制破骨细胞。这一现象是ZOL刺激后破骨细胞分化过程中的一种新的分子机制。此外,与双lin酸盐相比,外泌体释放的METTL14在体内不会引发颌骨骨坏死。
因此,METTL14将是一种比传统药物ZOL更安全的骨质疏松生物治疗药物。此外,作者发现了一种新的方法来提高外泌体靶向递送的有效性。体外和体内破骨细胞均可通过成骨细胞外泌体表面EphA2受体的过表达,从外泌体中摄取更多的METTL14。
这是因为破骨细胞表面有相应的EphrinA2配体。这一发现提示成骨细胞和破骨细胞可以通过EphA2-EphrinA2通路相互传递生物信号。结合本研究需要解决的临床问题,作者认为骨质疏松症对公众健康影响深远,抑制破骨细胞诱导的骨吸收是核心解决方案。作者认为EphA2在外泌体上的过表达是一种有效的靶向抑制破骨细胞的生物载体,可以帮助绝经后骨质疏松症患者在避免双lin酸盐副作用的同时保持骨量。重要的是,本研究提供了一种通过使用释放METTL14的外泌体来阻止破骨细胞分化的方法。






