研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Cell Reports】8.8分,肿瘤细胞通过增加肿瘤相关巨噬细胞衍生的外泌体来对抗抗肿瘤免疫
1479 人阅读发布时间:2024-01-18 09:31
基于免疫检查点阻断(ICB)的疗法,如针对程序性细胞死亡蛋白-1 (PD-1)的抗体,在治疗多种类型的癌症方面显示出很好的疗效。然而,大多数患者对治疗没有反应。需要更好地了解免疫检查点介导的免疫逃避,以开发有效的新治疗策略来改善患者的反应。程序性死亡配体1 ( PD-L1)在肿瘤细胞表面的表达被认为是PD-1/PD-L1阻断应答的重要因素。

湾湾今天分享的是发表在【Cell Reports】上题为“Upregulation of exosome secretion from tumor-associated macrophages plays a key role in the suppression of anti-tumor immunity”的研究文章。该研究揭示了肿瘤相关巨噬细胞(TAMs)通过积极增加外泌体的分泌,使这些外泌体表面富含PD-L1蛋白,从而有效地抑制了抗肿瘤的CD8 T细胞的增殖和功能。抑制TAMs外泌体的分泌能够显著提高PD-1抗体治疗的效果。
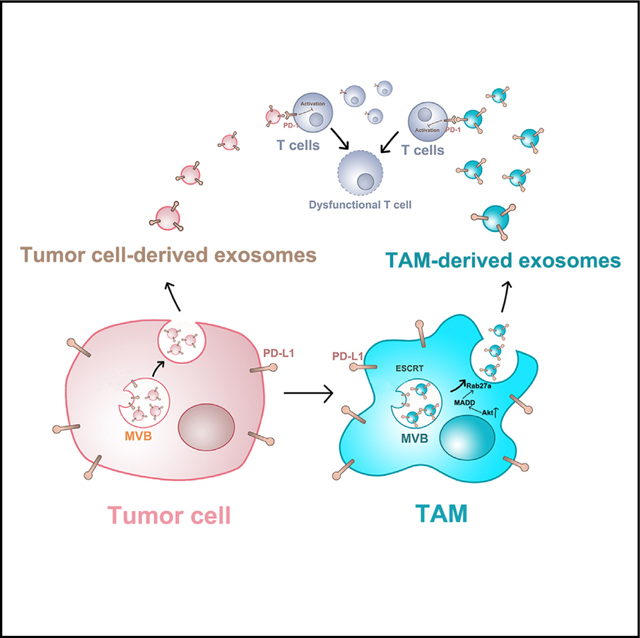
研究结果
1.巨噬细胞向TAMs的转化促进了sEVs的分泌
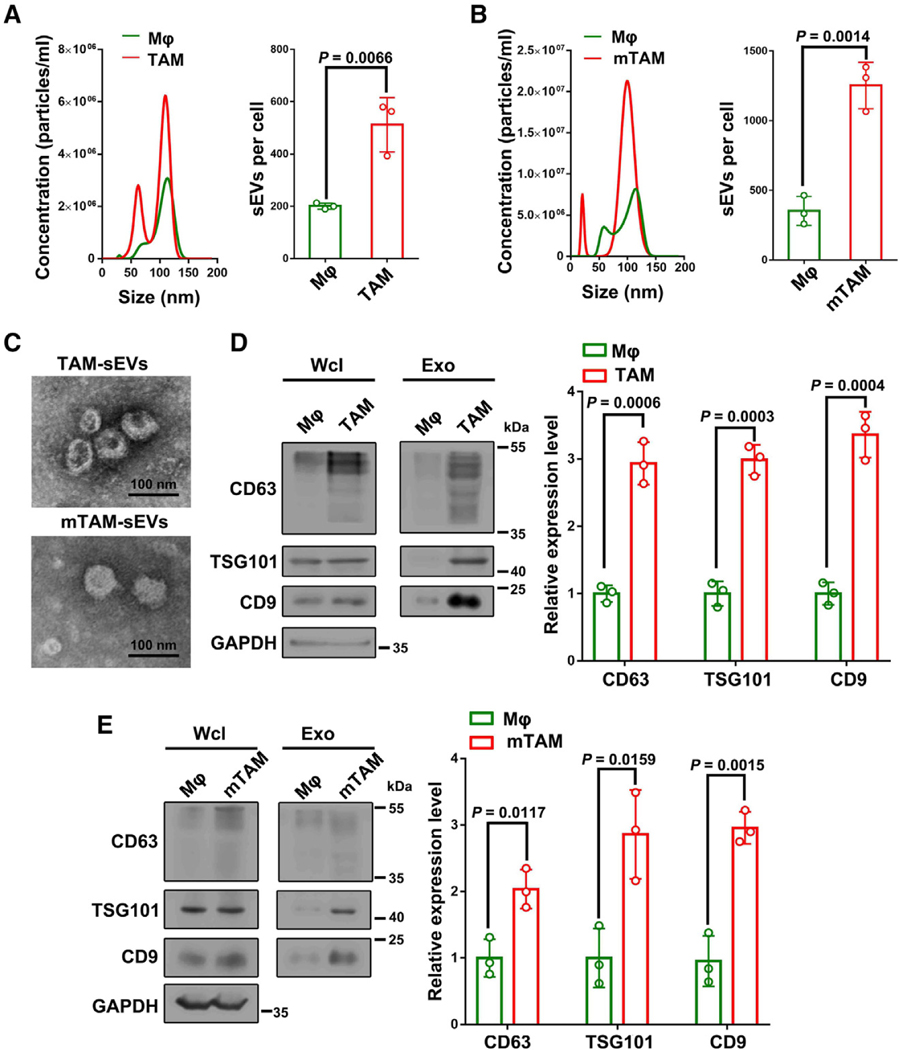
图1A:从人单核细胞源性巨噬细胞(Mφ)纯化的sEVs和WM9细胞CM诱导的TAMs的NTA。
图1B:小鼠骨髓源性巨噬细胞纯化sEVs的NTA,以及YUMM1.7细胞CM (mTAM)诱导的TAMs。
图1C:分别从TAMs和mTAMs中纯化的sEVs的代表性透射电镜图像。
图1D:Western blot分析显示外泌体标记蛋白(CD63, TSG101和CD9)在人Mφ和TAMs的全细胞裂解液(Wcl)和外泌体中的表达水平。
图1E:Western blot分析显示CD63、TSG101和CD9在小鼠Mφ和mTAMs的全细胞裂解液(Wcl)和外泌体中的表达水平。
这些结果表明,Mφ向TAMs的转变导致外泌体分泌增加。
2.Akt通过MADD激活Rab27a促进TAMs中外泌体的分泌
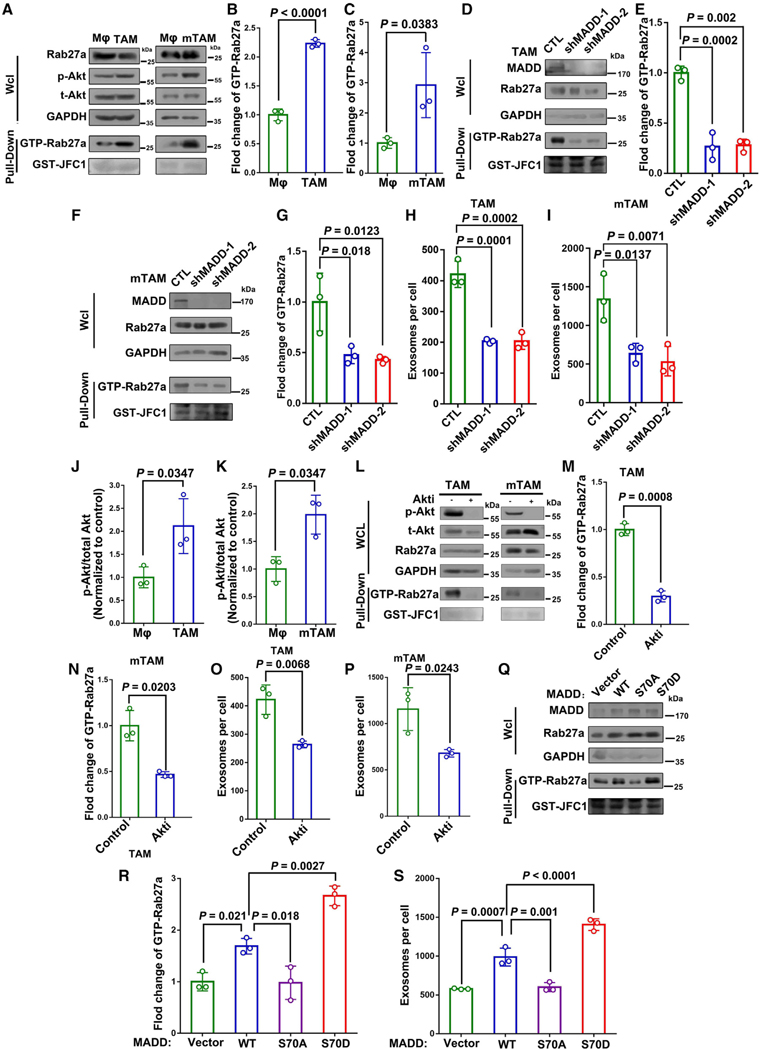
图2A:WM9-TAMs和亲代Mφ细胞(左图);YUMM1.7 - TAMs(mTAM)和亲代小鼠Mφ细胞(右图)全细胞裂解物(Wcl)中Rab27a、t-Akt和p-Akt水平。
图2B:RT-PCR检测TAM和Mφ中GTP-Rab27a的水平。
图2C:RT-PCR检测mTAM和Mφ中GTP-Rab27a的水平。
图2D:Western blot分析显示对照(CTL)和MADD敲低(KD)TAMs中GTP-Rab27a的水平。
图2E:MADD KD患者和非MADD KD患者GTP-Rab27a水平的定量分析。
图2F:Western blot分析显示GTP-Rab27a在患有或不患有MADD KD的mTAM中的水平。
图2G:GTP-Rab27a在患有或不患有MADD KD的mTAM中的定量水平。
图2H-I:利用NTA定量分析TAMs和mTAM分泌的外泌体。
图J-K:基于western blot数据定量人(J)和小鼠(K)巨噬细胞中p-Akt水平。
图2L:Pull-down实验检测Akt抑制剂处理或不处理WM9 - TAMs和YUMM1.7 - TAMs(mTAM)中GTP-Rab27a的水平。
图2M-N:RT-PCR检测Akt抑制剂处理和未处理TAMs和mTAM中GTP-Rab27a的水平。
图2O-P:RT-PCR检测Akt抑制剂处理和未处理TAMs和mTAM释放的外泌体。
图2Q:表达野生型MADD (WT)、缺磷突变体MADD (S70A)或拟磷突变体MADD (S70D)的细胞被裂解,用于GST-JFC1 RBD pull-down实验,以评估GTP-Rab27a的水平。
图2R:RT-PCR检测分析WT、S70A或S70D MADD的mTAM中GTP-Rab27a的水平。
图2S:RT-PCR检测分析WT、S70A或S70D MADD的mTAM中释放的外泌体。
这些结果表明,Akt在TAMs中磷酸化MADD是增加外泌体分泌所必需的。
3.TAM来源外泌体上PD-L1的表达增加
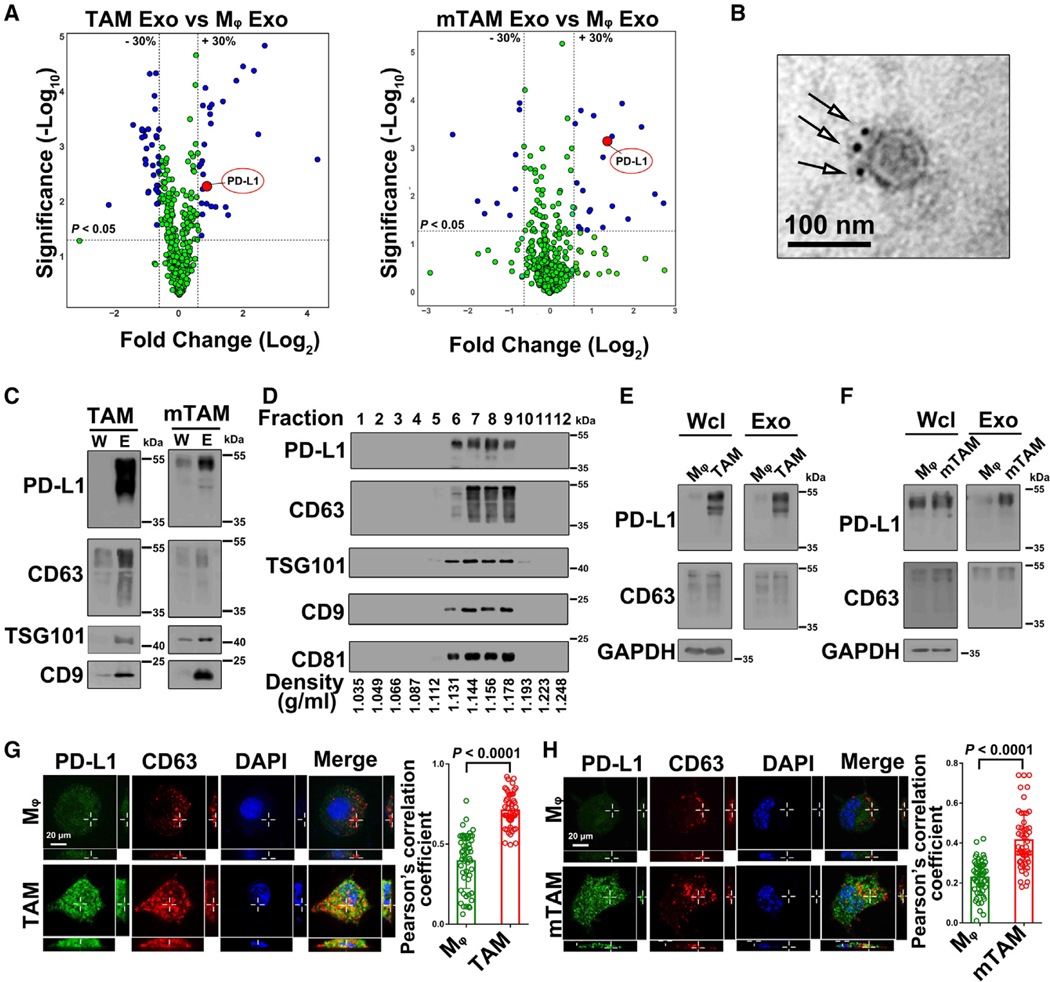
图3A:火山图分析基于RPPA的蛋白质水平,比较WM9细胞cm诱导的TAM来源外泌体(TAM Exo)或YUMM1.7细胞cm诱导的小鼠TAM来源外泌体(mTAM Exo)与其匹配的Mφ来源外泌体(Mφ Exo)。
图3B:巨噬细胞来源外泌体的代表性TEM图像。
图3C:Western blot分析从WM9-TAMs (TAMs)和YUMM1.7-TAMs(mTAM)纯化的全细胞裂解液(W)和外泌体(E)中PD-L1和外泌体标记蛋白CD63、TSG101和CD9。
图3D:PD-L1与CD63、TSG101、CD9和CD81在碘二醇密度梯度上共分异。
图3E:Western blot分析人巨噬细胞外泌体。TAM外泌体中PD-L1表达上调。
图3F:Western blot分析小鼠巨噬细胞外泌体。
图3G-H:Mφ和TAMs中PD-L1和CD63的免疫荧光染色。
这些结果表明,Mφ向TAM的转化增加了PD-L1向MVEs的募集,用于外泌体的分泌。
4.TAM外泌体抑制CD8+ T细胞
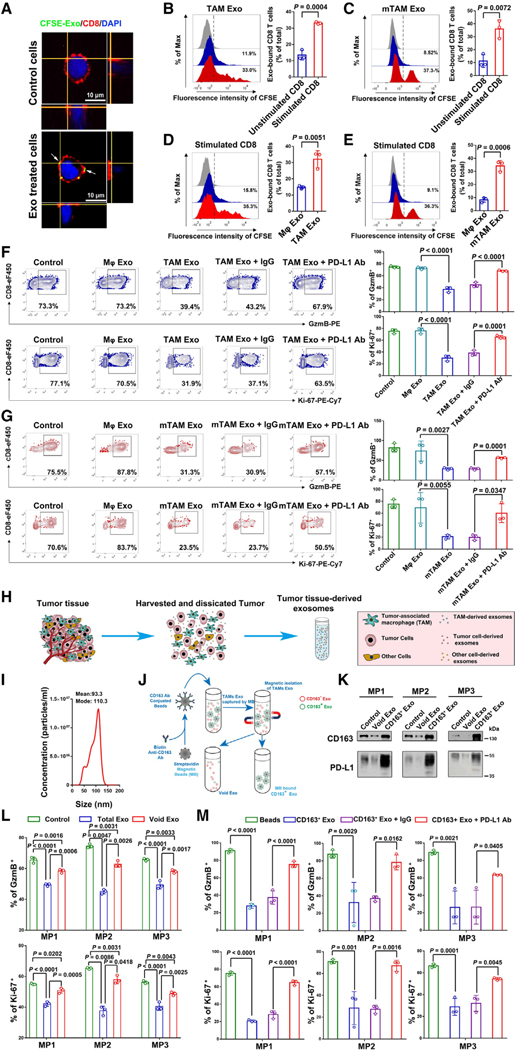
图4A:共聚焦显微镜图像显示受刺激的人CD8 T细胞(红色)与CFSE标记的TAM来源外泌体(绿色)的关联。
图4B:CFSE标记的TAM外泌体孵育后,有或没有抗CD3 /CD28抗体刺激的人CD8 T细胞流式细胞术的代表性图像。
图4C:用CFSE标记的mTAM外泌体孵育后,有或没有抗CD3 /CD28抗体刺激的小鼠CD8 T细胞的流式细胞术代表性图像。
图4D:CFSE标记的Mφ-或TAM来源外泌体孵卵后,CD3/CD28抗体刺激的人CD8 T细胞流式细胞术的代表性图像。
图4E:用cfse标记的Mφ-或mTAM来源外泌体孵育后,CD3/CD28抗体刺激小鼠CD8 T细胞的流式细胞术代表性图像。
图4F:经指示治疗后人外周血CD8 T细胞Ki-67和GzmB表达的代表性直方图。
图4G:小鼠CD8 T细胞经指示治疗后Ki-67和GzmB表达的代表性直方图。
图4H:黑色素瘤患者肿瘤组织来源外泌体的分离示意图。
图4I:通过NTA检测黑色素瘤患者肿瘤组织纯化的外泌体。
图4J:磁珠从肿瘤组织来源的外泌体中去除CD163+外泌体的示意图。
图4K:Western blot分析从3例代表性黑色素瘤患者(MP)肿瘤样本中纯化的总外泌体(Control)、剩余外泌体(Void)和CD163+外泌体中CD163和PD-L1的表达。
图4L:RT-PCR检测总外泌体(total Exo)和CD163对受刺激的CD8 T细胞的抑制去除了三例黑色素瘤患者(MP1、MP2和MP3)肿瘤样本中的外泌体(Void Exo)中GzmB和Ki-67的表达水平。
图4M:RT-PCR检测CD163+外泌体处理后GzmB和Ki-67表达阳性的CD8 T细胞的定量分析。
这些结果表明,CD163+ TAM衍生的外泌体是黑色素瘤组织中CD8+ T细胞抑制作用的重要贡献者。
5.PD-L1阴性肿瘤细胞通过巨噬细胞外泌体PD-L1抑制CD8 T细胞
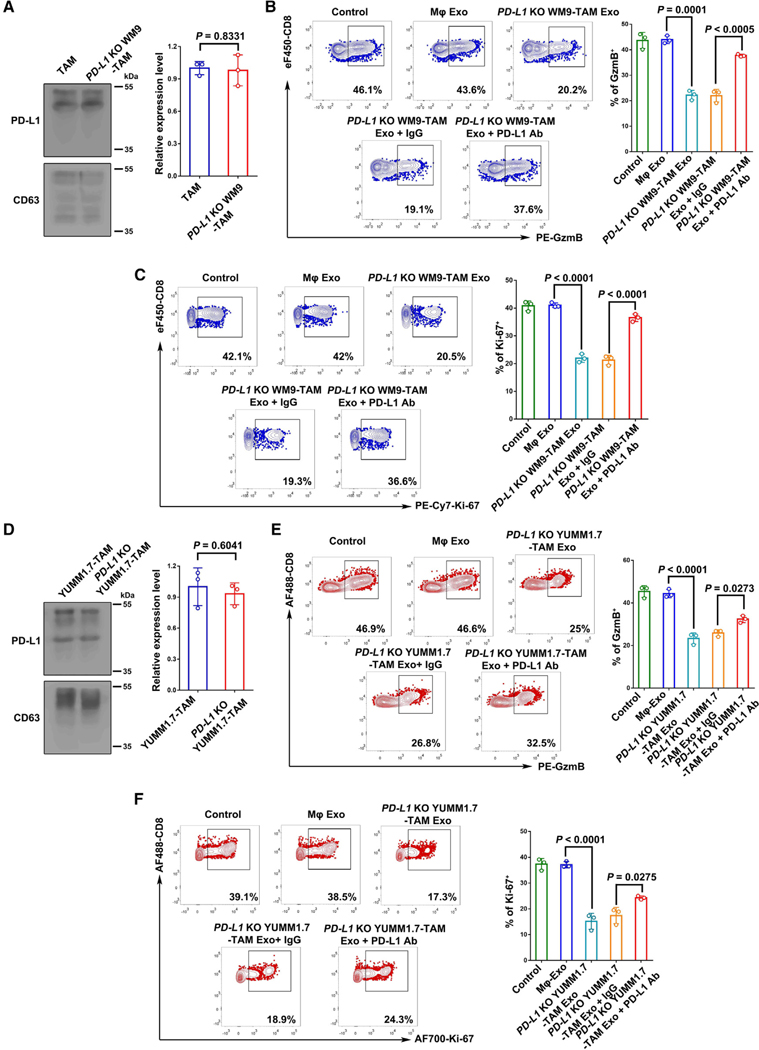
图5A:Western blot分析WM9细胞(TAM)和PD-L1 KO WM9细胞(PD-L1 KO WM9-TAM)诱导的TAM外泌体中PD-L1、CD63的表达。
图5B-C:流式细胞术显示治疗后表达GzmB (B)和Ki-67 (C)的CD8 T细胞百分比。
图5D:Western blot分析YUMM1.7细胞(YUMM1.7- TAM)和PD-L1 KO YUMM1.7细胞(PD-L1 KO YUMM1.7- TAM)诱导的mTAMs外泌体中的PD-L1。
图5E-F:流式细胞术显示治疗后表达GzmB (E)和Ki-67 (F)的CD8 T细胞百分比。
这些结果表明,在TAMs外泌体中PD-L1的上调与相应肿瘤细胞中PD-L1的表达无关。外泌体PD-L1在TAMs外泌体上的表达提示了PD-L1阴性肿瘤细胞通过TAMs外泌体PD-L1抑制CD8+ T细胞活化的机制。
6.TAM外泌体抑制小鼠抗肿瘤免疫
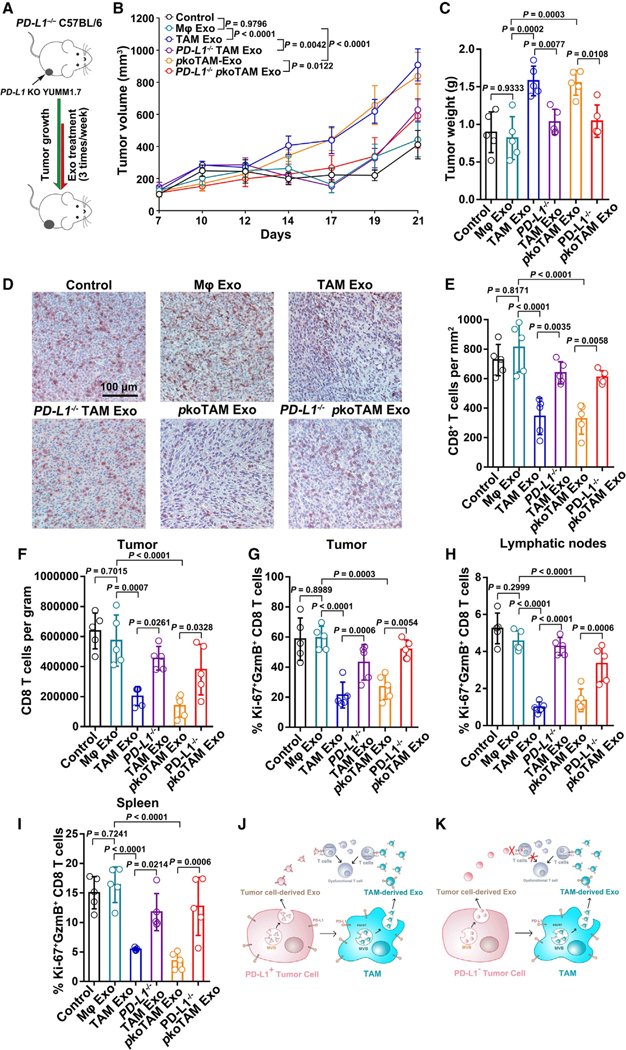
图6A:PD-L1 KO YUMM1.7肿瘤外泌体治疗PD-L1−/−C57BL/6小鼠模型。
图6B:PD-L1 KO YUMM1.7肿瘤在PD-L1−/−C57BL/6小鼠体内的生长曲线。
图6C:经指示治疗的小鼠肿瘤重量。
图6D:肿瘤组织中CD8+ TILs的代表性免疫组化图像。
图6E:每mm2中CD8+ TILs的数量通过免疫组化分析进行量化。
图6F:流式细胞术定量每克肿瘤中CD8+ TILs的数量。
图6G:流式细胞术定量Ki-67+GzmB+ CD8 TILs的百分比。
图6H-I:用流式细胞术测定淋巴结(H)和脾脏(I)中Ki-67+ GzmB+ CD8 T细胞的百分比。
图6J-K:图示表明,PD-L1+肿瘤细胞不仅利用自身的外泌体攻击CD8 T细胞,而且还将巨噬细胞重编程为TAMs, TAMs分泌大量携带更高水平PD-L1的外泌体来抑制CD8+ T细胞(J)。PD-L1−肿瘤细胞也可以诱导TAMs分泌PD-L1外泌体来抑制CD8+ T细胞(K)。
7.RAB27A在TAMs中的表达与CD8+ T细胞肿瘤浸润呈负相关
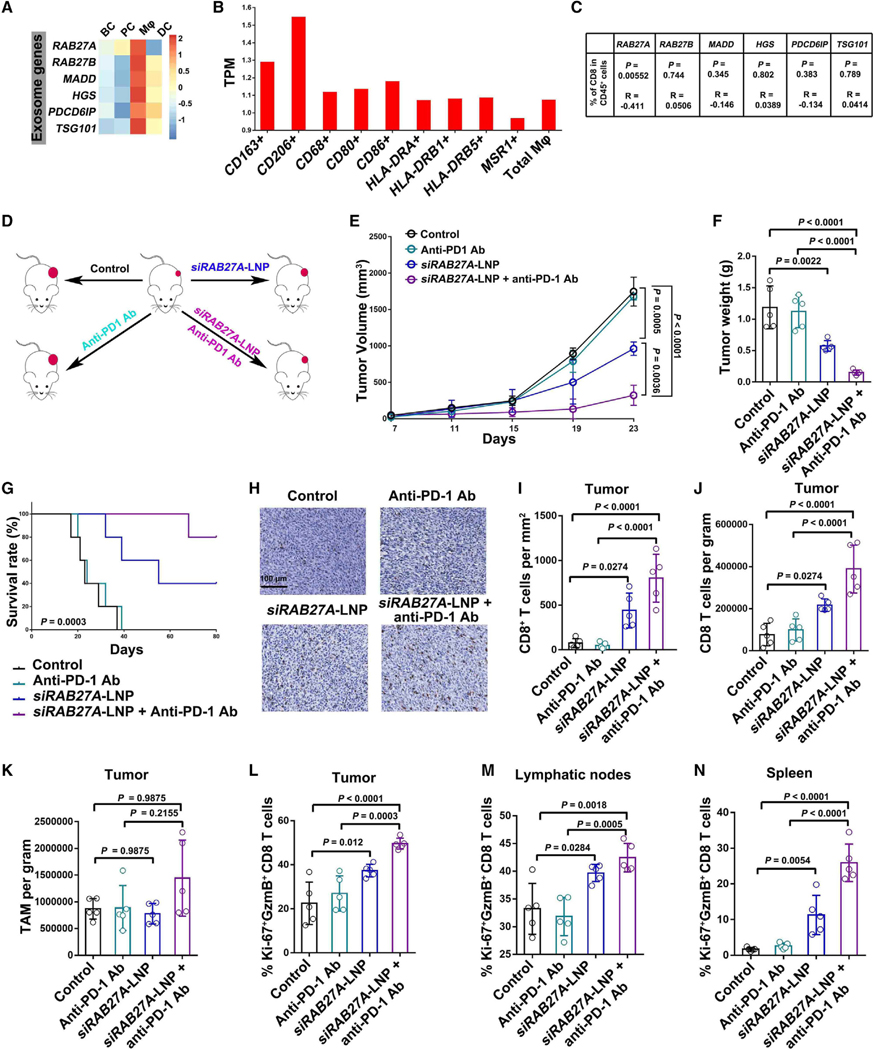
图7A:热图显示RAB27A、RAB27B、MADD、HGS、PDCD6IP和TSG101在B细胞(BCs)、浆细胞(PCs)、单核/巨噬细胞(TAM)和树突状细胞(DCs)四种细胞簇中的按比例表达值。
图7B:RAB27A在表达CD163、CD206、CD68、CD80、CD86、HLA-DRA、HLA-DRB、HLA-DRB5、MSR等不同标记物的巨噬细胞中的表达水平。
图7C:Spearman相关分析显示,黑色素瘤活检巨噬细胞中RAB27A的表达状态与CD8 T细胞占总CD45+免疫细胞的比例有显著相关性。
图7D:采用YUMM1.7细胞建立C57BL/6小鼠模型,并按指示处理。
图7E:不同治疗方法小鼠YUMM1.7肿瘤的生长曲线。
图7F:经指示治疗的小鼠YUMM1.7肿瘤的重量。
图7G:各组小鼠的生存曲线。
图7H:肿瘤组织中CD8+ TILs的代表性免疫组化图像。
图7I:免疫组化分析各组小鼠CD8+ TILs的数量。
图7J:流式细胞术定量每克肿瘤中CD8+ TILs的数量。
图7K:流式细胞术定量各组F4/80+ TAMs数量。
图7L:流式细胞术定量Ki-67+ GzmB+ CD8 T细胞的百分率。
图7M:流式细胞术定量Ki-67+ GzmB+ CD8 T细胞的百分率。
图7N:流式细胞术定量Ki-67+GzmB+ CD8 T细胞的百分率。
总结
该研究初步揭示了TAMs独特的外泌体分泌特性,这些外泌体通过携带免疫检查点分子,有效地抑制了抗肿瘤免疫反应。此外,该研究还提供了肿瘤细胞如何借助TAMs源性细胞外囊泡作为“代理人”来抑制CD8 T细胞的机制,为改善免疫检查点阻滞疗法提供了潜在的策略。值得思考的是,鉴于肿瘤微环境的重要作用,该研究启发我们将外泌体的研究推广到肿瘤细胞以外的其他间质细胞。






