研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Cell Death Disease】9分,circSKA3在细胞内的特异性保留通过减弱泛素化和SLUG的降解促进结直肠癌转移
1153 人阅读发布时间:2024-02-28 11:23
近年来,环状RNAs (circRNAs)被认为是重要的表观遗传调控因子,参与多种肿瘤生物学过程,如细胞增殖、凋亡、自噬、血管生成、能量代谢、免疫监视、迁移和侵袭。通常,CircRNAs是通过亲本基因转录后的反剪接产生的。CircRNAs的生物学作用包括:海绵miRNAs、与功能性RNA结合蛋白(RBP)结合、逆转录后形成假基因、调节细胞核内基因转录或RNA剪接,甚至编码多肽等。

湾湾今天分享一篇发表在【Cell Death Disease】上题为“Specific intracellular retention of circSKA3 promotes colorectal cancer metastasis by attenuating ubiquitination and degradation of SLUG”的研究,在本研究中,研究了circSKA3在CRC转移中的生物学作用和分子机制,并探讨了circSKA3在CRC细胞内保留的调控。此外,还设计合成了靶向circSKA3的特异性反义寡核苷酸(ASOs)来干预结直肠癌的转移,这可能成为未来治疗癌症的新药物。
研究结果
1.CircSKA3在结直肠癌组织中表达升高,但在结直肠癌患者的血清外泌体中表达降低
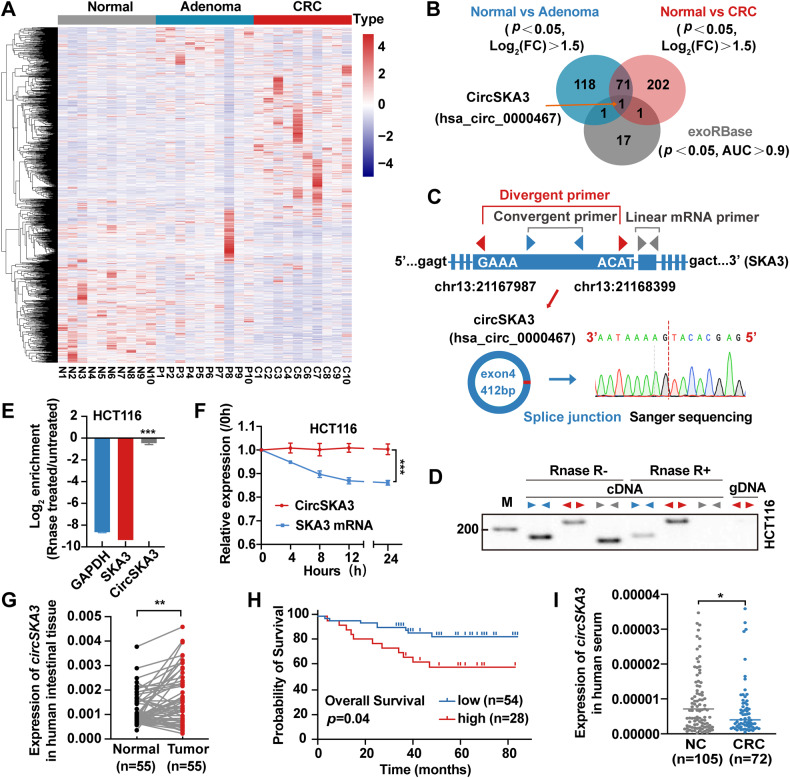
图1A:10对正常肠黏膜腺瘤/腺癌组织样本的CircRNAs测序热图。
图1B:GEO数据库中AUC>0.9的CRC患者的CRC、腺瘤和血清外泌体中CircRNAs上调的Venn图。
图1C-D:采用不同引物和RNase R处理的RT-PCR方法,明确了circSKA3在HCT116细胞cDNA和gDNA中的头尾剪接
图1E:通过RNase R处理和RT-qPCR评估HCT116中circSKA3和线性SKA3的稳定性。
图1F:Dactinomycin对HCT116细胞circSKA3和SKA3 mRNA稳定性的评价。
图1G:RT-qPCR检测55对正常和结直肠癌样本中circSKA3的表达水平。
图1H:根据circSKA3表达水平对结直肠癌患者总生存率进行K-M生存分析。
图1I:105例正常人和72例结直肠癌患者血清中circSKA3的检测。
2.CircSKA3促进结直肠癌细胞迁移、侵袭和转移
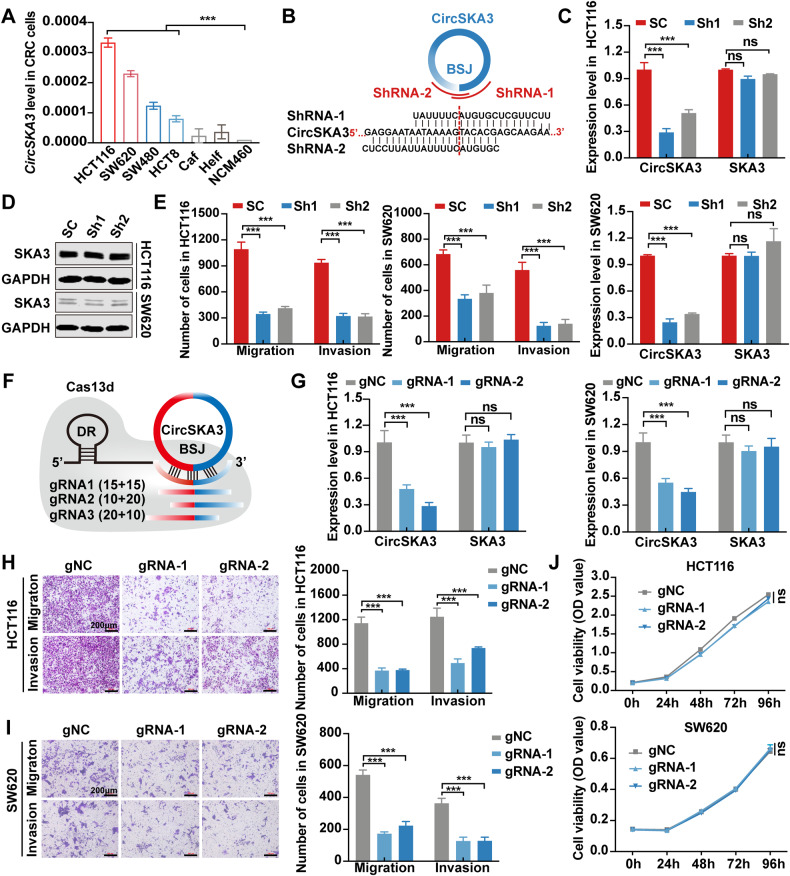
图2A:circSKA3在结直肠癌细胞系中的表达。
图2B:靶向circSKA3 BSJ位点的shRNA序列示意图设计。
图2C:在HCT116和SW620细胞中通过shRNA敲低circSKA3。
图2D:Western blot检测circSKA3敲除后宿主基因SKA3蛋白水平。
图2E:Transwell法分析circSKA3敲除后HCT116和SW620细胞的迁移和侵袭能力。
图2F:circSKA3 BSJ位点的sgRNA设计原理图。
图2G:RfxCas13d-BSJ-gRNA在HCT116和SW620细胞中下调circSKA3的效率。
图2H-I:Transwell法分析RfxCas13d-BSJ-gRNA敲除circSKA3后HCT116和SW620细胞迁移和侵袭能力,右图为定量分析结果。
图2J:RfxCas13d-BSJ-gRNA敲低circSKA3对HCT116和SW620细胞增殖的影响。
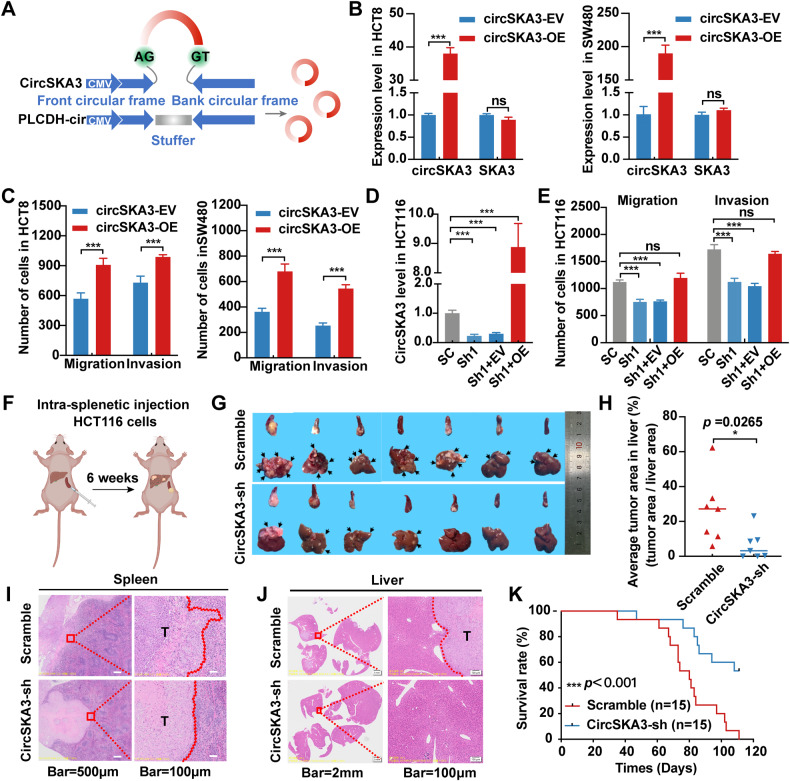
图3A:基于pLCDH-ciR载体构建circSKA3过表达质粒示意图。
图3B:慢病毒表达载体在HCT8和SW480细胞中过表达circSKA3。
图3C:Transwell法分析circSKA3过表达后HCT8和SW480细胞的迁移和侵袭能力。
图3D:circSKA3在circSKA3敲低的HCT116细胞中过表达。
图3E:Transwell法分析circSKA3敲低HCT116细胞重新表达circSKA3后的迁移和侵袭能力。
图3F:裸鼠脾-肝转移模型构建示意图。
图3G:裸鼠脾脏和肝脏图像,箭头表示转移。
图3H:远端肝转移模型中平均肿瘤面积的定量分析。
图3I:裸鼠脾原位肿瘤HE染色。
图3J:肝转移灶HE染色。
图3K:裸鼠远处肝转移生存分析。
3.结直肠癌细胞质中保留了致癌circSKA3
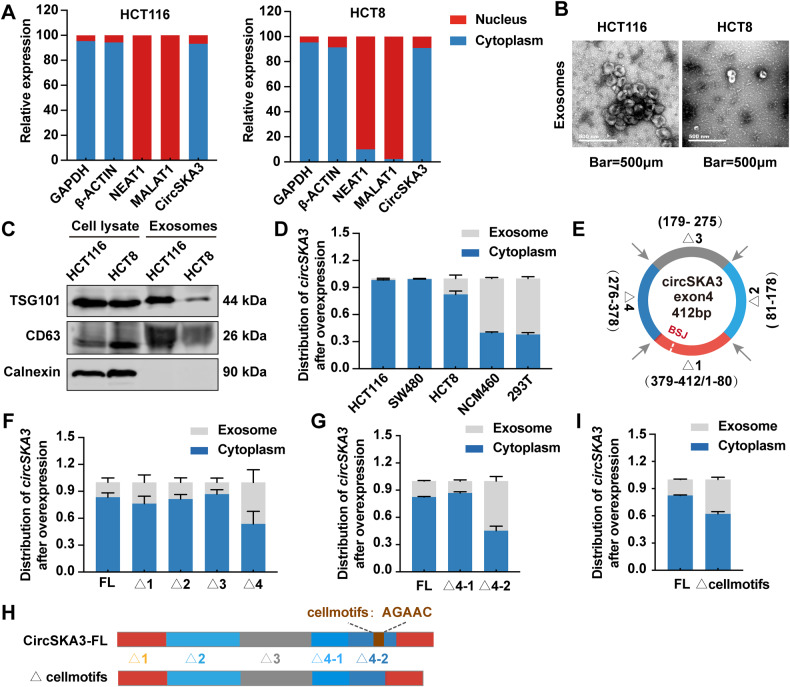
图4A:RT-qPCR检测circSKA3在HCT116和HCT8细胞中的分布。
图4B-C:透射电镜和Western blot检测HCT116和HCT8细胞中的外泌体。
图4D:转染circSKA3过表达载体的结直肠癌细胞、NCM460正常肠上皮细胞和293T细胞的外泌体分泌测定。
图4E:circSKA3截断质粒构建示意图。
图4F:截断circSKA3过表达载体(Δ1, Δ2, Δ3和Δ4)转染HCT8细胞的外泌体分泌测定。
图4G:截断circSKA3过表达载体转染HCT8细胞的外泌体分泌测定(Δ4-1和Δ4-2)。
图4H:circSKA3 FL和cellmotif (AGAAC)截断结构示意图。
图4I:转染上述两种载体的HCT8细胞外泌体分泌测定。
4.CircSKA3通过与结直肠癌中的SLUG相互作用促进上皮-间质转化(EMT)
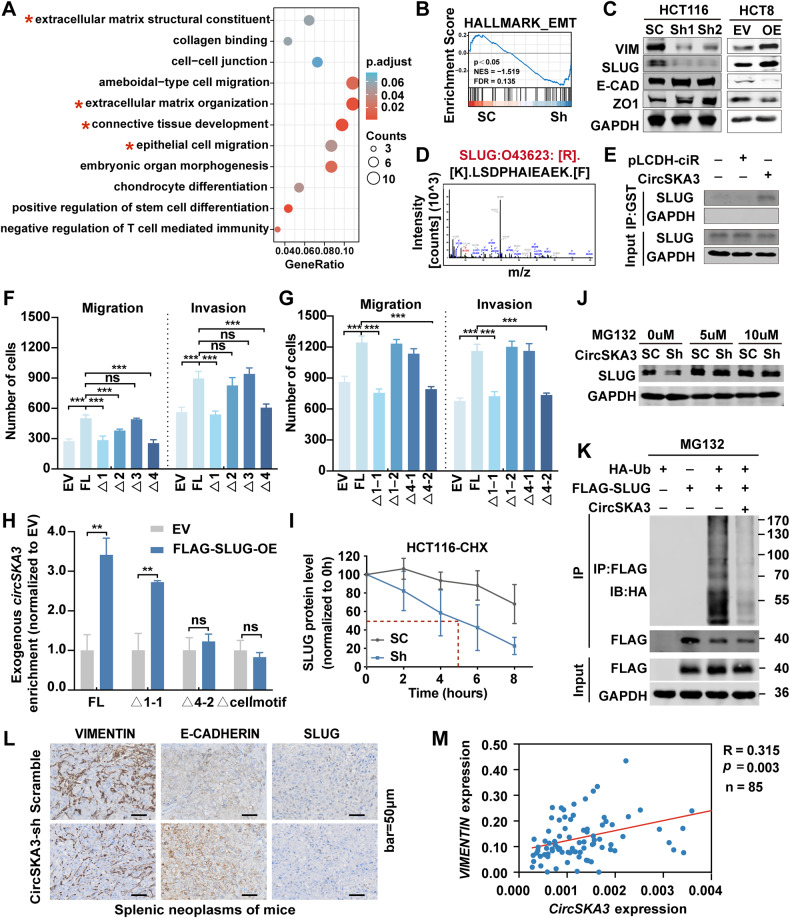
图5A:基于DAVID在线工具对差异表达基因(DEGs)进行GO富集分析,确定circSKA3调控的生物过程。
图5B:CircSKA3敲低HCT116细胞的GSEA。
图5C:Western blot检测circSKA3敲低HCT116细胞和过表达circska3的HCT8细胞中EMT相关标志物。
图5D:质谱法检测SLUG的氨基酸序列。
图5E:Western blot检测RNA pull down实验中SLUG的表达。
图5F-G:Transwell法分析过表达截断的circSKA3和FL circSKA3后,HCT8细胞迁移和侵袭能力的定量分析。
图5H:RT-qPCR检测RIP实验中FL、Δ1-1、Δ4-2和Δcellmotif-truncated circSKA3的富集情况。
图5I:对照和敲低HCT116细胞CHX处理后不同时间点SLUG蛋白水平的统计图。
图5J:Western blot检测不同浓度MG132处理的circska3敲除和对照HCT116细胞中SLUG蛋白水平
图5K:IP法检测SLUG泛素化水平。
图5L:E-CADHERIN、VIMENTIN、SLUG在结直肠癌脾-肝转移小鼠模型中的表达。
图5M:人结直肠癌样本中circSKA3和VIMENTIN mRNA水平的相关性。
5. FUS通过结合特定基序调节circSKA3的环化
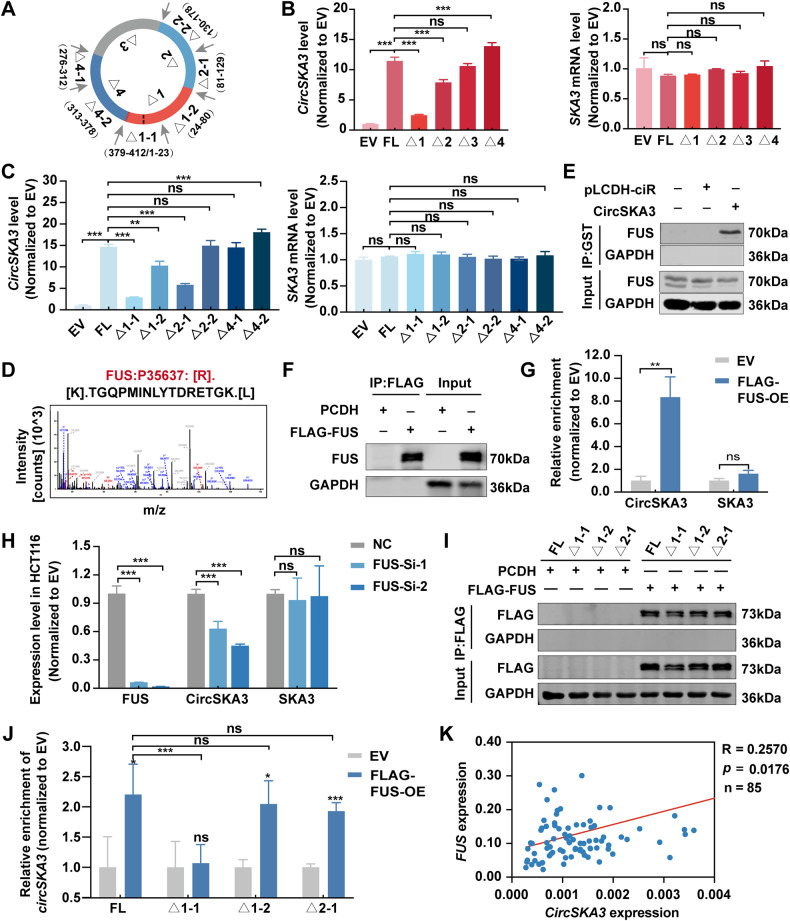
图6A:截断circSKA3质粒构建示意图。
图6B-C:CircSKA3的循环效率和线性SKA3水平。
图6D:质谱法鉴定FUS的氨基酸序列。
图6E:Western blot检测GST-RNA pull down试验中的FUS。
图6F:Western blot检测RIP实验中SLUG的表达。
图6G:RT-qPCR检测RIP中circSKA3的富集。
图6H:RT-qPCR检测FUS、circSKA3、SKA3 mRNA表达。
图6I:Western blot检测RIP中FLAG的含量。
图6J:RT-qPCR检测RIP实验中截断圆环ska3富集情况。
图6K:人结直肠癌样本中circSKA3和FUS mRNA水平的相关性。
6.靶向循环元件和细胞基序的ASOs抑制结直肠癌转移
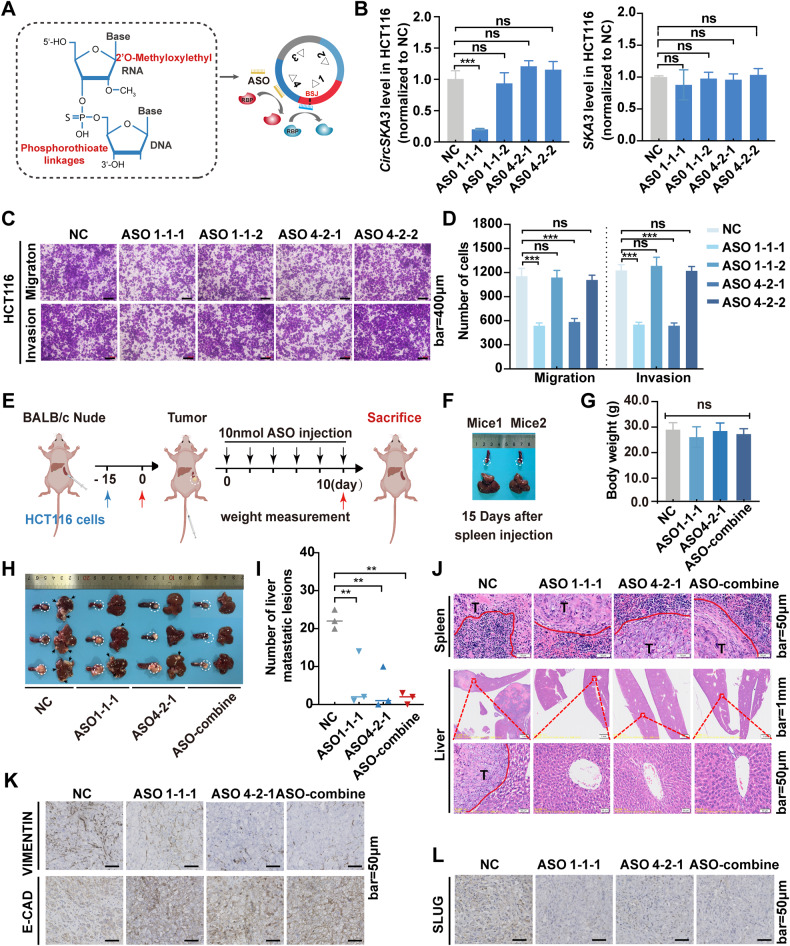
图7A:ASOs的作用机理及化学改性示意图。
图7B:circSKA3和SKA3在ASO-NC组和靶向特定circSKA3基序的ASO处理组中的表达水平。
图7C-D:Transwell实验和定量分析ASO处理的HCT116细胞的迁移和侵袭能力。
图7E:尾静脉注射ASO治疗脾肝转移模型示意图。
图7F:原位注射HCT116细胞15天后脾脏和肝脏图像。
图7G:ASO处理后裸鼠体重变化。
图7H:ASOs处理裸鼠的脾脏和肝脏图像。
图7I:远处肝转移病灶数目。
图7J:脾肿瘤及肝转移灶的HE染色。
图7K-L:异种移植瘤ASO治疗后E-CADHERIN、VIMENTIN及SLUG的表达。
总结
综上所述,CRC细胞可能通过特定的细胞基序将circSKA3保留在细胞质中抑制外泌体分泌,细胞内circSKA3可阻断SLUG泛素化降解,促进CRC转移。此外,针对circSKA3的关键循环元件和功能基序的特异性ASO可能成为CRC的治疗药物







