研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Advanced Science】15+,血管生成-成骨耦合骨修复的外泌体mRNAs
1514 人阅读发布时间:2024-02-06 10:20
骨损伤,特别是严重尺寸的缺陷是无法自我愈合的,需要骨科手术和治疗。骨组织工程(BTE)策略如生长因子和干细胞疗法在临床试验中得到了广泛的探索。一些生长因子,如重组人骨形态发生蛋白(rhBMPs)和血小板衍生生长因子(PDGF)已被批准在美国和欧洲使用。然而,这些分子的临床和临床前疗效令人失望,并且不良副作用导致临床使用受到严格限制甚至退出市场。骨科缺乏理想的再生疗法,使得目前的组织工程策略难以满足患者的需求。

湾湾今天分享一篇发表在【Advanced Science】上题为“Exosomal mRNAs for Angiogenic–Osteogenic Coupled Bone Repair”的研究,该研究报告了一种基于市售轨迹蚀刻膜(TM- nanoEP)简单且易于获取的细胞纳米电穿孔系统,该系统可以产生大量的sEVs,其中含有用于骨组织再生的治疗性mRNAs。通过将BMP‐2和VEGF‐a质粒混合物传递到人脂肪源性间充质干细胞(hAdMSCs)中,优化的人骨形态发生蛋白2 (BMP‐2)和人血管内皮生长因子a (VEGF‐a) mRNAs在sEVs中的偶联产生的协同血管生成-成骨效应比使用合成mRNA/LNP配方强得多。作者进一步证明,质粒转染增强了sEVs中与转录mRNAs相关的某些天然miRNAs的表达。在定制的可注射聚乙二醇化聚甘油癸酸酯丙烯酸酯(peg‐a)水凝胶中,将这些治疗性sEVs(t‐sEVs)与富集的外泌体mRNAs和相关miRNAs一起递送,可以实现治疗药物的局部和可控释放,从而在具有挑战性的股骨临界尺寸缺陷的大鼠中实现有效的骨再生。
研究结果
1.基于轨道蚀刻膜的纳米电穿孔(TM-nanoEP)大规模生产治疗性细胞外囊泡(sEVs)
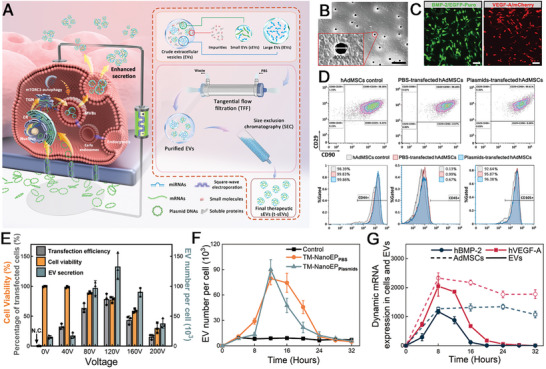
图1A:TM-nanoEP工艺用于生产携带治疗性核酸的sEVs的示意图。
图1B:轨迹蚀刻膜的扫描电子显微镜(SEM)图像。
图1C:hAdMSCs与表达人BMP - 2 (BMP2/EGFP - Puro)和表达人VEGF - A (VEGF - A/mCherry)的EGFP -透明蚀刻膜粘附在一起的荧光显微镜图像。
图1D:MSCs定义标记CD29+/CD44+/CD45-/CD90+/CD105+的流式细胞术图谱用于鉴定TM-nanoEP过程后hAdMSCs的表型。
图1E:转染效率、细胞活力和表达EGFP/Puro‐的质粒在不同电压下电穿孔hAdMSCs后的EV产量。
图1F:每4 h收集和更换介质时EV释放的动态曲线(每个时间点n = 3)。在TM-nanoEP后的最初24小时内产生了显著的EV。
图1G:TM - nanoEP后亲代hAdMSCs(虚线曲线)和衍生EVs(实线曲线)中mRNA的动态谱。
2.治疗性sEVs (t-sEVs )中EVs和富集RNAs的表征
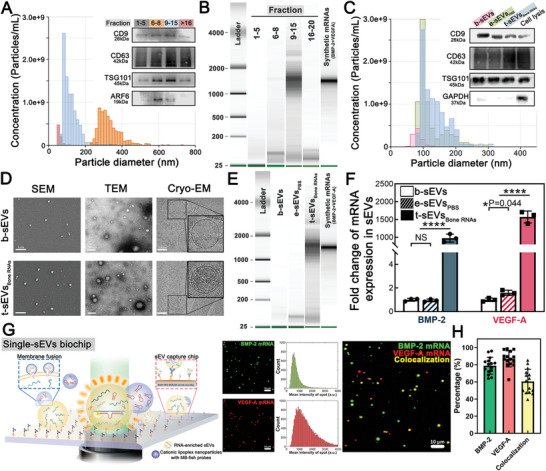
图2A:切向流过滤(TFF)和粒径隔离色谱(SEC)纯化分离后的EV亚群表面标记(CD9、CD63、TSG101和ARF6)和粒径分布。
图2B:RNA在EVs不同组分中的分布。
图2C:分离的空白sEVs (b‐sEVs )、工程sEVs (sEVsPBS)和治疗性sEVs (t‐sEVsBone RNAs)的粒径分布和表面标记,分别由空白hAdMSCs和PBS缓冲液或骨相关pDNA混合物转染的hAdMSCs产生。
图2D:富含RNAs的b-sEVs和t-sEVsBone RNAs的扫描电镜(SEM)、透射电镜(TEM)和低温电镜(cryo-EM)图像。
图2E:1 × 1012个b‐sEVs、e‐sEVsPBS和t‐sEVsBone RNAs中的RNA数量和分布。
图2F:RT-qPCR分析BMP‐2和VEGF‐A mRNAs的结果表明,t‐sEVsBone RNAs比e‐sEVssPBS和b‐sEVs含有更多的BMP‐2和VEGF‐A mRNAs转录。
图2G:用于外泌体mRNA检测的单‐sEV生物芯片示意图和用于检测t‐sEVsBone RNAs的代表性全内反射荧光显微镜(TIRFM)图像。
图2H:t‐sEVsBone RNAs与VEGF‐A和BMP‐2 mRNAs共定位的百分比。
3.雷帕霉素复合物1 (mTORC1) -自噬轴机制靶调控t-sEV释放增强
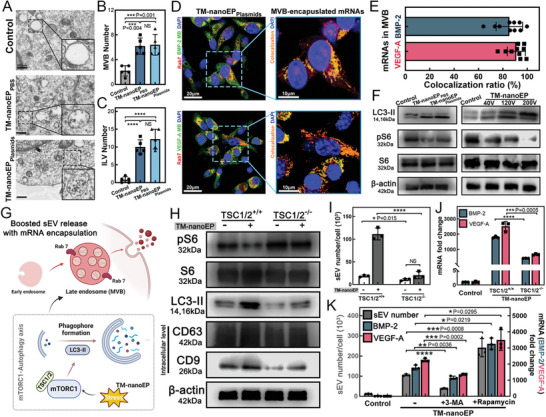
图3A:细胞电镜(Cell-EM)切片显示,与未经处理的hAdMSCs相比,有或没有质粒的TM - nanoEP刺激的hAdMSCs的多泡体(MVBs)和腔内囊泡(ILVs)发生了变化。细胞冷冻电镜切片的定量分析表明,TM-nanoEP诱导EV前体的活性。
图3B-C:MVBs和ILVs, MVB数量增加了两倍,ILV数量增加了八倍。
图3D: mRNA货物(BMP‐2和VEGF‐a)被MB‐FISH(基于分子信标的荧光原位杂交)探针识别(绿色)。荧光标记抗Rab7(红色)染色hAdMSCs的晚期核内体/MVBs。
图3E:后期核内体/MVBs中mRNAs的共定位定量。
图3F:Western blot显示TM‐nanoEP抑制mTORC1活性(phospho‐S6 (pS6)),从而激活自噬活性(轻链3‐II (LC3‐II))。增加TM-nanoEP电压导致mTORC1活性的更大降低和自噬的增强。
图3G:mTORC1 -自噬轴在TM-nanoEP调节t-sEV释放增强中的作用。
图3H:Western blot结果显示,TM-nanoEP后,宽型hAdMSCs中PS6表达受到抑制,LC3‐II表达增强,胞内sEV标记蛋白(CD63和CD9)表达显著增加。TSC1/2−/−hAdMSCs的mTORC1和自噬活性对TM - nanoEP不敏感,对sEV的释放没有影响。
图3I-J:TM‐nanoEP用质粒刺激TSC1/2+/+和TSC1/2−/−hAdMSCs, sEV数和外泌体mRNA表达。
图3K:经mTOR抑制剂雷帕霉素(400 nm)或自噬抑制剂3 -甲基腺嘌呤(3 - MA, 5 mm)预处理24小时后,经TM-nanoEP处理的hAdMSCs sEV数和mRNA表达。
4.t‐sev在体外成骨-血管成骨再生中的高效翻译
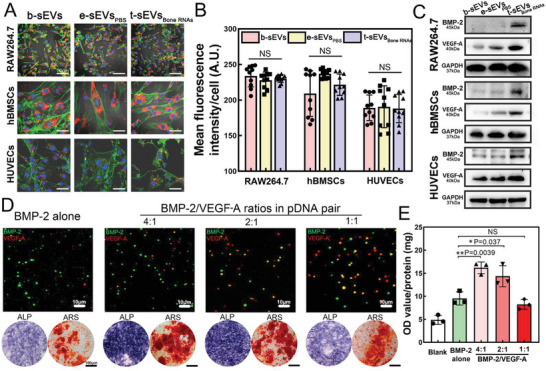
图4A:PKH26标记的sEVs在孵育24小时后被RAW264.7、hBMSCs和HUVECs内吞的代表性图像。
图4B:定量每个细胞中PKH26标记的sEVs的荧光强度。
图4C:t-sEV递送至受体细胞72小时后BMP-2和VEGF-A mRNAs的翻译。
图4D:在质粒混合物中BMP- 2/VEGF- A的不同比例的TM- nanoEP生成的t-sEVsBone RNAs的代表性TIRFM图像、碱性磷酸酶(ALP)染色和茜素红染色(ARS)对t - sEVsBone RNAs培养7天的hBMSCs。
图4E:不同sEVs的hBMSCs 7天ALP定量。
5.骨偶联mRNAs诱导的外泌体miRNAs在t-sEVs中的协同治疗作用
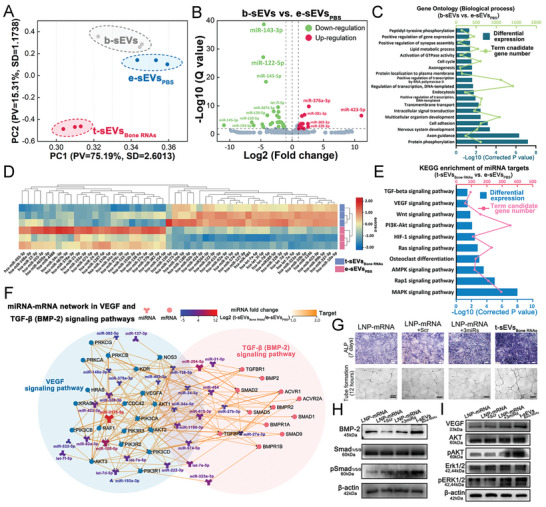
图5A:不同条件sEVs miRNAs的主成分分析(PCA)。
图5B:含TM - nanoEP和不含TM - nanoEP的hAdMSCs中sEVs差异表达miRNAs的火山图。
图5C:基因本体(GO)分析生物过程。
图5D:TM - nanoEP - PBS和TM - nanoEP -质粒作用下hAdMSCs sEVs中差异表达的microrna热图。
图5E:Top KEGG通路的信号转导和发育富集,以及与骨再生相关的再生通路。
图5F:TGF-β和VEGF信号相关miRNAs /靶mRNAs的相互作用网络。
图5G:用LNP‐mRNA、LNP‐mRNA+Scr、LNP‐mRNA+3miRs和t‐sEVsBone rna培养7天12小时,hBMSCs的碱性磷酸酶(ALP)染色(上一行)和HUVECs的管状形成(下一行)。
图5H-I:Western blot分析BMP‐2和VEGF及其下游信号通路的表达。
6.装载RNA富集t - sEVs的定制水凝胶笼在体外骨组织再生中的应用
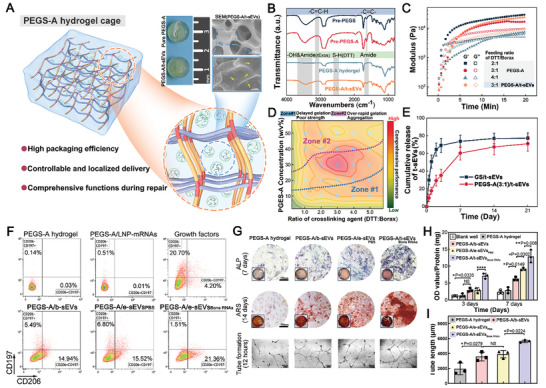
图6A:PEGS‐A水凝胶笼的示意图。
图6B:聚乙二醇预聚物、聚乙二醇-A水凝胶和聚乙二醇- A/t-sEVs的红外光谱。
图6C:不同硼砂/DTT配比下PEGS-A预聚物的流变行为。
图6D:骨组织工程PEGS‐A配方的正交分析。
图6E:凝胶海绵和PEGS-A水凝胶中t-sEVs的释放谱。
图6F:RAW 264.7与纯水凝胶、LNPs/合成mRNAs、生长因子(rhVEGF‐A和rhBMP‐2)、PEGS‐A/b‐sEVs、PEGS‐A/e‐sEVsPBS和PEGS‐A‐t‐sEVsBone RNAs共培养72小时的M1和M2极化百分比。
图6G:rBMSCs的碱性磷酸酶(ALP)染色(上行)和茜素红染色(ARS)(第二行),以及用纯水凝胶、PEGS‐A/b‐sEVs、PEGS‐A/e‐sEVsPBS和PEGS‐A‐t‐sEVsBone RNAs培养HUVECs 7、14天和12小时
图6H-I:定量分析在PEGS‐A/sEVs水凝胶作用3、7天和12小时后,rBMSCs的ALP活性和HUVECs的管状形成。
7.可注射水凝胶笼中骨RNA富集sEVs在具有临界大小股骨缺损的大鼠体内的实验证明
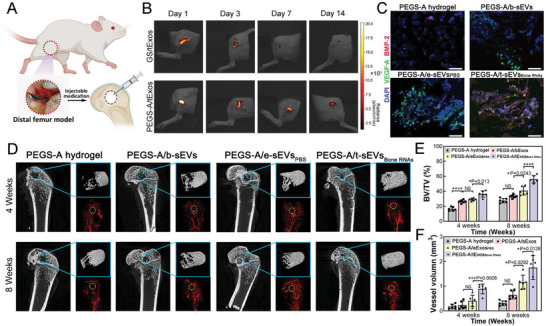
图7A:大鼠股骨缺损的注射治疗示意图。
图7B:在分娩后第1天、第3天、第7天和第14天,植入明胶海绵或注射含有PKH26标记sEVs的PEGS-A水凝胶的大鼠的体内荧光成像.
图7C:注射后第7天,纯水凝胶、PEGS‐A/b‐sEVs、PEGS‐A/e‐sEVsPBS和PEGS‐A/t‐sEVsBone RNAs中细胞的荧光图像,用VEGF‐A(绿色)和BMP‐2(红色)免疫染色。
图7D-F:在第4周和第8周,从股骨缺损重建和新骨和血管形成的插图中获得微CT图像。纯PEGS‐A水凝胶组和PEGS‐A/sEVs组治疗4周和8周后骨体积/总体积(BV/TV)和血管体积的形态计量学分析。
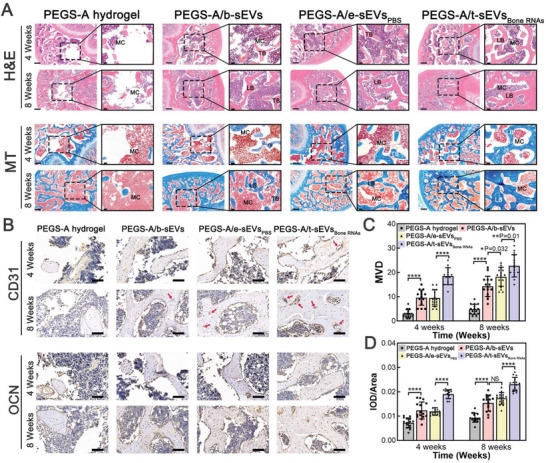
图8A:注射后第4、8周HE和MT染色对再生骨切片进行组织学评价。黑色边框显示缺陷部位的高分辨率图像。
图8B:注射后第4、8周CD31、OCN免疫组化染色。
图8C-D:定量分析微血管密度(MVD)和积分光密度(IOD)/阳性信号面积。
结论
值得注意的是,根据缺陷或骨折的性质和尺寸,这些估计值可能会有很大的波动。确定用于人类患者的t-EVs的最佳剂量应包括在较长时间内进行广泛监测,并在临床试验中观察再生结果。无论具体情况如何,设计高通量细胞转染技术和扩大sEV生产工艺仍然是必不可少的。在该论文中,作者发现了mTORC1 -自噬轴在通过TM - nanoEP诱导治疗性EVs中的关键作用。通过用雷帕霉素或其他mTORC1抑制剂/增强剂预处理亲本细胞,可以扩增sEVs的产生并调节TM - nanoEP后治疗性mRNAs的包封。这种组合方法显示出进一步提高高mRNA负载t - sEVs产量的潜力。
综上所述,可以相信TM-nanoEP诱导的t- sEVs不仅有望用于未来的骨再生治疗,而且还有望成为治疗其他疾病的新方法。






