研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Advance Science】15+,用STING激活的嵌合外泌体用于个性化胶质母细胞瘤免疫治疗
1047 人阅读发布时间:2024-04-16 13:19
现有癌症疫苗的一个关键挑战是在抗原呈递细胞(APCs)内协调抗原富化供给和最佳抗原呈递功能的需求。湾湾今天分享一篇发表在【Advance Science】上题为“Chimeric Exosomes Functionalized with STING Activation for Personalized Glioblastoma Immunotherapy”的研究,该研究开发了一种互补的免疫治疗策略,使用树突状细胞(DC) -肿瘤混合细胞衍生的嵌合外泌体装载干扰素基因刺激剂(STING)激动剂(DT‐Exo‐STING),以最大化肿瘤特异性T细胞免疫。

利用DC-肿瘤嵌合外泌体和外源性CDN驱动的STING激活,构建了一个互补的免疫治疗平台,以最大限度地提高肿瘤特异性T细胞免疫。与现有的CDN递送技术相比,这些嵌合纳米囊泡具有为双T细胞激活提供广谱肿瘤抗原复合物、细胞内递送STING激动剂以增强抗原呈递及具有卓越的BBB交叉能力的优势。
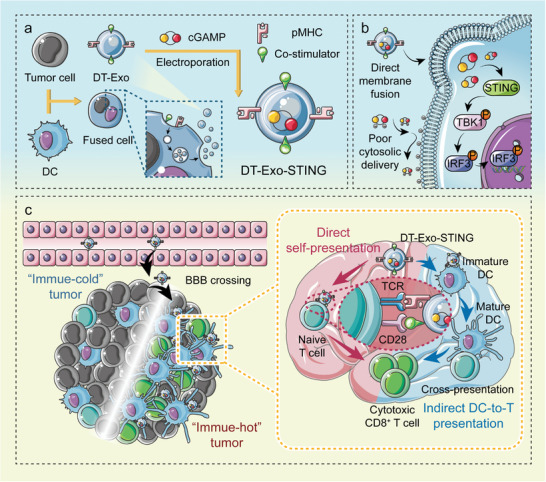
研究结果
1.DT‐Exo‐STING的制备与表征
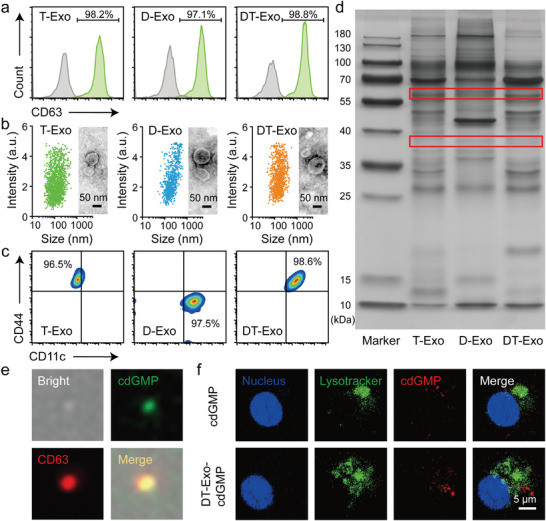
图1a:流式细胞术检测T‐Exos、D‐Exos和DT‐Exos中CD63的表达的结果。
图1b:T‐Exos, D‐Exos和DT‐Exos的TEM图像和尺寸分布。
图1c:流式细胞术检测抗CD44标记的T-Exos、抗CD11c标记的D-Exos和双抗体标记的化学DT-Exos的结果图。
图1d:T‐Exos、D‐Exos和DT‐Exos的SDS‐PAGE蛋白分析。
图1e:将荧光标记的CDN (cdGMP‐Dy547)装载到DT‐Exos(DT‐Exo‐cdGMP)中,成像流式细胞术测定CDN 在DT‐Exos中的包封性。
图1f:cdGMP‐Dy547和cdGMP‐Dy547负载的DT‐Exos孵育4小时后cdGMP‐Dy547在dc内分布的共聚焦激光扫描显微镜图像。
2. 嵌合外泌体纳米疫苗诱导双T细胞活化
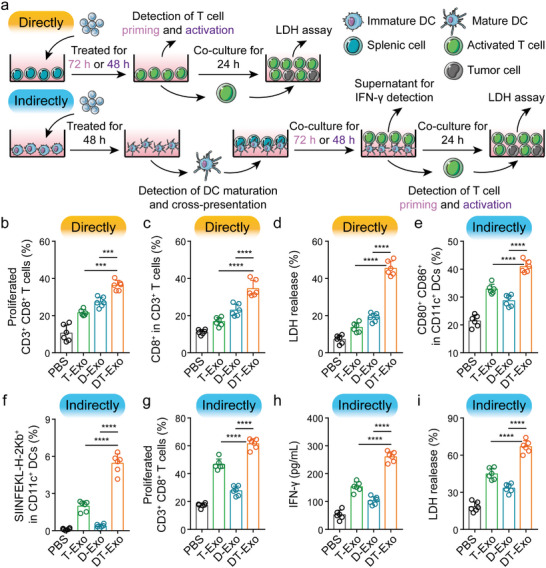
图2a:(b至i)中双T细胞活化试验示意图。
图2b:用PBS、T‐Exos、D‐Exos和DT‐Exos直接孵育72小时后,用CFSE染色,流式细胞术定量检测脾脏CD3+CD8+ T细胞增殖。
图2c:用指定配方处理48h后CD3+CD8+ T细胞的比例。
图2d:指定配方孵育24小时后外泌体激活T细胞对GL261细胞的体外细胞毒性检测。
图2e:用PBS、T‐Exos、D‐Exos和DT‐Exos孵育48小时后,流式细胞术分析DC成熟(CD11c+CD80+CD86+)的定量评价。
图2f:与指定的外泌体纳米疫苗孵育48小时后,流式细胞术定量分析DC介导的交叉呈递(CD11c+SIINFEKL‐H‐2Kb+)。
图2g:以20:1的比例将CFSE染色的脾细胞与上述预处理的DCs共培养72小时后,CD3+CD8+T细胞的增殖百分比
图2h:各种外泌体刺激的DCs和脾细胞以1:20的比例孵育48 h后,用ELISA试剂盒测定DC-T共培养系统上清中IFN-γ的分泌情况。
图2i:经指定外泌体DC处理的脾细胞在孵育24小时后对GL261细胞的体外细胞毒性检测。
以上结果表明,DT-Exos激活的经典DC-T免疫刺激途径导致T淋巴细胞功能改善。
3.DT‐Exo‐STING在体内的组织趋向性
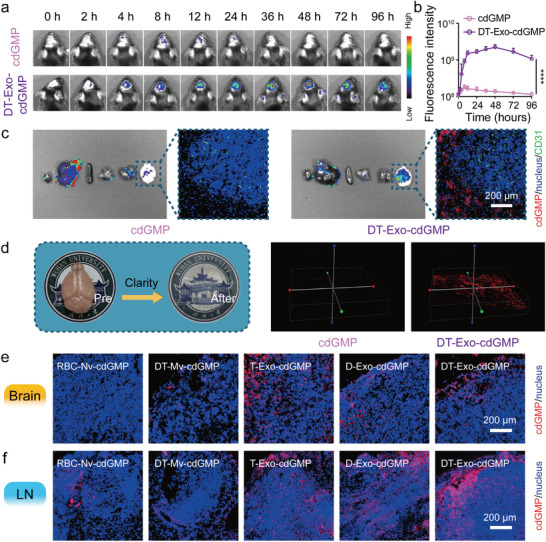
图3a-b:皮下注射含cdGMP-dy547的制剂后,在指定时间点对GL261小鼠脑区进行代表性体内荧光成像和定量。
图3c:皮下给药12小时后主要器官(心、肝、脾、肺、肾和脑)的离体荧光成像。
图3d:使用CLARITY技术对光学透明脑组织中cdGMP-Dy547负载的DT- Exos进行三维荧光成像,以显示其分布。
图3e-f:皮下注射含有cdGMP - Dy547的各种囊泡后,GL261肿瘤小鼠脑组织和颈部LNs的离体荧光图像。
4.DT‐Exo‐sting增强原位GBM模型的治疗效果
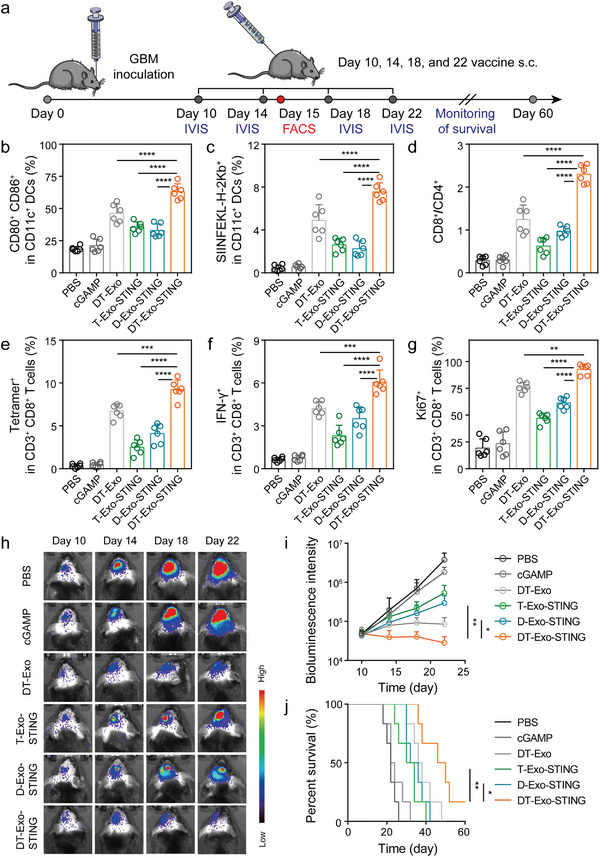
图4a:颅内GL261-OVA-Luc肿瘤小鼠的治疗方案。小鼠皮下每隔4天注射含cGAMP的制剂一次,共注射4次。
图4b:流式细胞术定量测定经指定疫苗制剂处理的小鼠颈部淋巴结成熟DCs (CD11c+CD80+CD86+)。
图4c:流式细胞术分析CD11c+SIINFEKL‐H‐2Kb+ DCs在颈淋巴结组织中的比例。
图4d:肿瘤浸润CD8+与CD4+ T细胞的比值。
图4e:流式细胞术定量分析肿瘤内CD3+CD8+ T细胞的H‐2Kb/SIINFEKL四聚体染色。
图4f:肿瘤组织中IFN‐γ+T细胞的百分比。
图4g:Ki67在肿瘤浸润性CD3+CD8+T细胞中的表达。
图4h-i:具有代表性的体内生物发光图像和神经胶质瘤小鼠在指定治疗后的量化信号强度。
图4j:用指定的癌症疫苗配方接种小鼠的Kaplan-Meier生存曲线。
5.个体化DT-Exo-STING联合ICB治疗可预防术后GBM复发
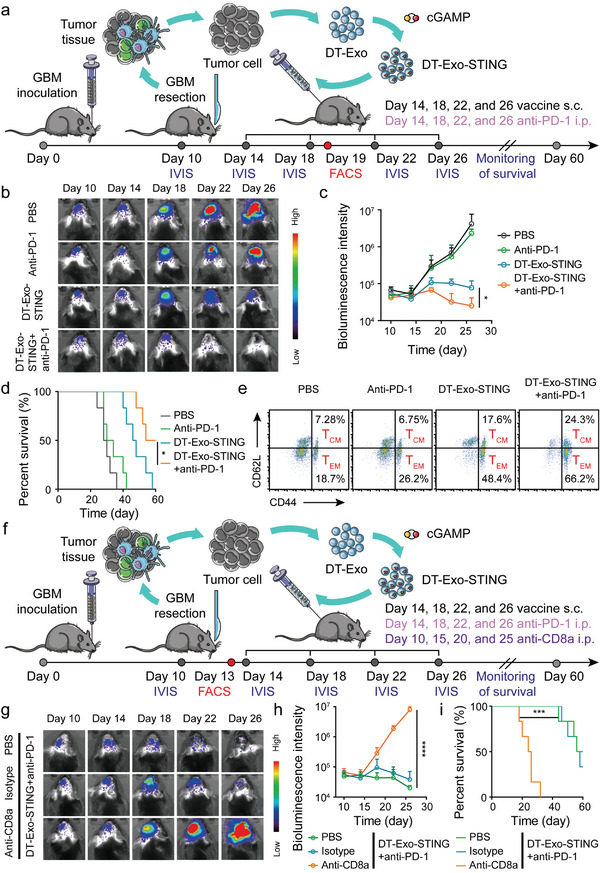
图5a:GL261‐luc负荷小鼠的术后治疗方案。小鼠在颅内GBM手术切除后,每隔4天皮下注射个体化DT-Exo- STING,腹腔注射抗PD-1抗体(ICB)一次,共注射4次
图5b-c:用指示的配方处理GL261‐luc小鼠的体内荧光成像和定量。
图5d:不同治疗后小鼠Kaplan-Meier生存分析。
图5e:在GBM肿瘤接种后第19天的外周血中TEM和TCM 代表性流点图。
图5f:基于嵌合外泌体的纳米疫苗与ICB联合治疗GBM术后复发的实验设计示意图。小鼠分别每隔4天皮下注射个体化DT - Exo - STING和腹腔注射ICB治疗一次,共4次;每隔5天腹腔注射抗CD8a或同型单克隆抗体IgG一次,共4次。
图5g-h:在嵌合外泌体纳米疫苗和ICB联合治疗之前,用抗CD8a或小鼠单克隆IgG预处理GL261-Luc负荷小鼠体内具有代表性的生物发光图像和h)生物发光信号强度的量化。
图5i:联合治疗和其他指定配方免疫小鼠的Kaplan-Meier生存曲线。
结论
利用融合引导的双亲本生物学特性整合,作者设计了一个基于DC-肿瘤嵌合外泌体的多功能纳米平台,通过CDN佐剂驱动的STING激活实现功能化。这种嵌合外泌体辅助递送策略可以发挥多方面的优点,甚至优于现有的CDN递送技术:(1)由于细胞间通信的外泌体固有特性,STING激动剂的理想胞质递送进入APCs;(2) CD8+T细胞介导的免疫刺激反应通过直接和间接的免疫激活途径,特别是在增殖能力和肿瘤杀伤活性方面的预期优化;(3)出色的组织归巢能力与分泌外泌体的DC-肿瘤杂交细胞一致,即使在顽固性血脑屏障中也如此。
值得注意的是,通过精心制作切除的肿瘤组织到这种个性化抗原呈递平台的升级方法,在一定程度上保证了活化自体肿瘤抗原反应性T细胞的可行性。作为单一疗法,局部使用这种DT‐Exo‐STING纳米疫苗可以产生全身和完全的免疫应答,甚至足以几乎消除颅内原发性或术后残留的肿瘤病灶。鉴于这种个性化疫苗策略,这种基于嵌合外泌体的治疗平台也可以提高对ICB免疫治疗的反应,在临床探索性开发中呈现出不断扩大的可能性。这种基于嵌合外泌体的传递平台的多功能性赋予了临床领域的应用前景,作为释放自身免疫系统潜力的有力工具。






