研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Bioactive Materials】18+,通过乳源性外泌体口服TNF-α siRNA有效治疗炎症性肠病
802 人阅读发布时间:2024-04-26 10:00
炎症性肠病(IBD)是一种肠道炎症性疾病,通常分为克罗恩病(CD)和溃疡性结肠炎(UC),前者伴有从口腔到肛门整个消化道的炎症跳跃病变,后者以整个结肠持续炎症为特征。IBD病因复杂,治疗困难,复发率高。鉴于IBD的主要病理表现局限于肠道组织,非靶向治疗促进全身吸收,导致副作用和疗效降低,口服给药被认为是确保药物直接递送到肠道内致病部位的最佳途径。然而,口服生物制剂,特别是RNA药物,由于其对胃肠道环境的易感性而受到阻碍;它们的大小也阻碍了它们通过肠上皮的运输。因此,需要基于配方的给药技术来提高口服生物药物的性能。

湾湾今天分享的是发表在【Bioactive Materials】上题为“Oral TNF-α siRNA delivery via milk-derived exosomes for effective treatment of inflammatory bowel disease”研究,该研究将TNF-α siRNA装载到M-Exos中,并在小鼠模型中评估其治疗结肠炎的疗效。从脂质组学的角度来看,M-Exos由于其脂质组成而表现出优异的稳定性,这与细胞来源的外泌体不同。此外,在口服给药后,M-Exo载体稳定地通过胃肠道到达结肠炎病变处,诱导TNF-α mRNA的降解。因此,M-Exos作为临床应用的口服基因传递载体具有很大的前景。特别是,TNF-α siRNA负载的M-Exos可能是IBD的有效生物治疗方式。
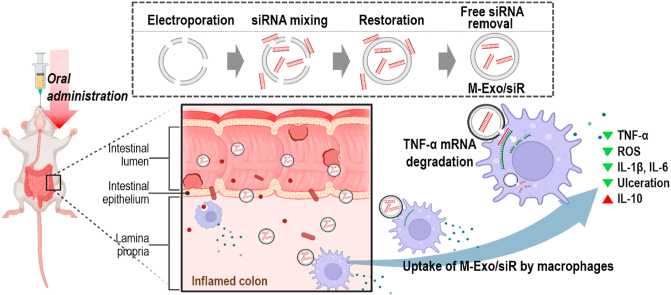
研究结果
1.M-Exos在装载时保持其结构以完成siRNA的封装
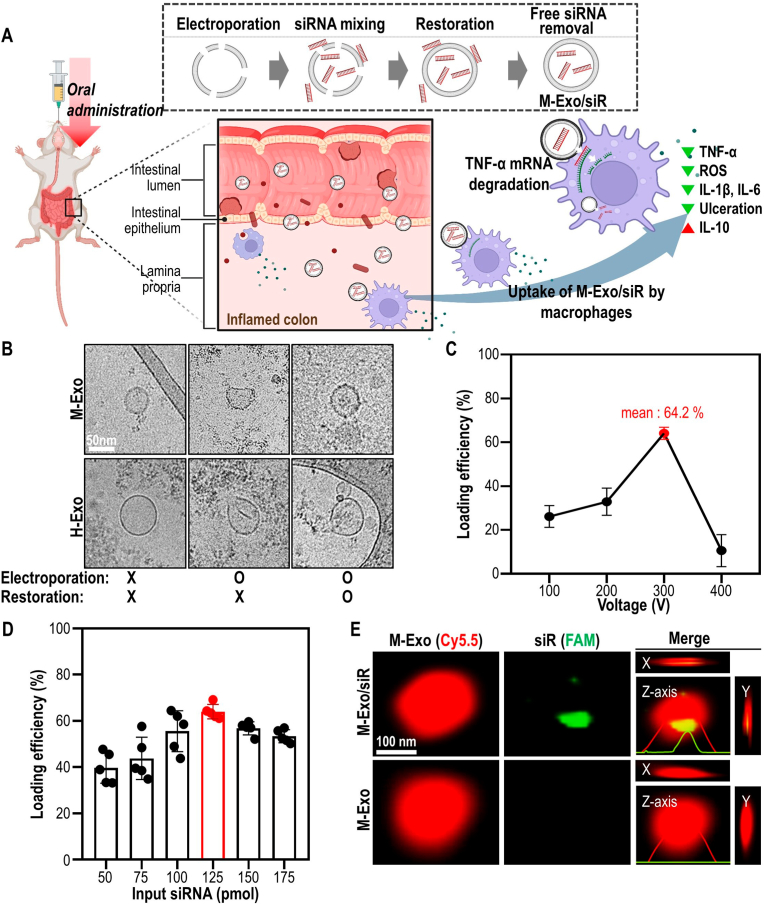
图1A:通过口服M-Exo/siR治疗结肠炎的示意图。
图1B:装载后外泌体形态的比较变化。
图1C:不同电压下TNF-α siRNA在M-Exos上的负载效率。在所有条件下M-Exos与siRNA的混合比例相同。
图1D:根据M-Exo与TNF-α的比值计算负载效率。
图1E:在M-Exo/siR的x、y和z轴方向上测量具有代表性的SRM图像。
以上结果表明,M-Exo具有适当的稳定性,可以保护包封药物免受外界刺激。
2. M-Exo/siR通过下调TNF-α改善炎症,而不诱导细胞毒性
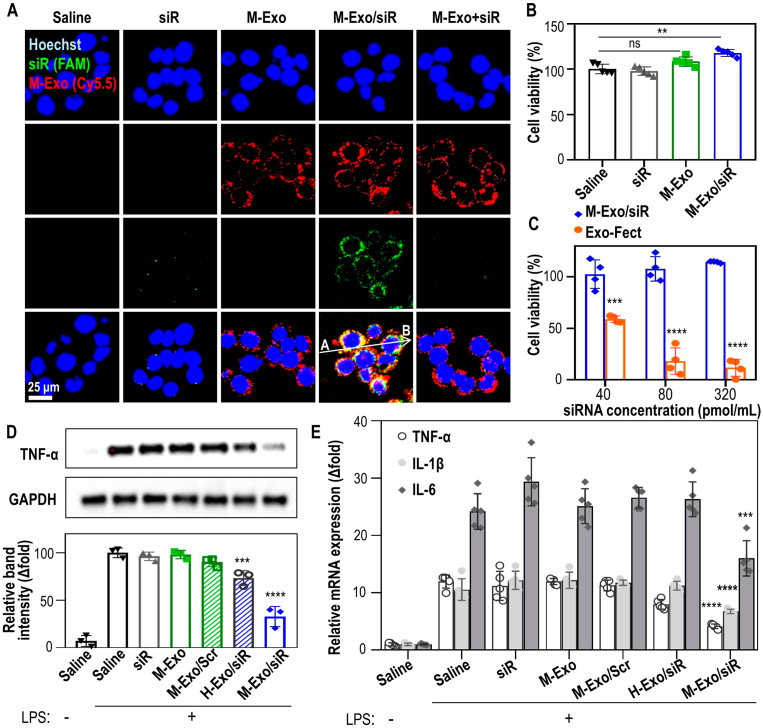
图2A:在NCM460细胞中通过M-Exo/siR传递细胞内TNF-α siRNA。
图2B:M-Exo/siR对NCM460细胞毒性的影响。
图2C:根据M-Exo/siR和Exo-Fect™浓度比较NCM460细胞活力。
图2D:M-Exo/siR对RAW264.7细胞TNF-α蛋白的下调作用。各组分别用100 ng/mL LPS处理8 h,然后用各自的物质孵育24 h。
图2E:促炎细胞因子的相对mRNA表达。各组分别用100 ng/mL LPS处理8 h,然后用各自的物质孵育24 h。
以上数据表明,M-Exo/siR的体外细胞摄取可诱导抗炎作用而不诱导细胞毒性。
3.成功的siRNA递送通过下调TNF-α表达减少结肠炎病理
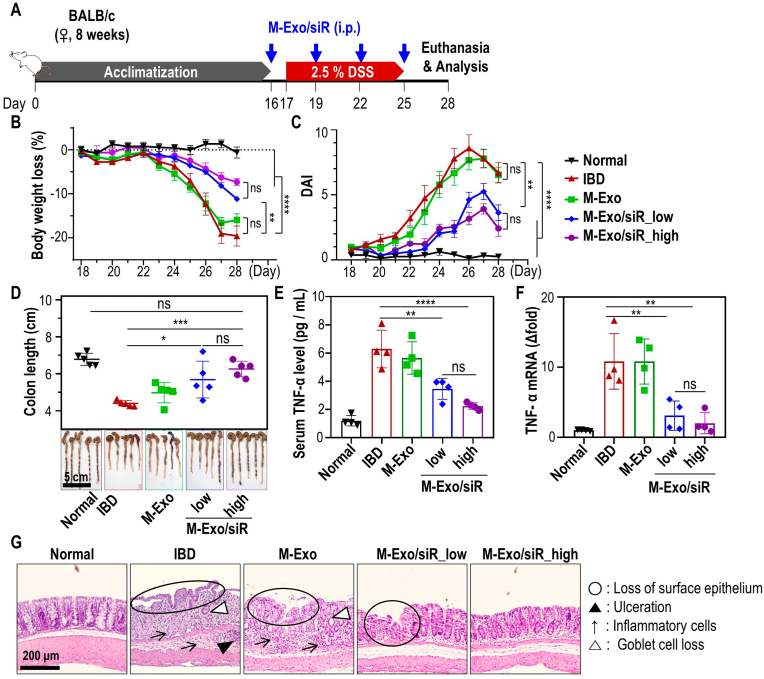
图3A:葡聚糖硫酸钠(DSS)诱导结肠炎及腹腔注射M-Exo/siR的治疗方案。驯化期结束后,8周龄雌性BALB/c小鼠从2.5% DSS给药前一天开始,每隔3天腹腔注射M-Exo/siR ,共注射4次。
图3B:注射后小鼠每日减重情况。
图3C:每日疾病活动指数(DAI)评分。
图3D:第28天有代表性的提取结肠图像和结肠长度。
图3E:第28天血清TNF-α细胞因子的表达水平。
图3F:第28天结肠炎结肠组织Tnfa mRNA的表达水平。
图3G:第28天HE染色结肠组织的代表性组织病理学图像。
以上数据表明,在DSS诱导的结肠炎模型中,M-Exos中封装的TNF-α siRNA有可能通过沉默Tnfa来功能性调节炎症。
4.口服M-Exos中的TNF-α siRNA可有效到达小鼠肠道
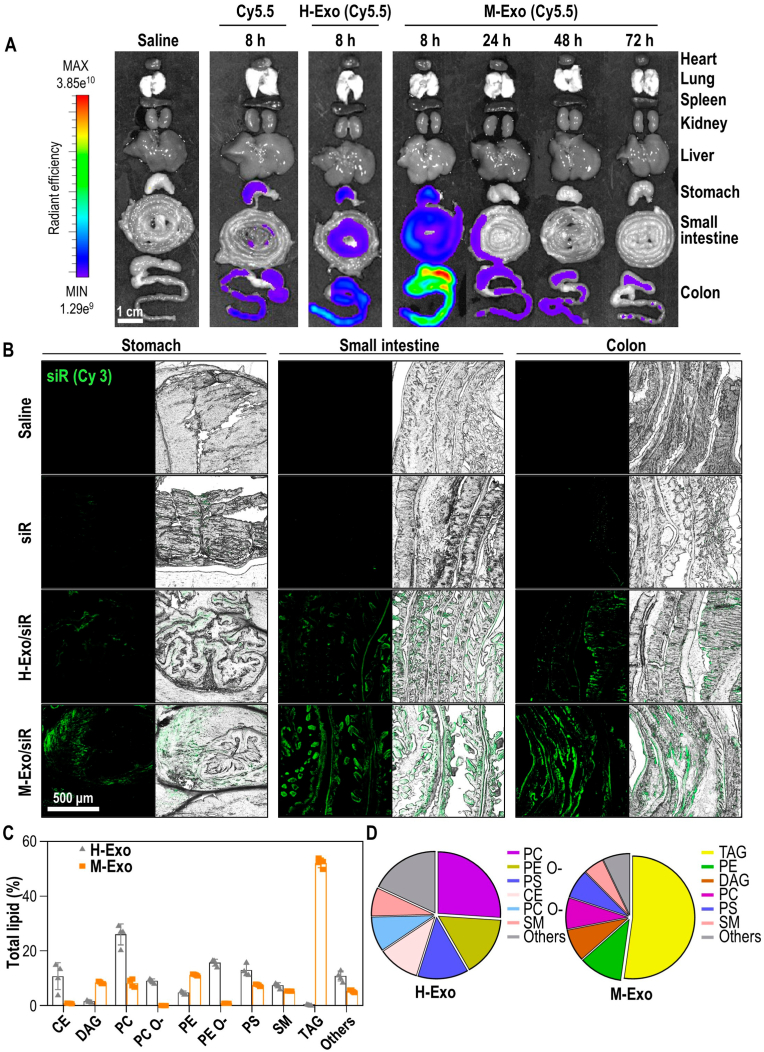
图4A:cy5.5标记M-Exos的生物分布。给8周龄雌性BALB/c口服生理盐水、cy5.5、cy5.5标记的H-Exos和cy5.5标记的M-Exos后,在8小时、24小时、48小时和72小时测量辐射效率。
图4B:cy3标记的siRNA被胃、小肠和结肠吸收的组织图像。
图4C:M-Exos与H-Exos的脂质组学分析。
图4D:构成H-Exos和M-Exos的脂质组成比例。
以上结果表明,M-Exos独特的脂质组成是胃肠道中特殊稳定性的基础。
5.口服灌胃M-Exo/siR可逆转结肠炎引起的炎症细胞因子失衡
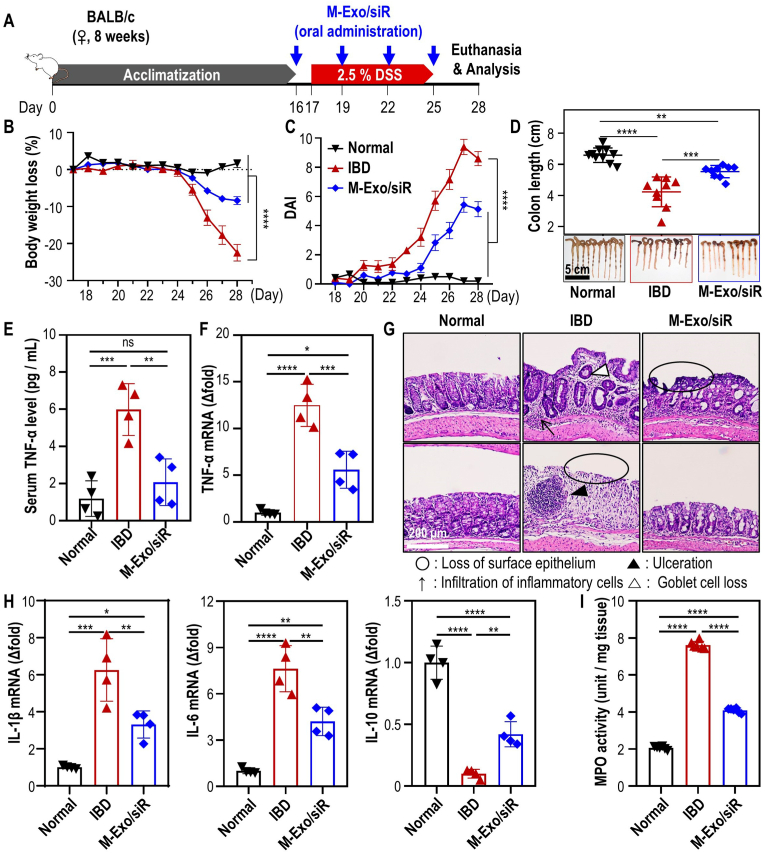
图5A:DSS结肠炎诱导及口服M-Exo/siR治疗方案。驯化期结束后,8周龄雌性BALB/c小鼠从2.5% DSS给药前一天开始,每隔3天口服一次M-Exo/siR,共口服4次。
图5B:口服后小鼠每日减重情况。
图5C:每日疾病活动指数(DAI)评分。
图5D:第28天有代表性的提取结肠图像和结肠长度。
图5E:第28天血清TNF-α细胞因子的表达水平。
图5F:第28天结肠炎结肠组织Tnfa mRNA的表达水平。
图5G:第28天HE染色结肠组织的代表性组织病理学图像。
图5H:结肠组织炎症细胞因子mRNA表达分析。
图5I:结肠髓过氧化物酶(MPO)活性。
以上数据表明,M-Exos口服TNF-α siRNA可有效且安全地治疗小鼠结肠炎模型。
结论
在这项研究中,作者证明了抑制TNF-α表达可改善IBD症状。基于这些结果,作者提出了一个基于M-Exos的新的强大平台,可以口服结肠炎基因治疗。由于M-Exo独特的膜脂组成,口服M-Exo/siR稳定地通过胃肠道到达结肠炎病变,具有优异的稳定性,并诱导小鼠炎症病变内Tnfa mRNA的降解。最终,TNF-α表达的下调降低了炎症结肠中的促炎细胞因子和ROS水平,减轻了肠结肠炎。相信该研究将对新的口服基因疗法的发展产生重大影响。此外,这种基于M-Exo的口服给药系统将被证明在包括IBD在内的各种炎症性疾病的临床治疗中有用。






