研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Int J Biol Sci】9+,肿瘤源性外泌体ENO2通过调节肿瘤相关巨噬细胞的极化促进弥漫性大B细胞淋巴瘤进展
784 人阅读发布时间:2024-05-07 13:52
弥漫性大B细胞淋巴瘤(DLBCL)是一种具有显著生物学和临床多样性的疾病,约占成人非霍奇金淋巴瘤的30%-40%。CHOP是DLBCL的最优选化疗方案。抗CD20单克隆抗体利妥昔单抗的应用显著提高了总生存率。尽管取得了这些进展,但约有20%-40%的病例治疗失败,尤其是复发和耐药患者。因此,寻找新的治疗靶点是相当重要的。

湾湾今天分享的是发表在【Int J Biol Sci】上题为“Tumor-derived Exosomal ENO2 Modulates Polarization of Tumor-associated Macrophages through Reprogramming Glycolysis to Promote Progression of Diffuse Large B-cell Lymphoma”的研究。该研究通过生物信息学分析和一系列实验研究了DLBCL来源的外泌体ENO2在DLBCL进展过程中调节巨噬细胞极化的作用和相关机制。生物信息学分析结果显示,ENO2高表达与DLBCL进展及巨噬细胞M2/M1比值呈正相关。DLBCL患者血清外泌体及DLBCL细胞中ENO2蛋白水平升高。此外,DLBCL衍生的外泌体被巨噬细胞同化,然后调节巨噬细胞的极化。体外和体内实验结果表明,DLBCL来源的外泌体ENO2调节巨噬细胞极化(M2表型增加,M1表型减少)从而促进DLBCL的增殖、迁移和侵袭。随后发现DLBCL来源的外泌体ENO2对巨噬细胞极化的调节依赖于糖酵解,并通过GSK3β/β-catenin/c-Myc信号通路促进。这些研究结果表明,DLBCL来源的外泌体ENO2通过GSK3β/β-catenin/c-Myc信号通路加速糖酵解,最终促进巨噬细胞向M2表型发展,从而促进DLBCL的增殖、迁移和侵袭,提示外泌体ENO2可能是DLBCL有希望的治疗靶点和预后生物标志物。
研究结果
1.ENO2高表达水平预示DLBCL预后不良,并与TME中巨噬细胞M2/M1比值升高相关
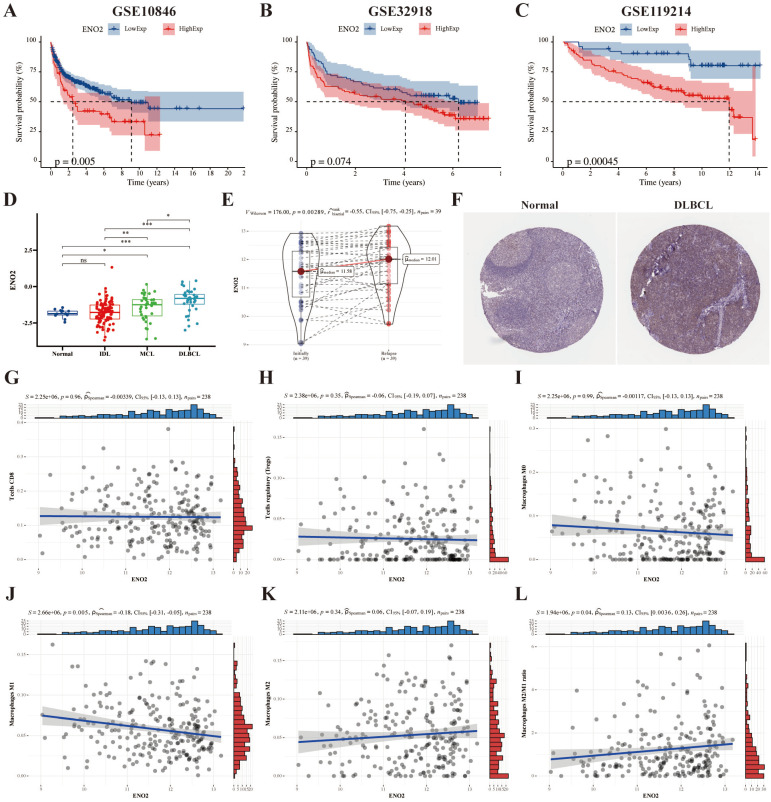
图1A-B:ENO2高或低表达的GSE10846和GSE32918队列DLBCL患者的OS Kaplan-Meier分析。
图1C:ENO2高或低表达的GSE119214队列FL患者的OS Kaplan-Meier分析。
图1D-E:ENO2在GSE9732和GSE32918队列中的表达特征。
图1F:来自人类蛋白质图谱的代表性ENO2 IHC染色图像。
图1G-L:ENO2表达水平与T细胞CD8、T细胞调控、巨噬细胞M0、巨噬细胞M1、巨噬细胞M2及巨噬细胞M2/M1比值的相关性。
2.DLBCL患者血清及DLBCL细胞外泌体ENO2升高
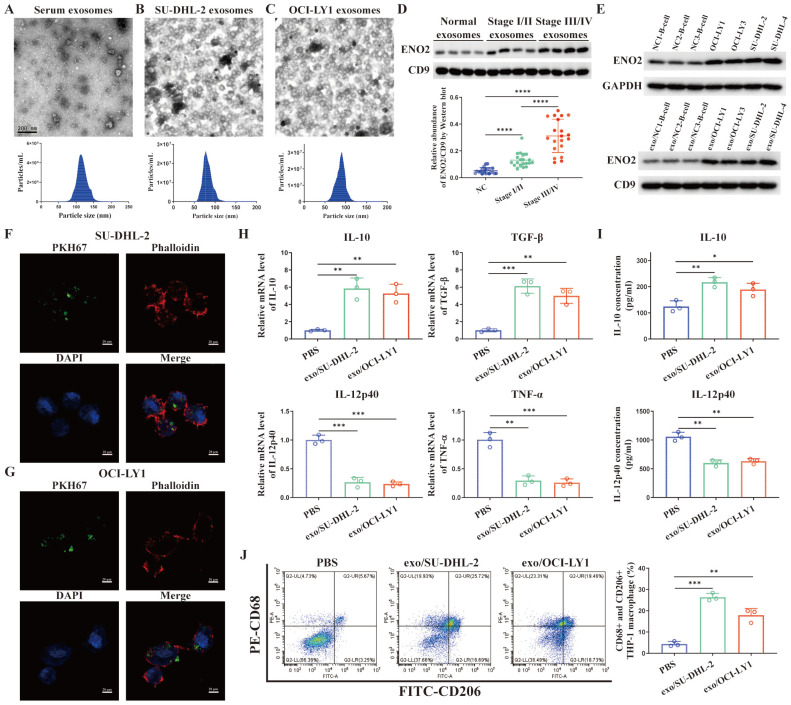
图2A-C:TEM和NTA鉴定外泌体形状和粒径大小。
图2D:Western blot检测外泌体ENO2表达水平。结果显示DLBCL患者血清外泌体ENO2升高,与DLBCL的进展有关。
图2E:DLBCL细胞和外泌体中的ENO2蛋白水平均高于NCs的B淋巴细胞。
图2F-G:共聚焦显微镜图像显示THP-1巨噬细胞从DLBCL细胞摄取外泌体。外泌体(绿色),F-肌动蛋白(红色)和细胞核(蓝色)。
图2H:THP-1巨噬细胞中IL-10、TGF-β、IL-12p40、TNF-α mRNA水平的变化。
图2I:THP-1巨噬细胞上清中IL-10、IL-12p40水平。
图2J:CD68+CD206+THP-1巨噬细胞比例及定量分析。
3.DLBCL来源的外泌体被THP-1巨噬细胞吸收,并通过ENO2调节巨噬细胞极化
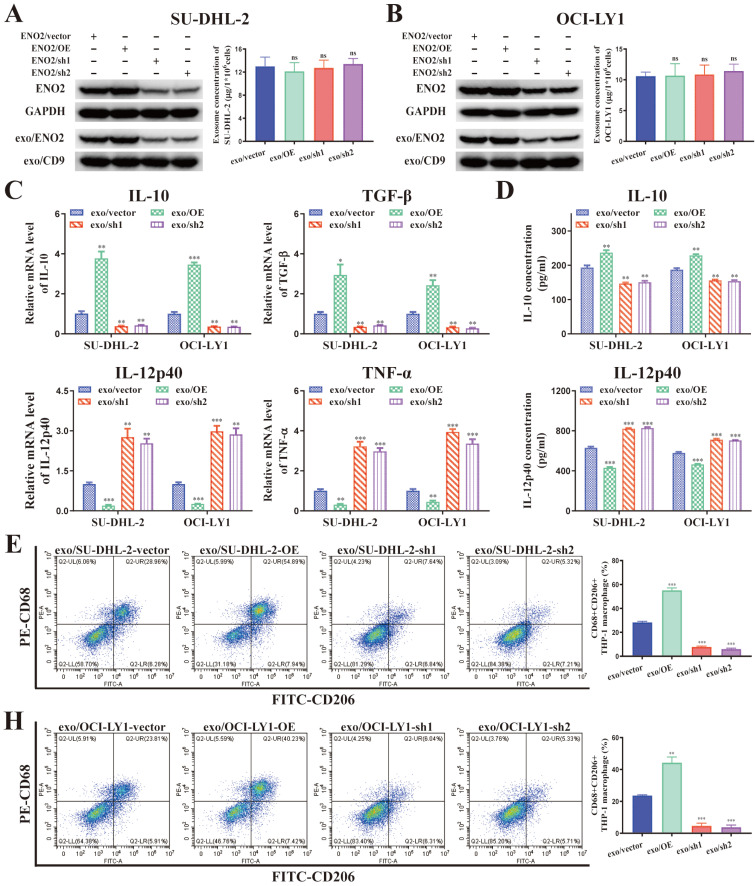
图3A-B:建立了ENO2稳定转染的DLBCL细胞。不同稳定转染的DLBCL细胞外泌体浓度无显著差异。
图3C:THP-1巨噬细胞中IL-10、TGF-β、IL-12p40、TNF-α mRNA水平的变化。
图3D:THP-1巨噬细胞上清中IL-10、IL-12p40水平。
图3E-H:CD68+CD206+THP-1巨噬细胞比例及定量分析。
4.DLBCL来源的外泌体ENO2在体内和体外均可促进巨噬细胞向M2样表型转变,从而促进DLBCL细胞的增殖、迁移和侵袭
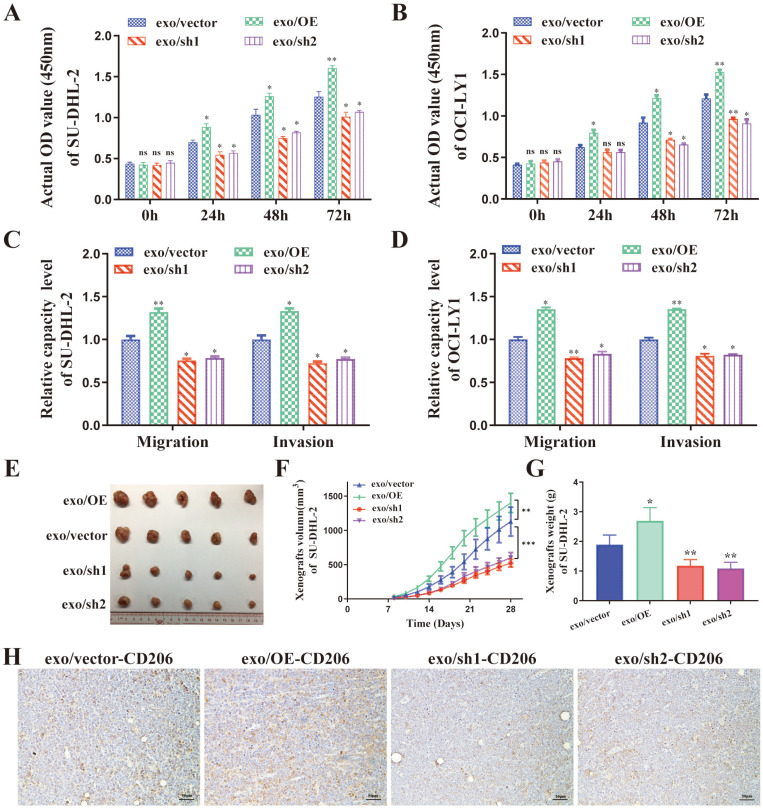
图4A-B:CCK8显示DLBCL细胞的增殖能力。
图4C-D:Transwell实验显示DLBCL细胞的迁移和侵袭能力。裸鼠皮下注射SU-DHL-2-ENO2-sh1细胞,每隔一天通过尾侧静脉注射稳定转染不同ENO2的SU-DHL-2细胞外泌体,共14次,共4周。
图4E:SU-DHL-2-ENO2-sh1异种移植瘤体积。
图4F:SU-DHL-2-ENO2-sh1异种移植物生长速度。
图4G:SU-DHL-2-ENO2-sh1异种移植瘤的肿瘤重量。
图4H:SU-DHL-2-ENO2-sh1异种移植瘤的免疫组化染色图像(CD206)。
5.DLBCL来源的外泌体ENO2对巨噬细胞极化的调节依赖于糖酵解
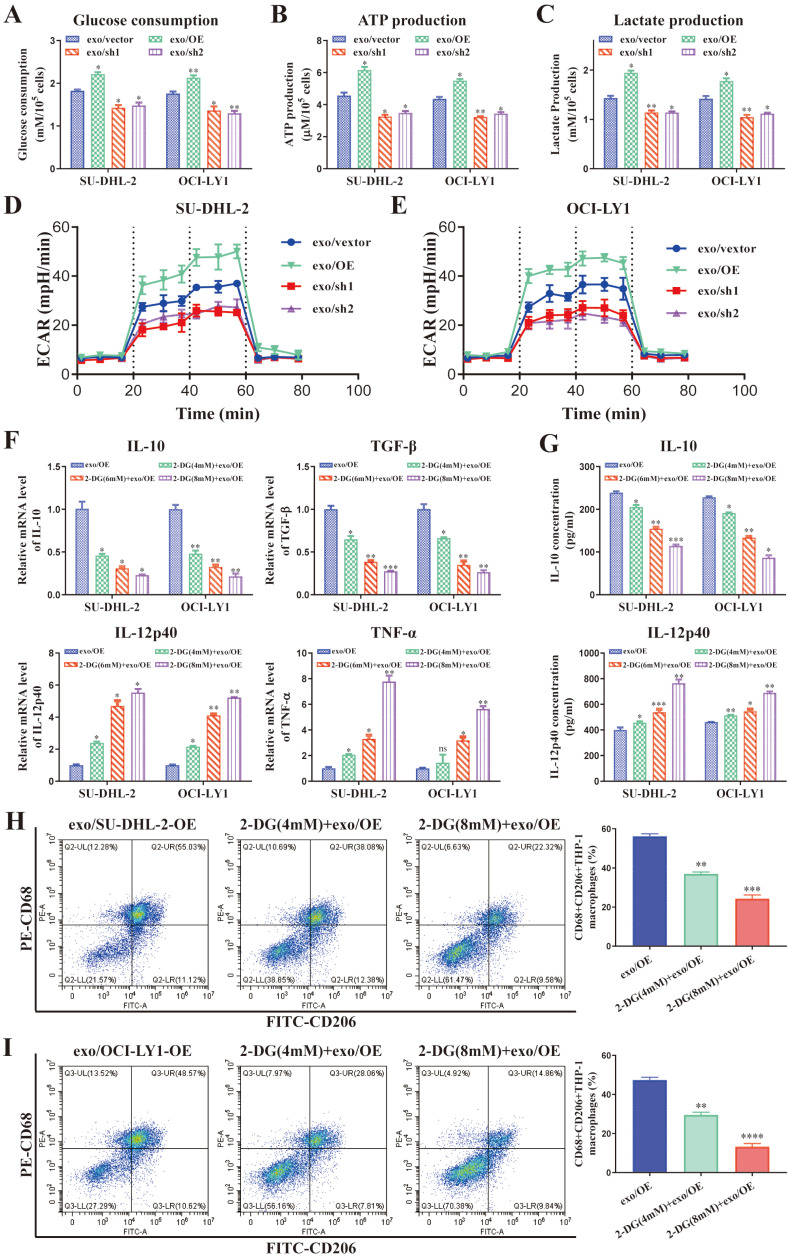
图5A:THP-1巨噬细胞的葡萄糖消耗。
图5B:THP-1巨噬细胞ATP的产生。
图5C:THP-1巨噬细胞的乳酸生成。
图5D-E:THP-1巨噬细胞的ECAR。用不同浓度的2-DG处理THP-1巨噬细胞1小时,然后用上调ENO2的外泌体刺激THP-1巨噬细胞24小时。检测巨噬细胞极化标记物。
图5F:THP-1巨噬细胞中IL-10、TGF-β、IL-12p40、TNF-α mRNA水平的变化。
图5G: THP-1巨噬细胞上清中IL-10、IL-12p40水平。
图5H-I:CD68+CD206+THP-1巨噬细胞比例及定量分析。
6.DLBCL来源的外泌体ENO2通过GSK3β/β-catenin/c-Myc信号通路加速糖酵解,从而调节巨噬细胞极化
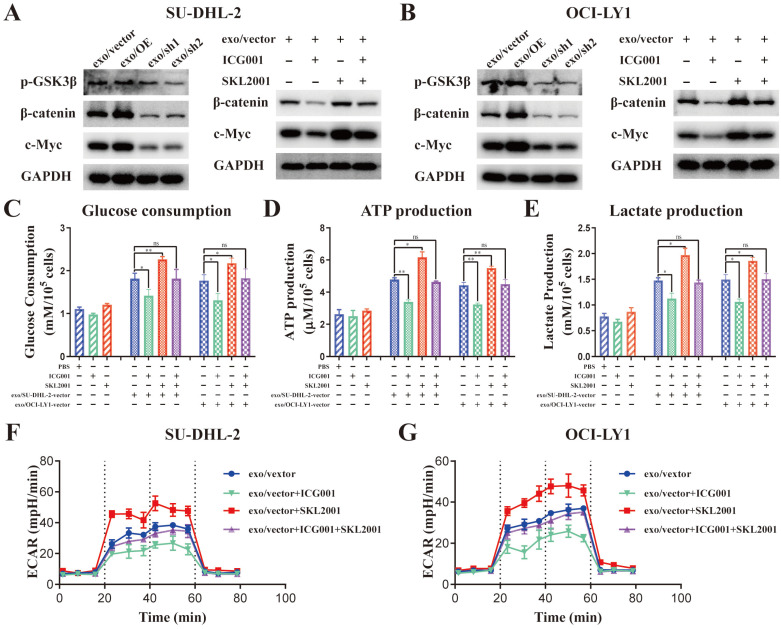
图6A-B:不同ENO2稳定转染的DLBCL细胞外泌体刺激THP-1巨噬细胞,检测p-GSK3β(Ser9)、β-catenin和c-Myc蛋白的表达水平;ICG001可降低THP-1巨噬细胞中β-catenin和c-Myc的蛋白表达水平;SKL2001可提高THP-1巨噬细胞中β-catenin和c-Myc的蛋白表达水平。用ICG001或SKL2001处理THP-1巨噬细胞1小时,然后用DLBCL细胞外泌体刺激24小时。检测糖酵解相关指标。
图6C:THP-1巨噬细胞的葡萄糖消耗。
图6D:THP-1巨噬细胞ATP的产生。
图6E:THP-1巨噬细胞的乳酸生成。
图6F-G:THP-1巨噬细胞的ECAR。
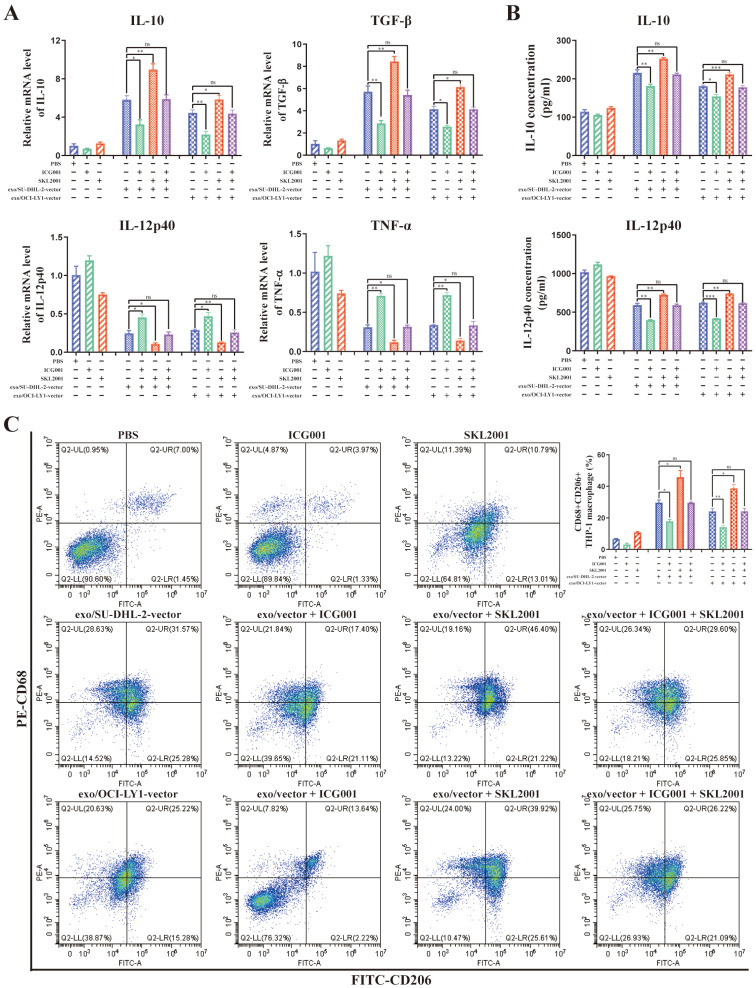
图7A:THP-1巨噬细胞中IL-10、TGF-β、IL-12p40、TNF-α mRNA水平的变化。
图7B:THP-1巨噬细胞上清中IL-10、IL-12p40水平。
图7C:CD68+CD206+THP-1巨噬细胞比例及定量分析。
结论
综上所述,DLBCL衍生的外泌体可以被巨噬细胞摄取,并且DLBCL衍生的外泌体ENO2通过GSK3β/ β-catenin/c-Myc信号通路加速糖酵解,调节巨噬细胞向免疫抑制表型发展,从而促进DLBCL的进展。认识到DLBCL衍生的外泌体ENO2在调节TAMs极化中的关键作用,为DLBCL治疗提供了潜在的分子靶点。






