研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
10分+高分文章,桑葚叶来源外泌体用于HCC靶向治疗的新策略
894 人阅读发布时间:2024-09-13 15:52
肝细胞癌(HCC)是肝癌的主要组织学亚型,约占肝癌所有病例的90%。它是全球有关癌症死亡的第三大常见原因,因其发病率和死亡率不断上升而引起全球关注。外科治疗(如切除、移植和经导管动脉化疗栓塞)在临床HCC治疗中取得了初步成功。然而,这些治疗模式的固有局限性,包括患者依从性下降、肿瘤复发和高死亡率,导致了其实际应用的实质性障碍。同时,临床化疗药物面临缓解率低、不良反应严重、寿命延长有限等挑战,迫切需要新型肝癌治疗方法。

湾湾今天分享的是一篇发表在【Journal of Nanobiotechnology】(影响因子10.6)上题为“Natural lipid nanoparticles extracted from Morus nigra L. leaves for targeted treatment of hepatocellular carcinoma via the oral route”的研究,该研究从桑树新鲜叶片提取并纯化了天然的类外泌体脂质纳米颗粒(MLNPs)。这些天然MLNPs富含糖脂、功能蛋白和活性小分子。体外实验显示,MLNPs通过半乳糖受体介导的内吞作用、增加细胞内氧化应激和触发线粒体损伤被肝肿瘤细胞系优先内化,从而抑制这些细胞的活力、迁移和侵袭。重要的是,体内研究表明口服MLNPs主要通过空肠和结肠进入循环系统,它们表现出轻微的不良反应和良好的抗肝肿瘤效果,通过直接杀死肿瘤和调节肠道微生物群。这些发现共同证明了MLNPs作为一种天然、安全且强大的纳米药物用于口服治疗肝细胞癌的潜力。
研究结果
1. MLNPs的理化表征
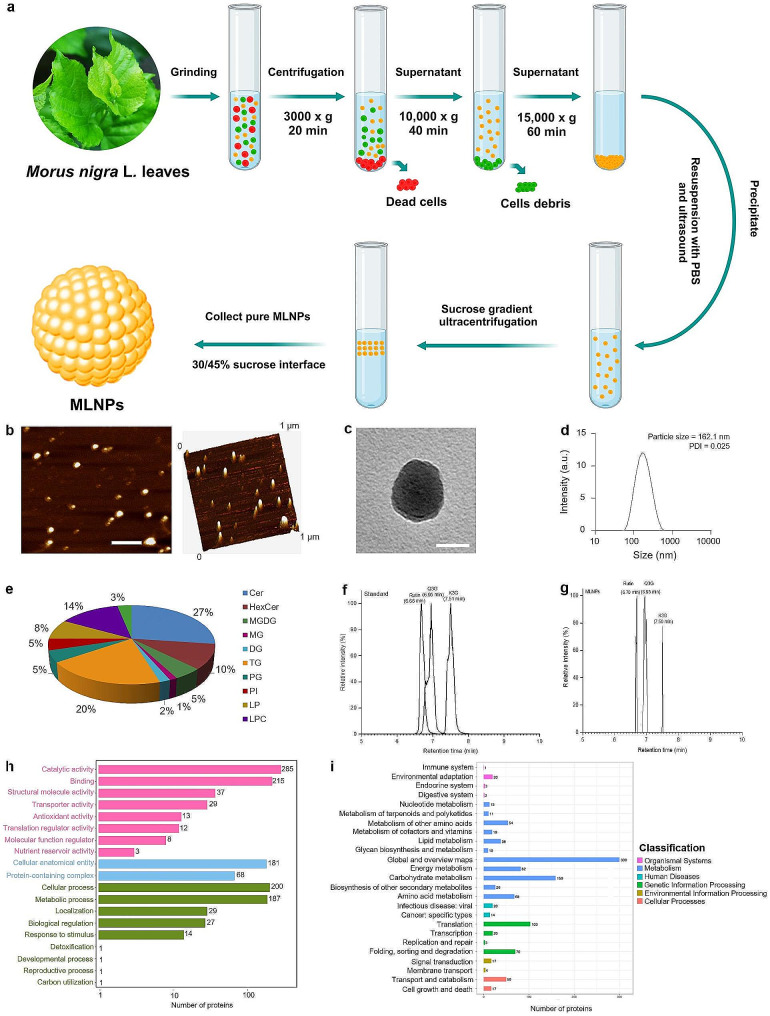
图1a:从桑叶中提取MLNPs。
图1b:MLNP的AFM图像,结果显示MLNPs在脱水后其直径约为100 nm。
图1c:MLNP的TEM图像,结果显示MLNPs在脱水后呈现为外泌体样球形颗粒。
图1d:流体动力学粒径分布,动态光散射(DLS)的进一步分析显示,MLNPs具有162.1 nm的流体动力学粒径,并表现出非常均匀的粒径分布(多分散性指数;PDI = 0.025)。
图1e:MLNPs的脂质组成,结果显示MLNPs含有5.0%的单半乳糖二甘油酯(MGDG)。
图1f:标准品色谱图。
图1g:MLNPs的色谱图,结果显示MLNPs中含有芦丁、槲皮素3-O-葡萄糖苷(Q3G)和shan奈酚3-O-葡萄糖苷(K3G)3种主要黄酮类化合物。
图1h:MLNPs的GO图,分析结果显示249个基因与仅由细胞解剖实体和含蛋白质复合物组成的细胞成分相关。
图1i:MLNPs的KEGG图,结果显示MLNPs中有34个蛋白与人类疾病和肝癌相关的信号通路相关。
生长因子(TGF-α、TGF-β、igf -Ⅱ和HGF)和Wnt信号通路在组织再生、细胞更新和某些病理状态(如癌前疾病和癌症)中被重新激活。Wnt/β-catenin蛋白通路在成熟和健康的肝脏中主要处于静止状态。相当大比例的肝肿瘤携带编码Wnt/β-catenin蛋白信号通路关键组分的基因突变。这些发现揭示了桑椹纳米囊泡抑制肝癌细胞的分子机制。
2. MLNPs的体外抗肿瘤活性
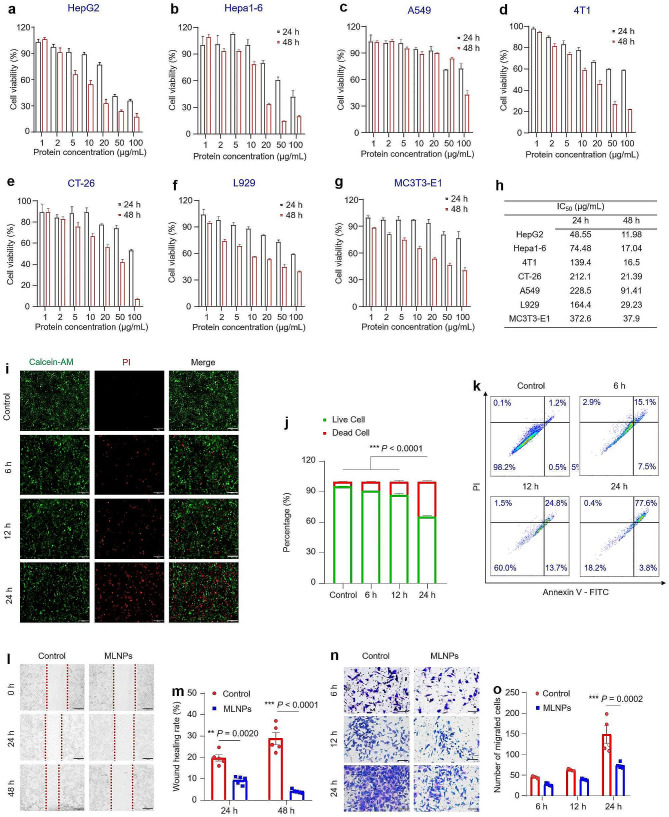
图2a-g:MTT法检测共孵育24和48 h后MLNPs对HepG2、Hepa1-6、A549、4T1、CT26、L929和MC3T3-E1细胞的潜在毒性,结果显示在HepG2、Hepa1-6、CT-26、4T1和A549细胞中,MLNPs对HepG2和Hepa1-6细胞表现出最大的细胞毒性。其中图2f-g结果显示,与肝癌细胞相比,MLNPs对健康细胞的毒性相对较低,表明它们具有良好的生物相容性。
图2h:MLNPs对不同细胞系的IC50值,结果中MLNPs处理的HepG2和Hepa1-6细胞暴露24小时后的IC50值分别为48.6和74.5 μg/mL,暴露48小时后的IC50值分别为12.0和17.0 μg/mL。
图2i:Calcein-AM/PI染色的Hepa1-6细胞荧光图像。活细胞用Calcein-AM染成绿色,死细胞用Calcein-PI染成红色,与对照组相比,在与MLNPs共孵育6、12和24小时后,Hepa1-6细胞显示出明显的红色荧光强度的时间依赖性增强。
图2j:定量分析活细胞或死细胞的荧光强度,结果显示MLNPs处理24小时后,细胞存活率约为60%,这一发现与MTT检测的结果一致。
图2k:MLNPs分别作用6、12、24 h对Hepa1-6细胞凋亡的影响,通过Annexin V-FITC/PI染色,结果显示接受MLNPs处理24小时的Hepa1-6细胞中,77.6%发生了晚期凋亡或坏死
图2l:MLNPs分别处理或不处理Hepa1-6细胞24和48h的迁移情况。
图2m:使用ImageJ软件检测有或没有MLNPs的Hepa1-6细胞的划痕愈合率MLNPs,在共培养24 h和48 h后,MLNPs分别处理或不处理的Hepa1-6细胞,伤口愈合率分别显著降低至9.3%和4.1%,表明其具有显著的抑制肝癌细胞迁移的能力。
图2n:MLNPs分别处理Hepa1-6细胞6、12、24 h后的transwell迁移能力。
图2o:ImageJ软件计数6、12、24 h的transwell迁移细胞数,
以上结果表明,MLNPs在HCC治疗中具有良好的应用前景。值得注意的是,图2n-o表明MLNPs在一定的时间范围内表现出时间依赖性的影响,以阻止肿瘤细胞的侵袭和转移。因此,实验假设MLNPs可以作为一种有前景的天然纳米药物来对抗转移性肝癌。
3. MLNPs的体外细胞摄取和抗肿瘤机制
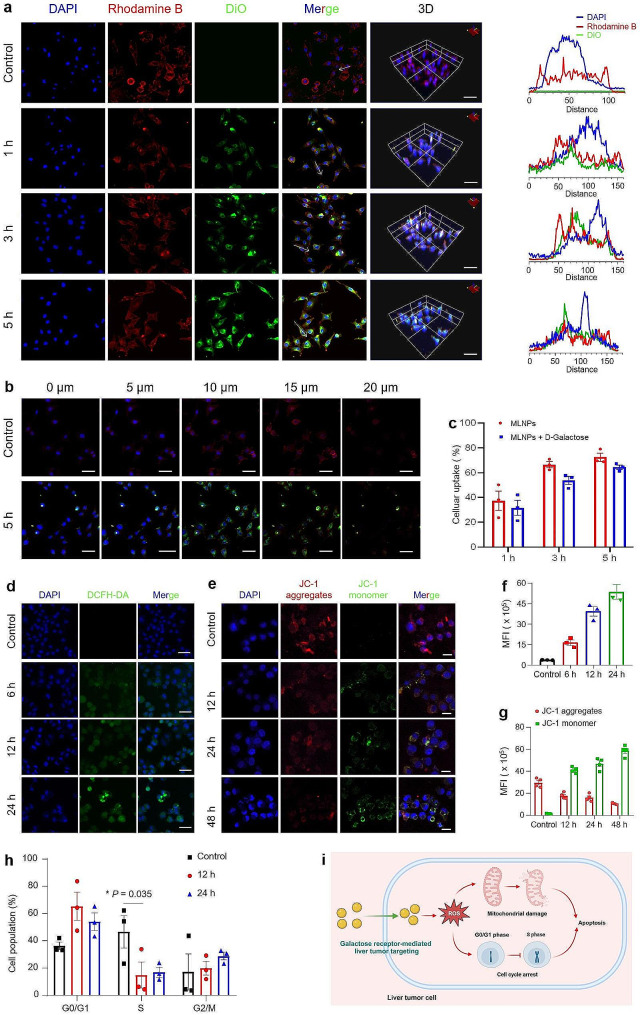
图3a:CLSM图像和荧光分布轮廓。
图3b:5h后,Dio标记的MLNPs(绿色)的细胞摄取CLSM横断面图像。用DAPI(蓝色)和罗丹明鬼笔环肽(红色)标记Hepa1-6细胞。
图3c:Dio标记的MLNPs分别被Hepa1-6细胞内化1、3和5h的百分比,结果显示Hepa1-6细胞的摄取百分比分别为37.3%、66.0%和72.5%。
图3d、f:分别与MLNPs共孵育6、12、24 h后,Hoechst 33、342(蓝色)标记的Hepa1-6细胞内ROS变化的CLSM图像及定量,结果观察到绿色荧光强度逐渐增强,反映出MLNPs可以有效地诱导肝癌细胞中ROS的产生。
图3e、g:分别与MLNPs共孵育12、24、48 h后,JC-1和Hoechst 33,342染色的Hepa1-6细胞的CLSM图像及定量,在施用MLNPs后观察到红色荧光中的可识别衰减和绿色荧光中的同时增强。这些发现表明这些天然来源的MLNPs具有诱导线粒体膜结构损伤的能力。
图3h:流式细胞仪分析MLNPs与Hepa1-6细胞共孵育12 h或24 h后细胞周期的变化,MLNPs处理12 h和24 h后,G0/G1期细胞比例明显增加,S期细胞比例明显减少。
图3i:MLNPs抗肝肿瘤细胞的促凋亡机制示意图,MLNPs可以阻断Hepa1-6细胞的细胞周期,使其停滞在G0/G1期。
结果显示,随着与MLNPs孵育的延长,Hepa1-6细胞内的绿色荧光信号逐渐增加,与细胞骨架的红色荧光重叠,这一观察证实了MLNPs被Hepa1-6细胞有效内化,且主要分布在细胞质内。
4. MLNPs的体内生物分布和肝脏靶向性
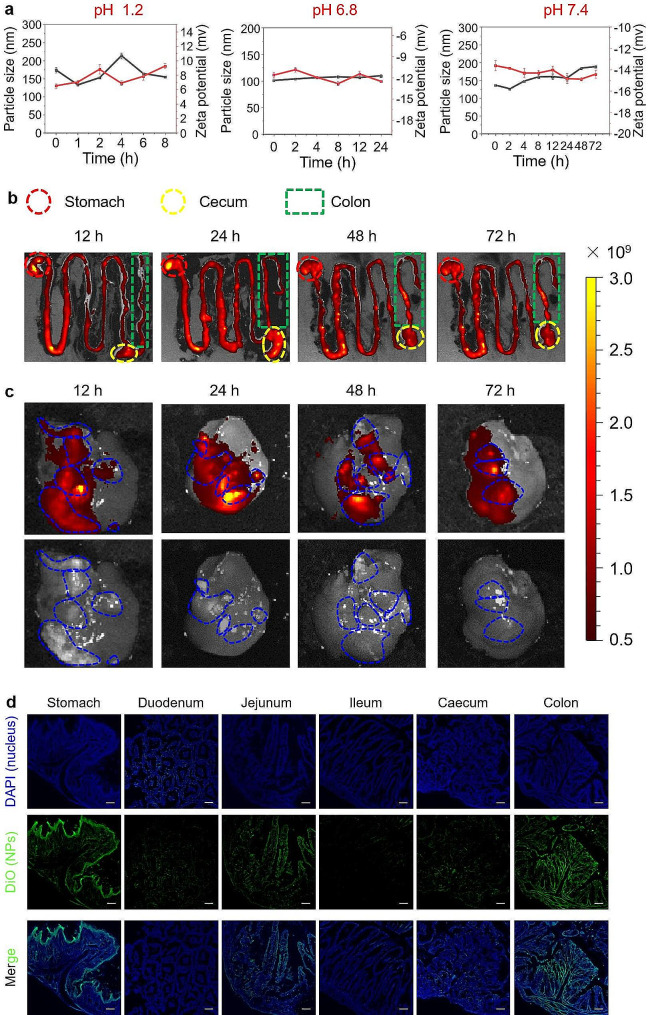
图4a:MLNPs在模拟胃液、小肠液和结肠液中的稳定性,MLNPs在不同模拟溶液中的孵育过程中具有相对稳定的粒径和表面电荷,表明它们在GIT中的稳定性。
图4b:不同时间点(12、24、48和72 h)口服DiR-MLNPs的HCC小鼠模型中GIT的体外荧光图像,口服给药后,Dir标记的MLNPs在GIT中维持了72小时,从Dir标记的MLNPs发出的荧光强度在口服24小时后的GIT内达到顶峰。
图4c:体外肿瘤靶向荧光图像和Dir标记的MLNPs在肝癌原位小鼠模型中的生物分布,MLNPs的荧光信号与肝肿瘤完美重叠,表明其具有内在的肝肿瘤靶向能力。
图4d:来自经口施用DiO-MLNPs的小鼠的GIT切片的荧光图像, 在胃、空肠和结肠中均检测到明显的绿色荧光信号(MLNPs)。此外,这些绿色信号在胃的上皮层富集,而在空肠和结肠的黏膜中主要存在。
以上结果表明,MLNPs可能不是在胃中吸收,而是在空肠和结肠中吸收,它们在空肠和结肠中进入循环系统,并通过半乳糖受体介导的靶向作用在肝肿瘤中蓄积。
5. MLNPs抗肝癌的体内治疗结果
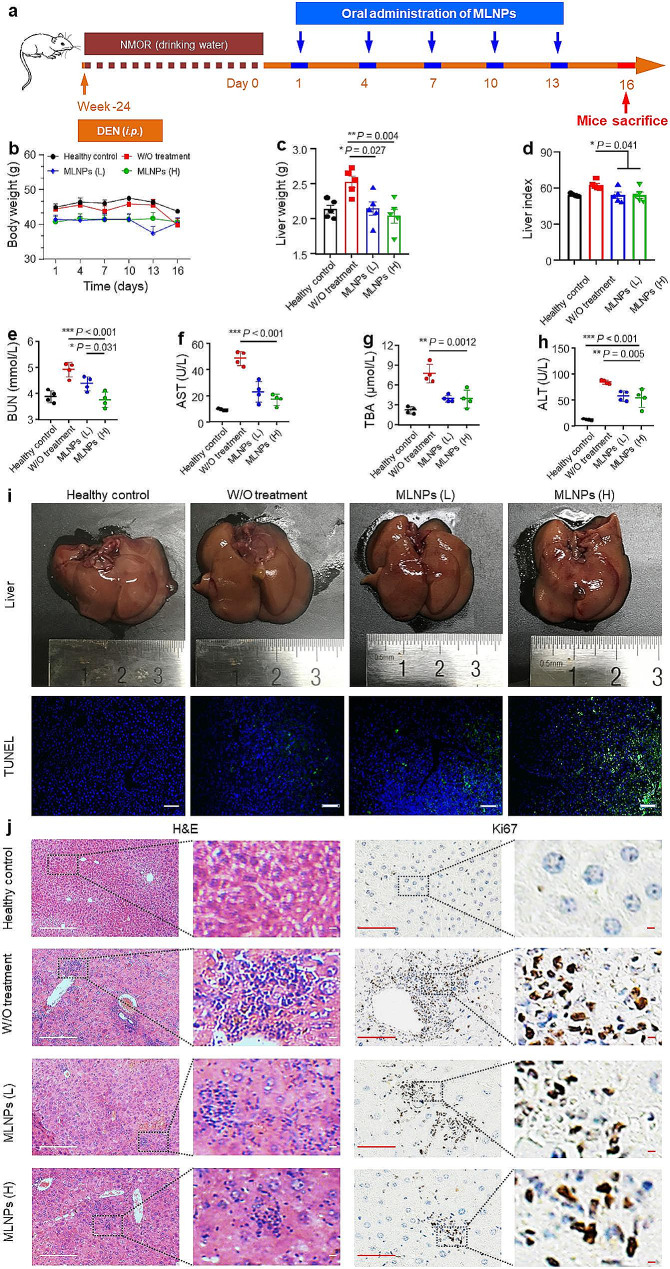
图5a:肝癌原位小鼠模型建立流程及治疗流程示意图。
图5b:经MLNPs治疗的原位肝癌小鼠的体重,在整个调查过程中,各组小鼠的体重没有明显差异。
图5c:经MLNPs治疗的原位肝癌小鼠的肝脏重量。与健康对照组相比,对照组(未进行处理)的肝脏重量有所增加。
图5d:经MLNPs治疗的原位肝癌小鼠的器官指数。与健康对照组相比,对照组(未进行处理)的肝脏指数有所增加。
图5e-h:经MLNPs治疗的原位肝癌小鼠的 BUN、AST、TBA、ALT的水平,水平分别降低1.1倍、2.1倍、2.0倍和1.5倍。
图5i-j:接受MLNPs口服治疗的小鼠肝组织的代表性数字照片、TUNEL、H&E和Ki67染色图像。图5i结果显示,与未处理的对照组相比,MLNPs (L和H)处理组的肝组织学明显改善。HE染色显示对照组(未治疗)存在早期肝脏肿瘤,表现为肝细胞核分裂和空泡变形。然而,口服MLNPs (L和H)显著减少了原发性肝脏肿瘤的表现(图5j)。采用TUNEL法和Ki67法分别标记肿瘤组织中细胞的凋亡和增殖情。
6. 口服MLNPs对肠道菌群的影响
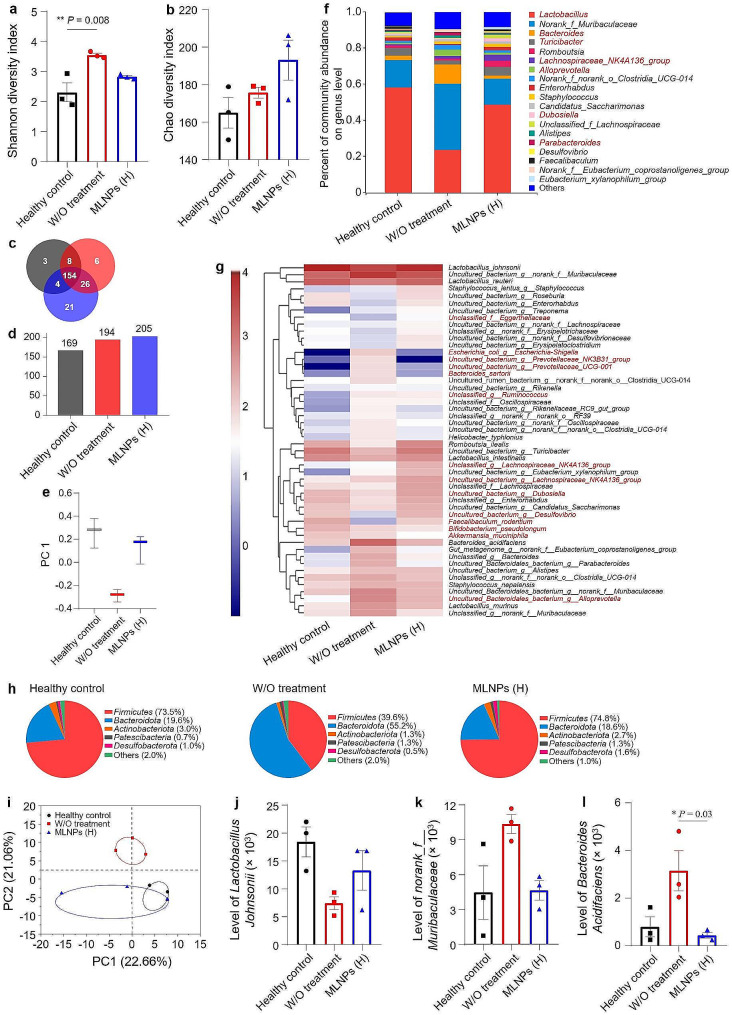
图6a-b:Shannon指数和Chao指数的箱形图表示α-多样性,Chao和Shannon多样性指数的变化证明口腔MLNPs引起菌群多样性的改变。
图6c-d:常见和独特细菌种类的韦恩图及各组小鼠的微生物种类总数。结果表明,MLNP (H)处理组的菌落形成显著增加,有205株菌株(154株在所有小鼠组中共享,21株为该组独有),这与Chao丰富度指数中观察到的趋势一致。
图6e:实验结果β-多样性的离散度。健康对照组、DEN/NMOR对照组和MLNP (H)处理组之间的距离反映了MLNPs对菌群重塑的积极作用,表明MLNPs可以在保持稳定的同时有效逆转化学致癌物引起的肠道菌群紊乱。
图6f:肠道菌群属水平的群落丰度百分比。与健康对照组相比,对照组(未进行处理)的有害细菌(例如Norank Muribaculaceae和Bacteroides)的相对丰度较高。
图6g:肠道菌群物种水平相对丰度热图。这些菌株与对照组(未处理)呈正相关,与健康对照组和MLNP (H)处理组呈负相关。
图6h:各小鼠组在门水平的微生物组成。DEN/NMOR对照组中厚壁菌门(Firmicutes)水平降低,拟杆菌门(Bacteroidota)和Patescibacteria水平升高。
图6i:各组肠道菌群主坐标分析(PCoA)。口服MLNPs给肝癌小鼠后,MLNP (H)处理组的集落结构与健康对照组小鼠的集落结构部分相交。
图6j-l:不同处理组中典型有益和有害细菌的相对丰度。
以上这些结果表明,MLNPs可以有效地调节肠道菌群的平衡。
结论
从桑树葚新鲜叶片中提取并纯化天然的类外泌体纳米囊泡,用于治疗肝癌。这些桑树新鲜叶片来源的脂质纳米颗粒(MLNPs)包含多种功能成分,包括脂质、蛋白质和类黄酮,其中半乳糖被确定为肝肿瘤靶向的潜在靶点。此外,它们在模拟胃肠道条件下表现出优异的稳定性和优异的生物相容性,因此非常适合在体内应用。体外实验表明,MLNPs表面的半乳糖基团有助于其被Hepa1-6细胞特异性内化,并增强其对肝肿瘤细胞的细胞毒性。MLNPs可使Hepa1-6细胞周期阻滞在G0/G1期,并诱导细胞凋亡。它们还触发了细胞内ROS水平的激增,并显著抑制肝癌细胞的增殖和迁移。MLNPs口服给药的生物安全性优于静脉给药,未引起免疫原性和毒副作用。在小鼠原发性肝癌模型中,口服MLNPs表现出显著的肝脏靶向和富集能力,显著抑制肿瘤生长和调节肠道微生物平衡。综上所述,MLNPs代表了一种天然、安全、环保的纳米药物,具有出色的肝肿瘤靶向能力,可用于肝细胞癌的口服治疗。






