研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
蹭上国自然双重热点!外泌体+铁死亡发表10分+,发文思路轻松GET
907 人阅读发布时间:2024-09-27 11:12
阿霉素(DOX)属于蒽环类药物家族,被广泛用于治疗各种类型的癌症。然而,DOX相关的心脏毒性,其特点是心肌细胞丧失、进行性心脏增大,最终导致充血性心力衰竭,限制了其临床应用。当累积接受DOX剂量超过550 mg/m2时,大约四分之一的患者会导致心力衰竭。因此,阐明潜在的机制并开发治疗策略以避免不良反应,是迫切需要的。

湾湾今天分享的是发表在【Journal of Nanobiotechnology】(IF:10.6)上题为“Ultrasound targeted microbubble destruction assisted exosomal delivery of siHmox1 effectively inhibits doxorubicin-induced cardiomyocyte ferroptosis”的研究。在本研究中,作者进一步发现DOX诱导小鼠心肌铁死亡与Hmox1上调有关。UTMD辅助siHomox1的外泌体递送几乎阻断了阿霉素诱导的铁死亡和随后的心脏毒性。该研究结果表明,HMOX1的上调可诱导心肌细胞铁死亡,UTMD辅助的siHmox1外泌体递送可作为DIC的潜在治疗策略
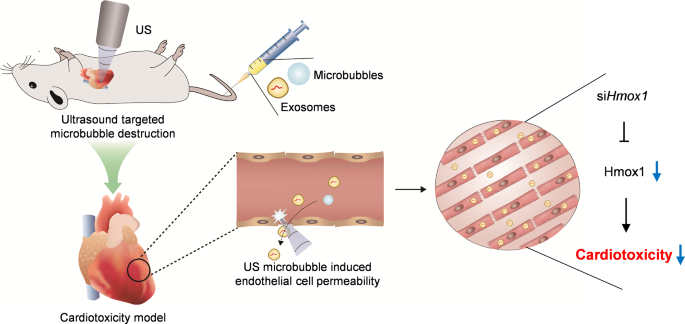
研究成果
1、DOX诱导心肌铁死亡呈时间和剂量依赖性
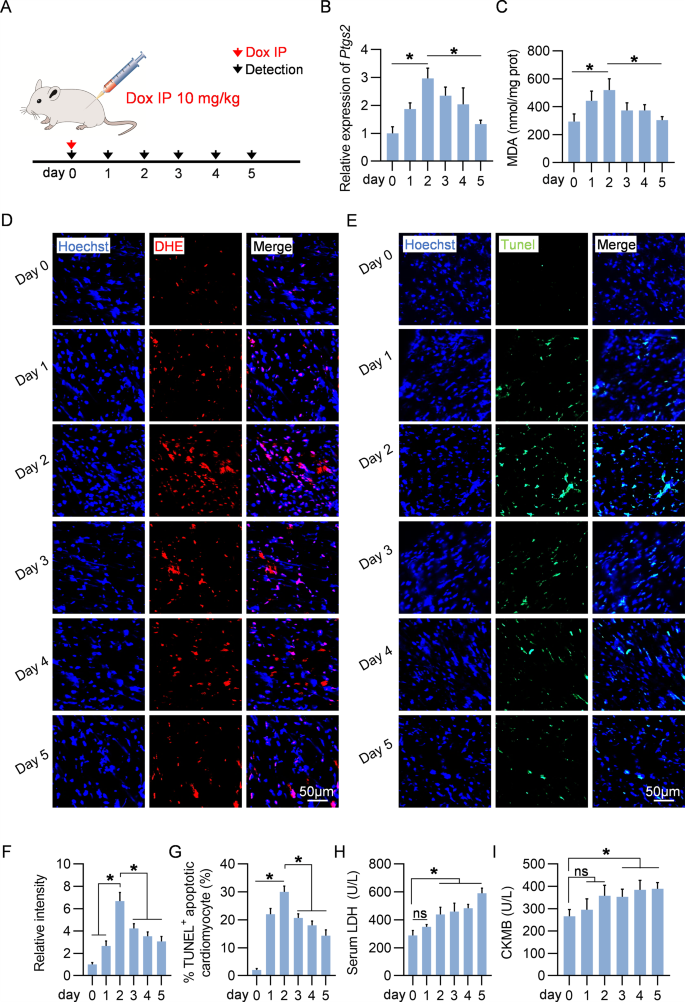
图1A:实验过程示意图,小鼠接受10 mg/kg Dox治疗,然后在治疗后的不同时间点检测铁死亡。
图1B:qPCR分析接受DOX治疗的小鼠心脏中铁死亡标志物Ptgs2 mRNA表达,结果显示,Ptgs2 mRNA表达在第2天达到峰值,此后逐渐下降。升高持续到第5天。
图1C-G:同上处理小鼠心脏各时间点的MDA水平、小鼠心脏组织代表性DHE染色和TUNEL染色,数据显示,脂质过氧化标志物MDA、ROS指标DHE和细胞死亡也显示出Ptgs2 mRNA类似的趋势。
图1H-I:同上处理小鼠各时间点血清LDH和CKMB水平,数据显示,血清LDH和CKMB随时间增加,表明Dox具有明显的心脏毒性。
以上数据表明,DOX可诱导心脏铁死亡,且具有时间和剂量依赖性。
2、反复使用Ferrostatin-1抑制剂治疗具有全身毒性
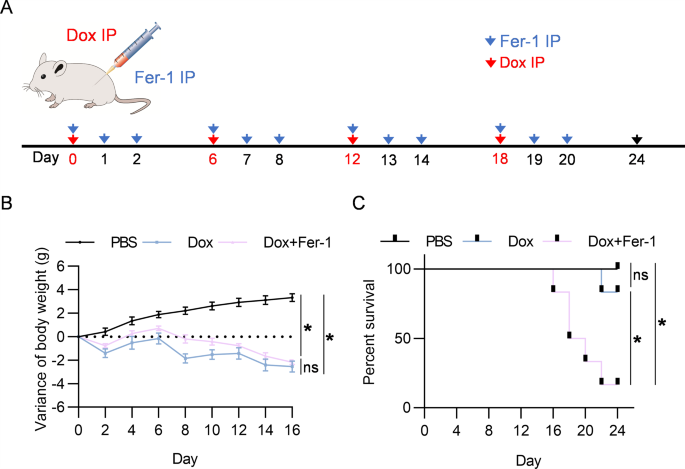
图2A:实验过程示意图。在指定时间给予DOX和Fer-1治疗小鼠并监测体重和存活率。
图2B:按指示处理小鼠的体重变化。
图2C:按图示处理小鼠Kaplan-Meier生存曲线。
以上数据表明,Fer-1具有全身毒性作用。
3、DOX诱导的铁死亡主要与Hmox1上调有关
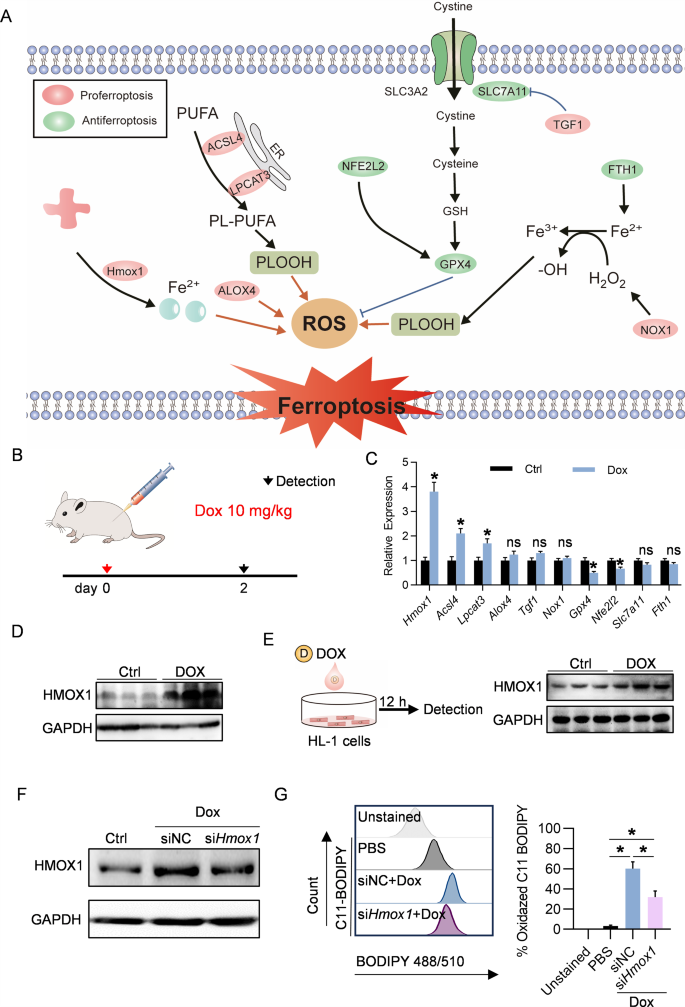
图3A:调控铁死亡的基因网络示意图。
图3B:实验过程示意图。用DOX治疗小鼠,在第2天分析基因表达。
图3C:qPCR分析对照组和DOX治疗小鼠中候选基因。
图3D:Western blot分析对照组和DOX治疗小鼠心脏中Hmox1蛋白。
图3E:Western blot分析用或不用DOX处理的HL-1细胞中心脏Homx1蛋白。
图3F:Western blot测定siHomx1的敲除效率。
图3G:流式细胞术分析脂质过氧化。在流式细胞术分析之前,用荧光探针C11-BODIPY对指定处理的细胞进行染色。
以上结果表明,DOX诱导的铁死亡主要归因于Hmox1的上调。
4、UTMD辅助外泌体递送siHmox1减少铁死亡和心脏毒性
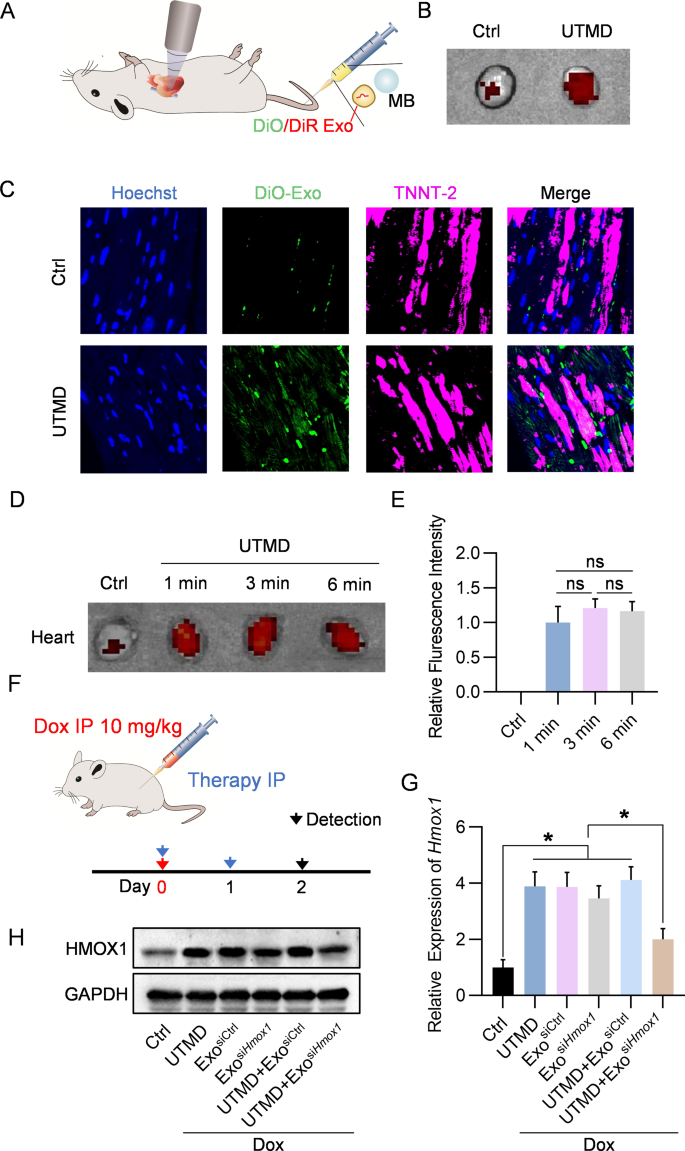
图4A:实验过程示意图。小鼠注射或不注射DiO或DiR标记的外泌体,然后在UTMD组的心脏区域进行UTMD辐射。
图4B:体外荧光图像显示对照或UTMD处理小鼠心脏中外泌体的分布。
图4C:外泌体在TNNT-2阳性心肌细胞定位的代表性图像。
图4D:体外荧光图像显示外泌体在小鼠心脏中的分布。对于UTMD治疗组,小鼠在UTMD后的指定时间额外注射外泌体。
图4E:D组量化数据。
图4F:实验过程的示意图。
图4G:qPCR分析siHmox1在小鼠心脏中的体内敲除效率。
以上数据表明,当前的策略可以功能性地将siRNA递送到心脏中。
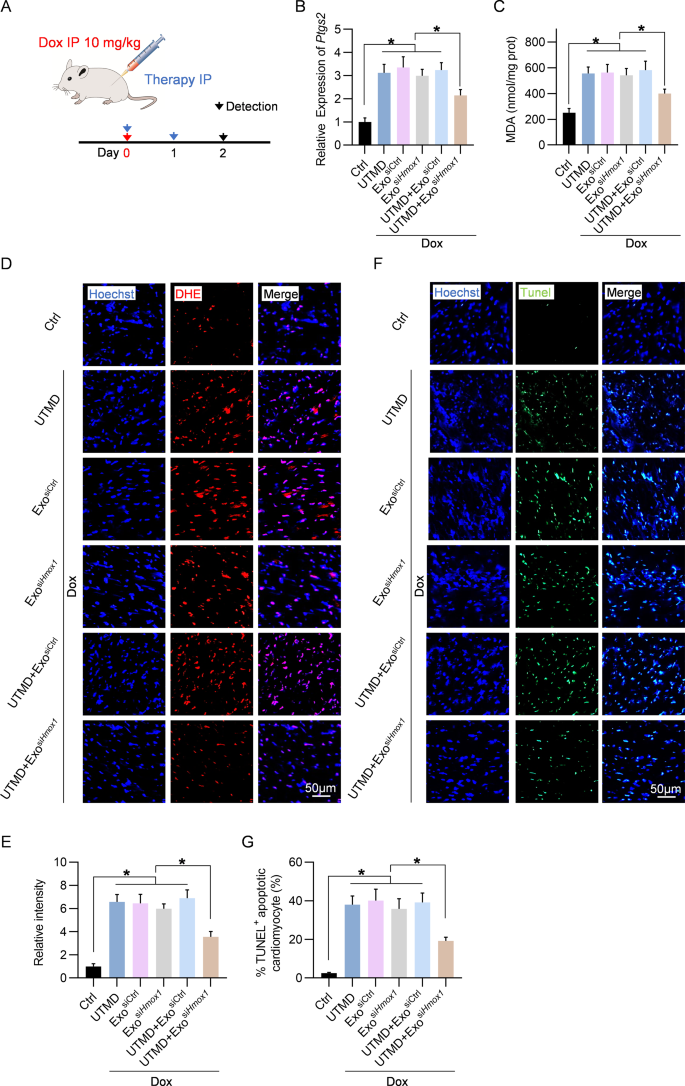
图5A:实验过程示意图。
图5B:qPCR分析接受指定治疗的小鼠在指定时间点心脏中Ptgs2 mRNA表达。
图5C:同上处理小鼠心脏各时间点的MDA水平。
图5D:同上处理小鼠心脏组织代表性DHE染色。
图5E:D组量化数据。
图5F:同上处理小鼠心脏组织代表性TUNEL染色。
图5G:F组量化数据。
上述数据表明UTMD + Exo siHmox1治疗可以抑制DOX诱导的铁死亡。
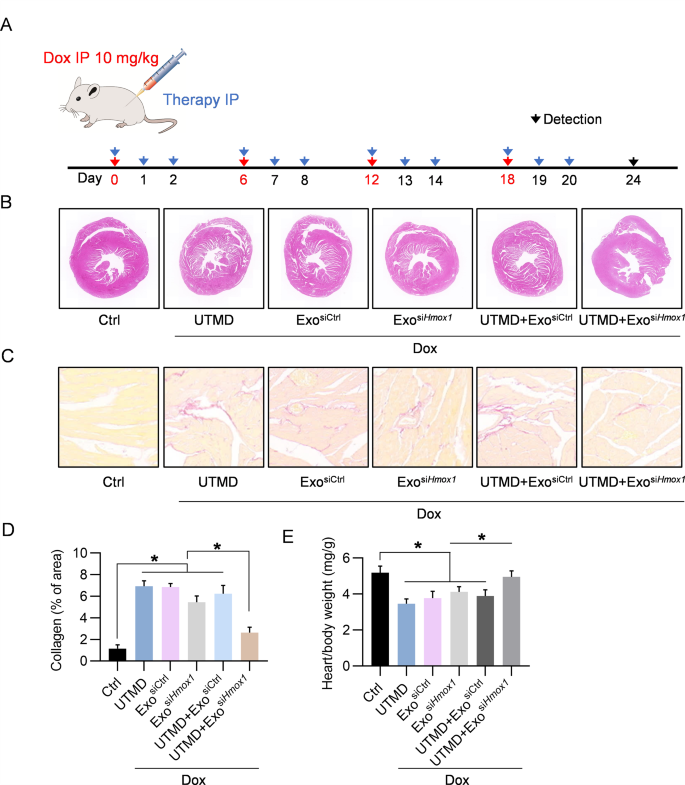
图6A:实验过程示意图。
图6B:指定组小鼠心肌HE染色的代表性图像。
图6C:指定治疗小鼠心肌天狼星红染色的代表性图像。
图6D:胶原蛋白含量的定量。
图6E:小鼠心脏/体重比。
以上数据表明,研究中的心脏重量变化主要是由DOX治疗引起的细胞损失决定的,而不是随后的纤维化。
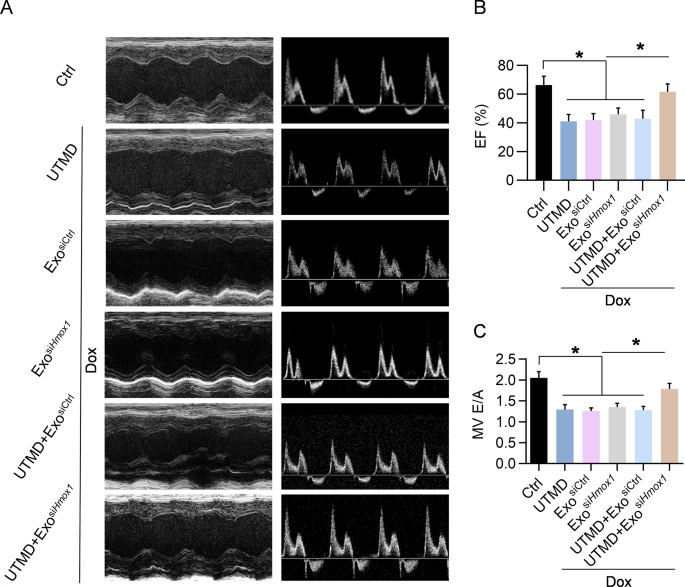
图7A:超声心动图的代表性图像。
图7B:通过EF值确定收缩功能的量化。
图7C:由E/A值决定的舒张功能。EF,射血分数;FS:缩短分数;MV:二尖瓣。
以上数据表明,各组中未观察到死亡和体重显著下降,该策略应该是安全的。
结论
该研究进一步证实了铁死亡通过上调Hmox1介导DOX诱导的心脏毒性的发病机制。结果表明,通过UTMD辅助外泌体递送选择性地敲低心肌细胞中的Hmox1可能是一种实用的治疗方法,可以在不影响药物抗癌特性的情况下治疗DOX诱导的心脏毒性。需要进一步的研究来检验这一治疗策略的潜在临床意义。






