研载生物科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
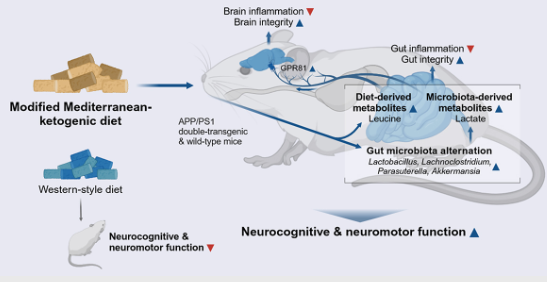
减脂人士有福啦!“微生物组+代谢组”分析12分+文章告诉你,减脂餐可以改善阿尔兹海默病!
430 人阅读发布时间:2024-10-10 14:56
地中海饮食法是什么?
是指有利于健康的,简单、清淡以及富含营养的饮食。这种特殊的饮食结构强调减少糖类和脂肪的摄入,增加高纤维食物促进消化,蔬菜量>主食量>豆类>肉类,尤其提倡用橄榄油。目前成为很多人的减肥方法。
除了预防心血管、糖尿病等慢性疾病,辅助减肥,该研究表明改良的地中海饮食法,可以改善阿尔兹海默病(AD)。

研究背景
阿尔茨海默病 (AD) 是痴呆的主要形式, 由于病因的多因素复杂性,加上遗传和环境风险因素,使得任何单一药物或干预措施都不可能有效治疗或治愈所有患者。尽管如此,三分之一的病例与可改变的风险因素有关,这些风险因素可以通过调整饮食和生活方式来缓解。因此,饮食和生活方式干预是降低全球AD发病率的有前途的途径。
研究成果
1、MkD干预可防止AD模型中的代谢失调
通过对转基因APP/PS1 (AD)和野生型(WT)小鼠进行为期12周的MkD和WD饮食干预,评估了生理参数,以确定饮食对身体组成和代谢健康的影响。
体重:没有观察到显著差异。 AD小鼠比WT小鼠表现出更高的体重,这主要是由于从第3周开始增加食物摄入量,一直持续到研究终点(图1b)。
身体组成:观察到显著差异。在AD小鼠中,与WD喂养组相比,MkD导致脂肪量显著降低;在WT小鼠中也观察到类似的模式(图1c)。
肠道长度和肝脏面积:MkD喂养小鼠有延长的趋势,而WD喂养小鼠肝脏重量更高,尤其是AD组(图1d,e)。
口服葡萄糖耐量试验(GTT):MkD喂养的WT小鼠表现出明显升高的空腹血糖水平。尽管曲线下面积(AUC)在两组之间没有显著差异,但在两种基因型中,WD喂养的小鼠餐后血糖峰值均高于MkD喂养的小鼠(图1f)。
胰岛素耐量试验(ITT):MkD喂养小鼠的AUC较高,差异显著,尤其是WT小鼠。WT-WD小鼠的血清葡萄糖水平在注射胰岛素后60分钟达到最低点,而其他所有组在注射胰岛素后30分钟达到最低点。此外,两组小鼠均需要较长的时间才能达到原始的空腹血糖水平(图1g)。
肠道通透性:与WD相比,MkD干预在两种基因型中均显示出较低的肠道上皮通透性(图1h)。
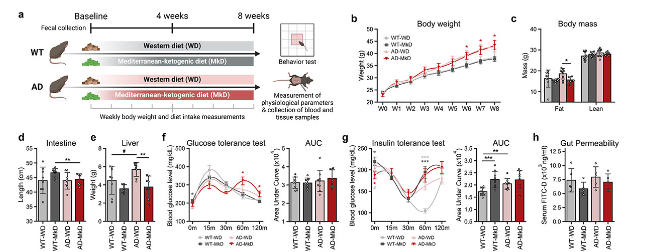
图1:与WD相比,MkD饮食可改善AD小鼠的身体成分
2、MkD诱导神经行为功能的改善
为了探索饮食对神经行为和神经肌肉活动的影响,对小鼠进行了一系列行为测试。总体而言,MkD对小鼠的各种行为领域产生了有益的影响,包括探索行为、焦虑水平、记忆和运动表现。
旷场实验(OPT):与WD相比,MkD喂养小鼠在中心区域停留的时间更长,在OPT中穿越的距离更长,这表明探索活动适度改善,焦虑样行为减少(图2a)。
T迷宫实验:空间工作记忆以交替得分评估,两组间差异无统计学意义;然而,MkD喂养小鼠表现出显著降低的潜伏期,这表明神经认知处理或任务特异性适应得到改善,从而做出更好/更快的决策(图2b,f)。
辨别指数(DI):MkD喂养小鼠对熟悉和新的物体都表现出更多的探索倾向(图2c)。
线挂测试和转棒实验:AD小鼠在吊线上悬挂时间缩短,在加速旋转棒上耐力下降,表明神经肌肉能力受损 (图2d-f); MkD喂养小鼠,特别是AD小鼠,在线挂测试中表现出明显的改善,在转棒实验中表现出积极的趋势(图2d-e)。
行为结果之间的相关性:计算结果之间的相关性发现(图2f),花更多时间在中心区域的小鼠在OPT中探索更远的距离,在T迷宫中花更少的时间。此外,在T迷宫中花费较少时间做决定的小鼠在OPT中表现出更活跃。
综上所述,这些数据表明,与WD相比,MkD可能有益于行为和神经运动能力,尤其是在AD小鼠中。
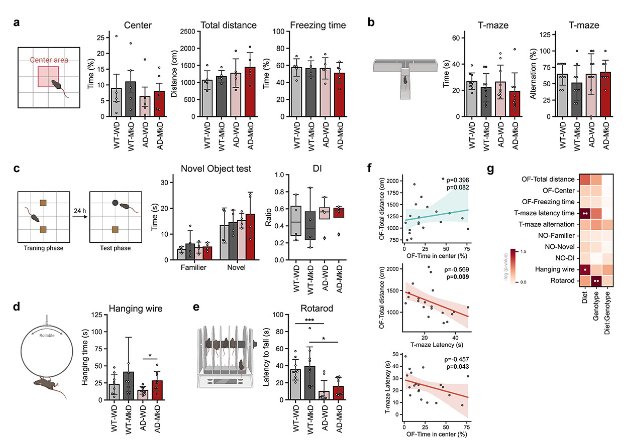
图2:与WD相比,MkD饮食可改善AD小鼠的神经认知和行为功能
3、与WD干预相比,MkD诱导独特且有益的肠道微生物组调节
在观察到MkD对神经行为和代谢特征的有利结果的推动下,研究了肠道细菌微生物组的饮食特异性变化,旨在确定潜在机制。
α -多样性、 β 多样性:观察到两种基因型小鼠中MkD喂养的微生物α -多样性略高,与WD喂养的小鼠相比,其肠道微生物组结构明显不同,从而在PCoA分析中产生不同的饮食特异性β -多样性簇(图3a,b)。根据小鼠的饮食,小鼠表现出显著不同的微生物组成特征。
细菌微生物组组成的相对丰度和差异:在门水平上,MkD喂养的小鼠的拟杆菌门丰度增加,放线菌门减少(图3c)。属水平比较和线性区分分析(LDA)效应量(LEfSe)分析显示,与WD喂养小鼠相比,MkD喂养小鼠中乳杆菌属、阿克曼氏菌属、g_丹毒杆菌科、Lachnoclostridium属、肠球菌属和Parasuterella属等细菌属的丰度更高,而双歧杆菌属和杜氏杆菌科的丰度较低(图3d,e)。具体来说,在MkD喂养小鼠中,乳酸菌属、阿克曼氏菌属、拟杆菌属和肠球菌属随着时间的推移逐渐增加,而在WD喂养小鼠中,杜氏杆菌科的升高更为显著,乳杆菌属属随着时间的推移明显减少(图3f)。
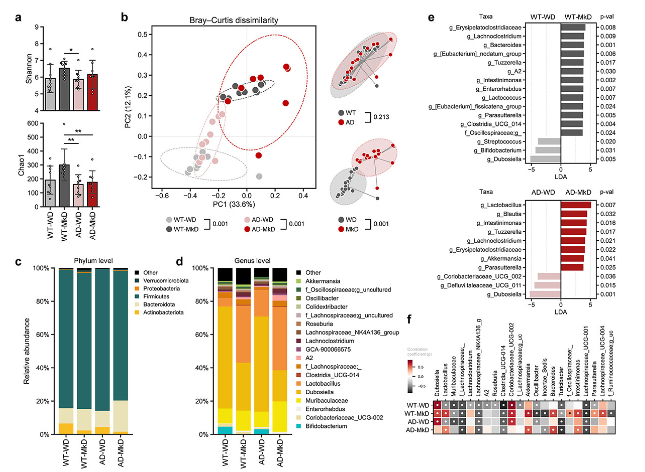
图3:与WD相比,MkD饮食在AD小鼠中诱导独特且有益的肠道微生物组多样性和组成阵列
4、MkD通过培养特定的神经递质阵列诱导不同的粪便和血清代谢组学特征
消化过程和肠道微生物群产生的代谢物是评估MkD影响和潜在机制的重要因素。某些代谢物不仅能调节肠道健康,还直接影响免疫系统和大脑产生。鉴于在两种饮食干预后肠道微生物组的实质性差异,进行了全局非靶向代谢组学研究,以测量粪便和血清中微生物群衍生的代谢物。代谢物的总体特征明显随饮食而异(图4)。
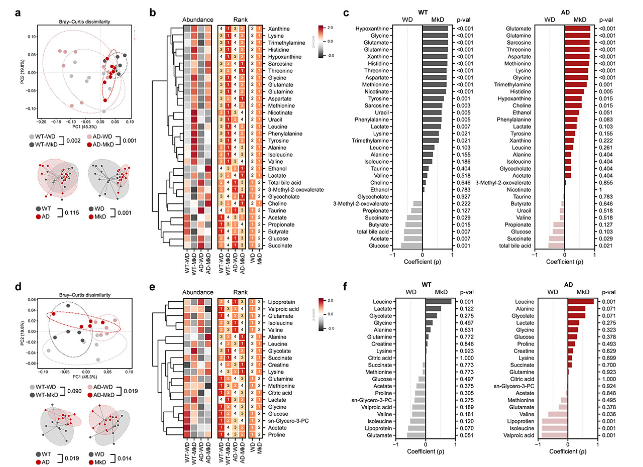
图4:与WD相比,MkD饮食明显调节AD小鼠的肠道和血液代谢组
采用微生物组和代谢组学合并丰度数据的随机森林模型时,发现粪便代谢物特征比细菌和真菌群落特征具有更强的预测能力(图5c,d)。各组分类均成功,准确率较高。在20个最显著的特征中,有18个是代谢物,证明饮食对代谢物的影响更明显(图5c,d)。
基于粪便和血清代谢物相对丰度的PCoA分析显示,不同饮食有明显聚类特征,并且在WT和AD小鼠的血清代谢组学中观察到显著差异(图4a,d)。在MkD喂养小鼠的粪便中,AAs、乳酸和嘌呤等代谢物更丰富。在AD小鼠中,甘氨酸、酪氨酸和组氨酸等神经递质和神经活性代谢物的前体显著降低,而在MkD中显著增加。此外,MkD组兴奋性神经递质谷氨酸、甘氨酸和肌氨酸升高。WD组总胆汁酸(TBA)、几种SCFA、葡萄糖和琥珀酸盐水平升高(图4b、c、5a)。然而,在血清中,相对较少的代谢物被发现在MkD后更丰富。亮氨酸、乳酸、丙氨酸和甘氨酸随着MkD的增加而增加,而谷氨酸和异亮氨酸则相反,在WD饮食中更为普遍。此外,WD喂养小鼠的脂蛋白和缬氨酸水平更高(图4e,f)。
共现网络分析显示,大多数氨基酸,包括苏氨酸、谷氨酰胺、谷氨酸和蛋氨酸及其代谢物肌氨酸,与乳杆菌属、Lachnoclostridium、Parasutterella和阿克曼氏菌属呈正相关,这些菌属都在MkD后富集。特别是乳杆菌属与MkD增加的大多数代谢物共存,与TBAs存在互斥关系。相反,杜氏杆菌科在WD喂养的小鼠中更为普遍,主要与MkD富集的代谢物呈负相关。乳酸与毛螺球菌科家族的微生物群呈正相关,据估计这些微生物群利用乳酸,如Lachnoclostridium、Lactococcus和g_uncultous。亮氨酸还与毛螺球菌科和颤螺旋菌科的几个微生物类群表现出相互上升的共调节网络(图5b)。
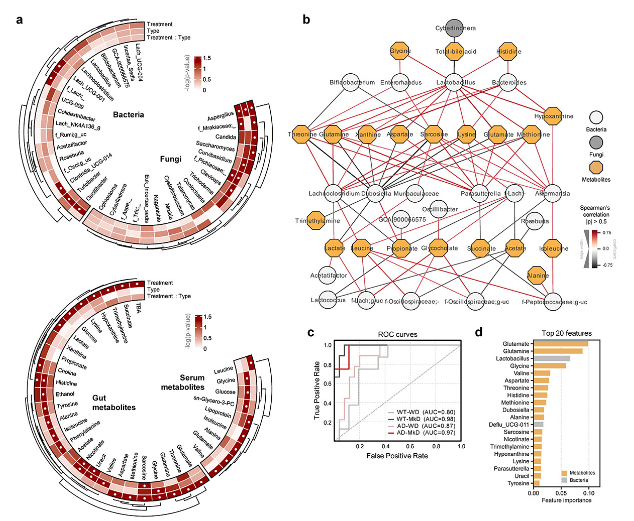
图5:与WD相比,MkD饮食通过调节宿主微生物-代谢物共同调节相互作用的多组学阵列来明显塑造肠道微生态位
5、MkD 可改善肠道和大脑炎症特征,这与神经认知改善密切相关
神经认知和神经肌肉活动的增强,以及肠道微生物群和粪便-血清代谢物的实质性调节,推动研究肠道和大脑生态位中上皮屏障完整性和炎症的状态。为此,测量了编码紧密连接蛋白和炎症标志物的基因mRNA表达,并确定了它们与神经认知结果的相关性,以了解潜在关系。
使用小肠(回肠)和大肠(结肠)远端,并选择海马体和下丘脑(AD早期受损,导致记忆障碍和行为改变的区域)进行基因量化。发现MkD干预倾向于增加CLDN12(在回肠和结肠中调节Ca2+的吸收和稳态)的表达,在AD小鼠趋势相反,且该蛋白与运动功能呈正相关。(图6a,b)。CLDN3(直接影响连接紧密性)也显示出与运动功能的正相关,尽管其表达在各组之间没有显著差异。在MkD喂养小鼠的海马体和下丘脑中,CLDN5(与神经退行性疾病有关的最丰富的紧密连接蛋白)的表达增加。WT-MkD小鼠海马体ZO-1明显高于WD小鼠, AD组相反(图6c,d)。伴随着屏障完整性的改善,MkD也降低了促炎介质在肠道和大脑中的表达。在MkD干预后,结肠和海马体中的IL-1β显著下降,并且这种下降与运动活动呈负相关(6a,c)图。此外,MkD导致IL-6(与海马和下丘脑的神经变性有关)的下调。较低的海马体IL-6表达与较高的运动活动相关(图6c,d)。MkD后,回肠和海马体IL-8呈持续的边际下降,其水平与运动活动呈负相关,与T迷宫测试中的潜伏期成正比(图6b,c)。MkD后结肠和下丘脑中TNF-α的表达也趋于减少,结肠TNF-α的减少与OPT的有利结果相关(图6a,d)。虽然WT和AD小鼠之间有相反的趋势,但MkD后肠道IL-17降低。另一方面,在AD小鼠的MkD后,IL-10在肠道中升高,而在大脑中降低(图6a-d)。
综上所述,MkD干预通过紧密连接蛋白和降低促炎介质,改善上皮屏障和验证状态,对神经认知和肌肉功能产生积极影响。
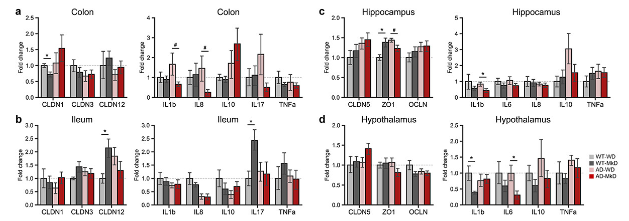
图6:与标WD相比,MkD饮食改善了AD小鼠的肠道和脑屏障完整性,降低了肠道和神经元炎症,并改善了神经认知和行为功能
6、乳酸和亮氨酸,关键代谢物,可能介导MkD对AD病理的改善作用
为了确定MkD衍生的关键代谢物,及其有助于减少炎症和改善屏障功能、神经行为和神经肌肉活动,将粪便和血清的代谢组学特征重叠,以筛选可能通过肠-脑轴输送到大脑的代谢物。
在MkD后,粪便和血清中乳酸和亮氨酸的代谢物含量同时增加,乳酸在粪便中比血清中差异更明显,亮氨酸相反(图7a,b)。为了确认这些代谢物是微生物群衍生的,执行PICRUSt2工作流程来检索微生物群的功能读数。对与乳酸或亮氨酸产生相关的基因相对丰度的比较分析显示:
·在MkD喂养小鼠中,与乳酸产生相关的基因较多,尤其是编码NAD依赖性乳酸脱氢酶的基因,该酶在乳酸产生中起着重要作用(图7c)。这证实了MkD调节的微生物组产生乳酸的能力可能增加,乳酸可以通过循环运输到大脑。
·WD喂养小鼠的肠道微生物群中含有更多参与亮氨酸产生的基因,这表明亮氨酸可能来自MkD本身,而不是由改变的肠道微生物群产生。
为了进一步证实饮食和饮食诱导的关键代谢物变化对大脑的特异性影响,量化了参与乳酸代谢和神经退行性疾病病理学的蛋白质水平,并评估了脑代谢组学特征。
乳酸受体GPR81:MkD喂养小鼠中GPR81的表达水平趋于增加,尤其在 AD小鼠中,尽管AD小鼠的表达水平相对于WT小鼠相对较低(图7d,e)。这一发现表明,MkD后乳酸水平的增加增强了GPR81在大脑中的表达。
脑代谢组分析:WD和MkD喂养AD小鼠的代谢物谱不同(图7f)。AD-MkD小鼠乳酸和神经递质相关代谢物水平更高,而代谢副产物以及能量代谢相关的代谢物在AD-WD小鼠中更丰富。然而,在 WT 和 AD 小鼠中,生物合成前体含量更高,MkD后急性神经毒性副产物琥珀酰丙酮减少(图7g,h)。与粪便和血清代谢物不同,亮氨酸在WD喂养小鼠两种基因型中含量都更高。
此外,通过测量AD的特异性标志评估了饮食对发病机制的直接影响。
Aβ:AD小鼠高于WT小鼠。而MkD喂养对Aβ水平影响不显著。
总tau:个体小鼠的总tau水平不同,但AD-WD小鼠的水平高于其他组。磷酸化的tau蛋白在MkD喂养组略有下降(图7d,e)。
综上所述,MkD通过调节亮氨酸和乳酸、关键代谢物,可能改善AD小鼠大脑功能。
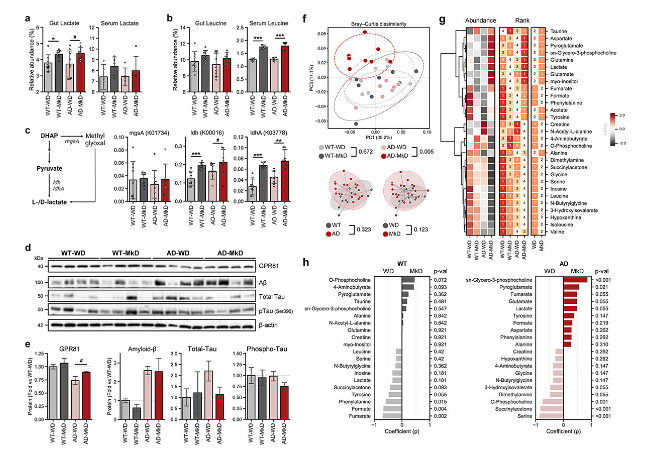
图7:MkD饮食会增加肠道和血液中的乳酸和亮氨酸水平,从而上调乳酸受体并诱导AD小鼠脑代谢组的变化
7、MkD 诱导 AD小鼠海马体的不同转录组变化
基于海马体促炎细胞因子表达减少和海马体GPR81表达优势的发现,使用NanoString神经炎症面板检测海马体中23条神经炎症通路相关的770个基因的转录变化。
总体而言, WT小鼠比AD小鼠表现出更高数多的差异表达基因(DEGs),两组中大多数基因均下调(图8a)。
随后,使用一组潜在基因评估通路富集。每只WD、WT-MkD和AD-MkD小鼠都是分开聚集的,这表明同一基因型饮食组的小鼠具有相似的途径谱(图8b)。AD-MkD小鼠的通路谱变化最为显著,WT-MkD小鼠与其他组相比变化最小(图8b)。
更具体地说,基于全局显著性评分的前六种差异表达途径(DEPs),包括血管生成、先天免疫反应、细胞因子和炎症信号,在WT小鼠MkD后都下调。同时,在AD小鼠的这6种DEPs中,除少突胶质细胞功能外,MkD后星形胶质细胞功能、基质重塑、Notch、自噬、血管生成等通路均上调(图8c)。尽管没有达到统计学上显著的水平,并且在通路特征得分上表现出适度的差异,但一个明显的趋势,即与对应的饮食组相比,一个饮食组中与这些通路相关的基因更多地高表达。
此外,使用先前在各种细胞群中表征的基因来估计细胞丰度(图8d)。在WT组中,除了内皮细胞外,不同饮食之间几乎没有差异,MkD喂养小鼠内皮细胞显著减少。相反,在AD组中,MkD喂养的小鼠的小胶质细胞和星形胶质细胞的丰度高于WD喂养的小鼠。
综上所述,MkD干预后,AD小鼠的海马体炎症通路和细胞丰度出现差异,这可能会影响神经炎症状态。
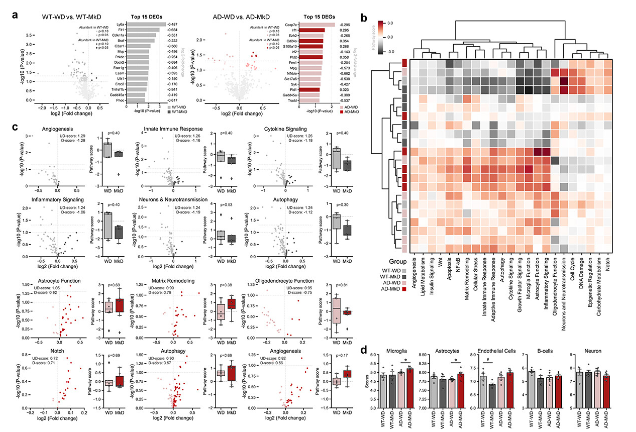
图8:与WD相比,MkD饮食明显调节AD小鼠海马体中的转录阵列
结论
该研究通过综合运用“微生物组+代谢组”分析方法,深入探讨了MkD饮食对AD小鼠模型的影响及潜在机制。研究结果表明,MkD饮食能够有效改善AD小鼠的神经功能行为,为开发基于MkD饮食干预AD治疗方法提供了思路和依据。






