研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
流量密码一“国自然热点”!真正的大佬,只需略微出手,创新性就可拿下10+!
274 人阅读发布时间:2024-12-20 16:02
恶性黑色素瘤是最致命的皮肤癌,其发病率在全球范围内均较高。NRAS基因突变的黑色素瘤具有更具侵袭性的肿瘤生物学特性、较差的预后和较短的生存期,因此,迫切需要新的治疗策略。

湾湾今天分享的是一篇发表在【Journal of Controlled Release】(IF:10.5)上题为“Extracellular vesicles powered cancer immunotherapy: Targeted delivery of adenovirus-based cancer vaccine in humanized melanoma model”的研究,该研究为EV的肿瘤靶向疫苗递送提供了一种有前途的策略,从而提高抗癌功效并增加肿瘤浸润淋巴细胞的浸润。
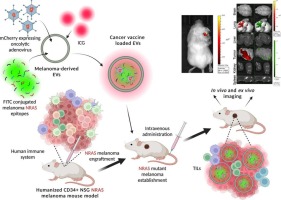
研究成果
1. 评估二维黑色素瘤培养模型中细胞毒性和转导效率
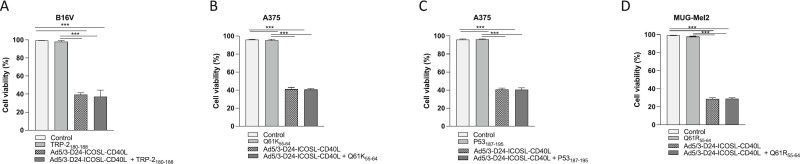
图1 CellTiter 96 AQueous One Solution 细胞增殖测定(MTS)法检测细胞活力。
图1A:B16V细胞系经TRP-2180-188、Ad5/3-D24-ICOSL-CD40L、TRP-2180-188+ Ad5/3-D24-ICOSL-CD40L处理72 h后使用MTS测定细胞活力。
图1B:A375细胞系经Q61K55–64、Ad5/3-D24-ICOSL-CD40L、Q61K55–64+Ad5/3-D24-ICOSL-CD40L处理72 h后使用MTS测定细胞活力。
图1C:A375细胞系经P53187–195、Ad5/3-D24-ICOSL-CD40L、P53187–195+ Ad5/3-D24-ICOSL-CD40L处理72 h后使用MTS测定细胞活力。
图1D:MUG Mel-2细胞系经Q61K55–64、Ad5/3-D24-ICOSL-CD40L、Q61K55–64+Ad5/3-D24-ICOSL-CD40L处理72 h后使用MTS测定细胞活力。
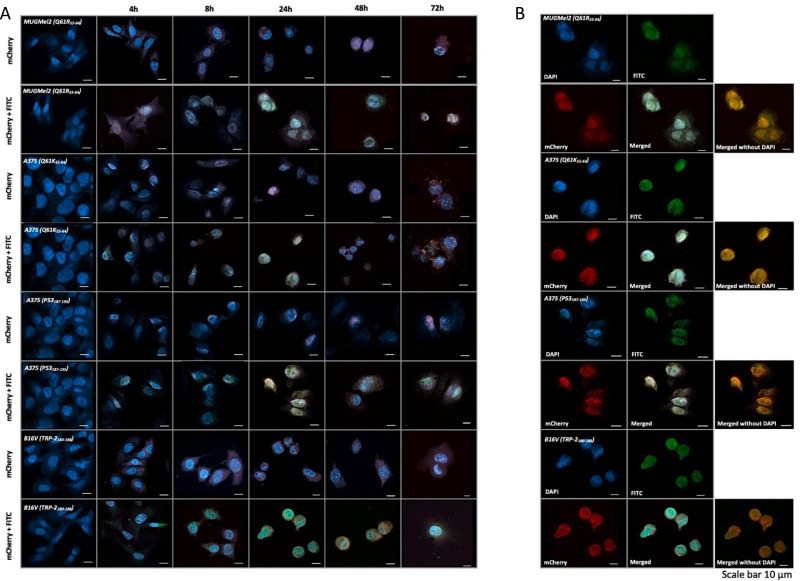
图2通过共聚焦显微镜评估转导效率。
图2A:将黑色素瘤细胞 MUG Mel-2、A375 和 B16V接种在载玻片上。经染色后通过共聚焦显微镜在治疗后的不同时间点在一组黑色素瘤细胞系上单独或与黑色素瘤选择的表位一起评估Ad5/3-D24-mCherry-ICOSL-CD40L内化。
图2B:治疗后24小时溶瘤疫苗在细胞中的定位。
图1结果显示,与未处理的对照细胞相比,所有测试的黑色素瘤细胞系中病毒和联合处理的细胞的细胞活力均显著降低,溶瘤腺病毒与黑色素瘤表位的联合治疗没有改变溶瘤载体的总体体外功效。图2结果显示,荧光标记随着时间的推移显著增加,这一趋势在不同细胞系中是一致的,这表明它们可以内化到细胞中。综上结果突出了疫苗在测试细胞系中的内化能力。
2. 体外肿瘤细胞死亡的免疫原性
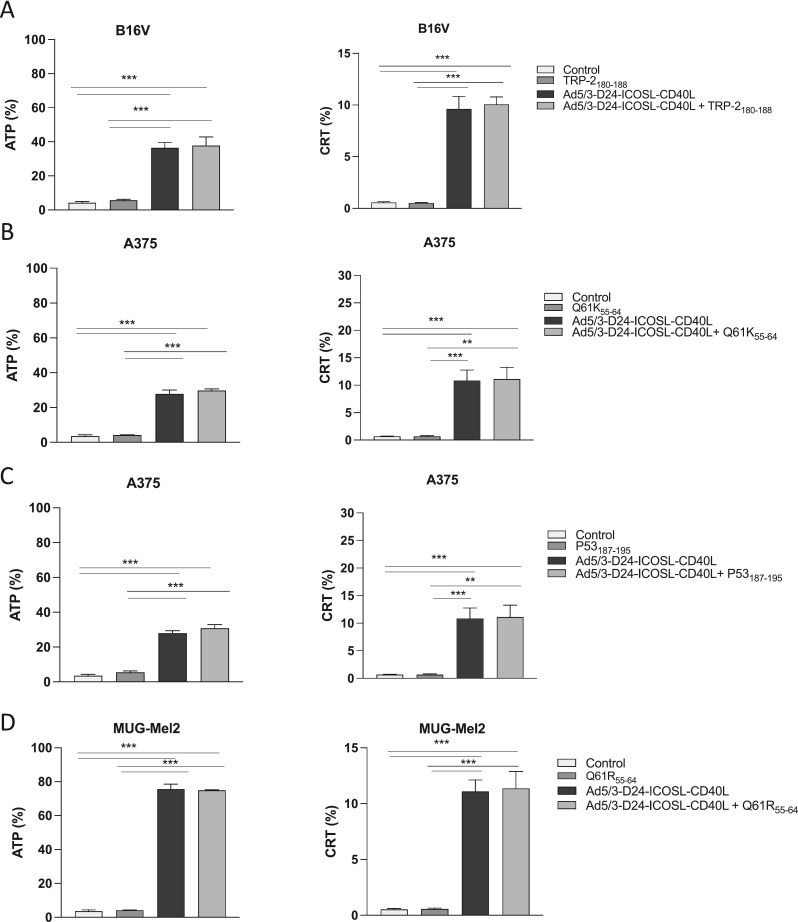
图3评估ATP释放和CRT暴露。
图3A:B16V细胞系分别感染TRP-2180-188、Ad5/3-D24-ICOSL-CD40L、Ad5/3-D24-ICOSL-CD40L+ TRP-2180-188 72小时后评估 ATP释放与CRT 暴露的水平。
图3B:A375细胞系分别感染Q61K55-64、Ad5/3-D24-ICOSL-CD40L、Ad5/3-D24-ICOSL-CD40L+ Q61K55-64 72小时后评估ATP释放与CRT 暴露的水平。
图3C:A375细胞系分别感染P53187-195、Ad5/3-D24-ICOSL-CD40L、Ad5/3-D24-ICOSL-CD40L+ P53187-19572小时后评估ATP释放与CRT 暴露的水平。
图3D:MUG-Mel2细胞系分别感染Q61R55-64、Ad5/3-D24-ICOSL-CD40L、Ad5/3-D24-ICOSL-CD40L+ Q61R55-6472小时后评估ATP释放与CRT暴露的水平。
获得的结果表明,当用病毒和联合疗法处理时,MUG Mel-2细胞最容易发生细胞死亡。
3.黑色素瘤模型的功效研究
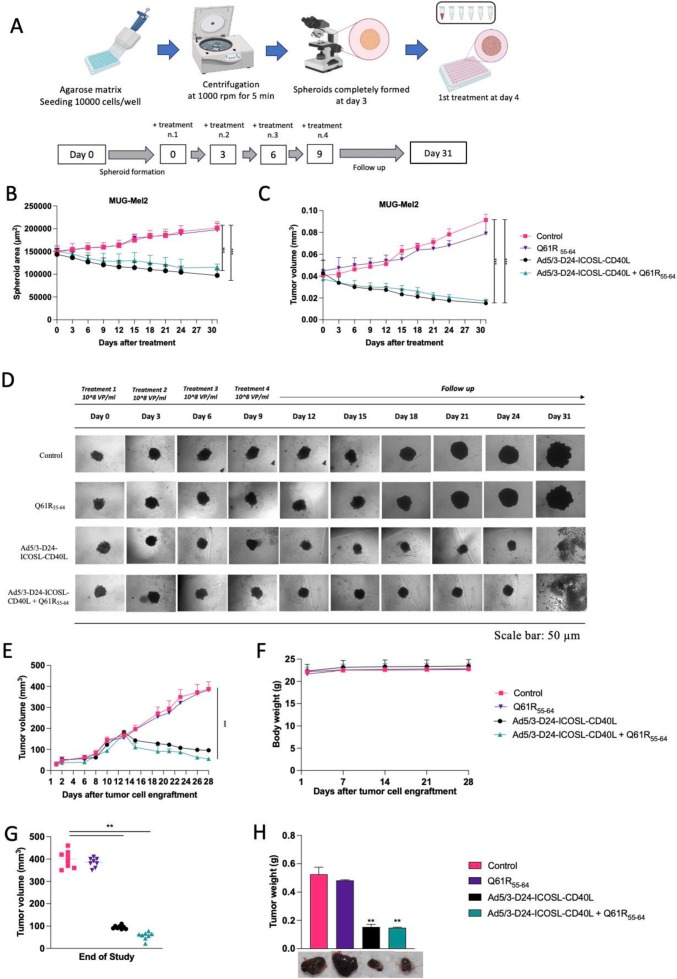
图4使用3D体外MUG Mel-2黑色素瘤和免疫缺陷Balb/c裸鼠模型评价抗肿瘤功效。
图4A:MUG Mel-2黑色素瘤细胞系3D体外球体的方案。
图4B:在整个研究过程中测量的球体面积。
图4C:通过公式评估球体体积。
图4D:随时间变化的3D培养形态。
图4E:在整个实验过程中肿瘤体积(mm3)的测量。
图4F:在整个研究过程中体重的测量。
图4G:在研究结束时记录肿瘤体积。
图4H:在研究结束时评估肿瘤重量。
结果显示,无论是单独使用溶瘤病毒(OV)还是与黑色素瘤特异性抗原表位(Q61R55-64)联合治疗,球体细胞的面积和肿瘤体积均在第31天减少,从而证明了其长期有效性。此外,在小鼠体内观察到抗癌效果,并且治疗的耐受性良好,因此表明其治疗的安全性。
4. MUG Mel-2和经溶瘤疫苗处理的PBMC的3D共培养可提供协同抗癌作用
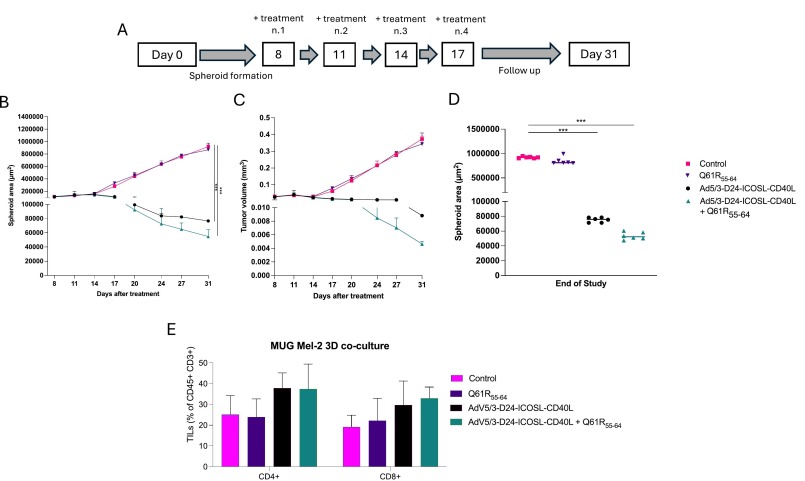
图5在MUG Mel-2 3D共培养模型上评估测试组合疗法的抗癌功效和免疫细胞浸润。
图5A:将MUG Mel-2细胞以7500个细胞/孔的密度接种在96孔中,并以1000 rpm离心5 分钟,形成球状体。第6天,将PBMC以1:4的比例添加到肿瘤球体中。第8天,用Ad5/3-D24-ICOSL-CD40L、Q61R 55 – 64及其组合处理球体。每三天在显微镜下检查一次球体。
图5B-D:每三天测量一次球体的二维尺寸,同时通过应用公式获得体积,使用Zeiss的 AxioVision软件测量面积。
图5E:MUG Mel-2 3D共培养物中肿瘤浸润淋巴细胞CD3 +、CD4 +、CD8 +的水平。使用 BD Lyric FACS Flow采集样品。
这些结果表明腺病毒疫苗能够有效地增强CD4+辅助性T淋巴细胞和CD8+细胞毒性T淋巴细胞的浸润,因此在球体体积变化中发挥关键作用。
5. 细胞外囊泡增强溶瘤疫苗向肿瘤的靶向递送
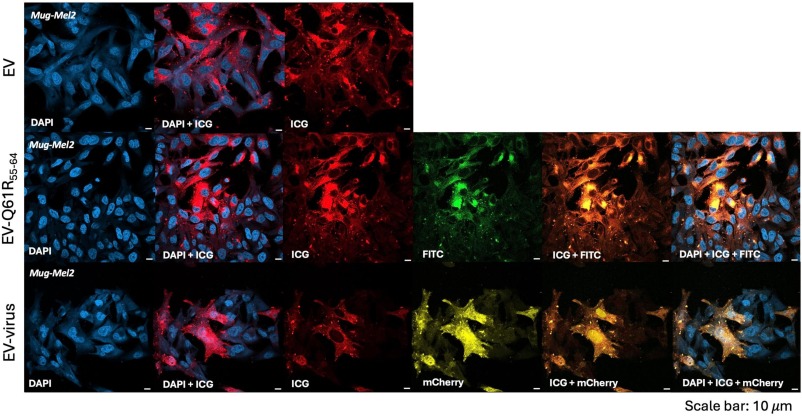
图6 MUG Mel-2 细胞中EV和负载EV的细胞内生物分布。使用配备63×油物镜的Zeiss LSM800进行共焦分析。之后使用EV-Q61R 55 – 64 、EV-Virus和EV制剂处理后对 MUG Mel-2 细胞进行分析。细胞核染色使用DAPI,FITC、ICG和mCherry分别检测黑色素瘤表位Q61R 55 – 64、EV和病毒。
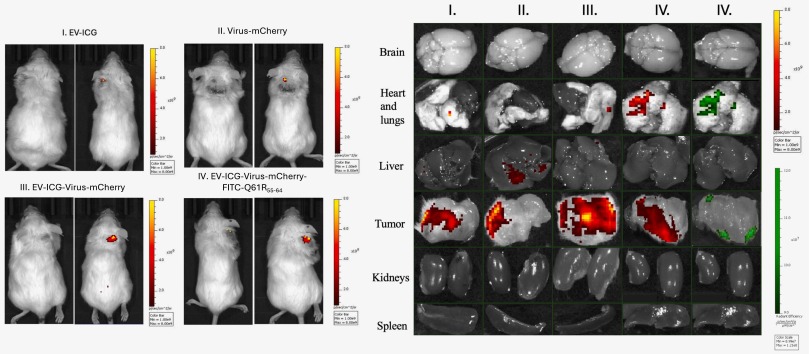
图7黑色素瘤衍生的EV制剂静脉注射治疗小鼠肿瘤区域的荧光代表性图像。
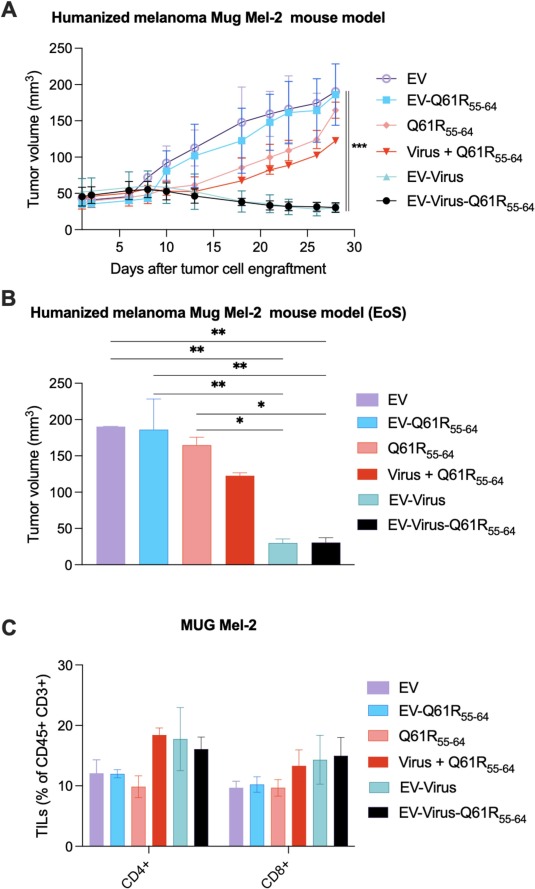
图8在人源化黑色素瘤模型中评估EV、EV-Q61R55-64、Q61R55-64、病毒+ Q61R55-64、EV-Virus和EV-Virus- Q61R55-64的抗肿瘤效果。
图8A:整个研究过程中测量的肿瘤体积(mm3)。
图8B:在研究结束时(第30天)测量肿瘤体积(mm3)。
图8C:收集的肿瘤中肿瘤浸润淋巴细胞CD4+、CD8+的表达水平(研究结束)。使用BD Lyric FACS Flow获得样品。
图6中这些结果表明EV可以在体外将OV和黑色素瘤表位传递到NRAS突变黑色素瘤细胞系中。同时,作者根据图7的结果推测肺内EV相关荧光信号的存在可能与EV表面四跨膜蛋白8的高表达水平有关,根据图8的结果,作者可以推测EV制剂可能改善腺病毒对肿瘤的靶向递送,同时提供针对宿主免疫应答的保护。此外,与单独使用病毒相比,这些制剂可能导致肿瘤组织内的病毒载量增加,从而可能诱导免疫原性细胞死亡,并产生更有效的抗癌反应。值得一提的是,之前已经证明癌症来源的EV可以增强T细胞在肿瘤中的浸润,因此在本研究中作者进行了T细胞表型分析。获得的结果证实了用 EV治疗的小鼠中细胞毒性CD8 + 和 CD4 + T 细胞的浸润增强。
综上所述,作者可以推测载体编码的两种共刺激分子的存在有助于增强肿瘤中CD8 +和 CD4 + T 细胞的浸润。
结论
在这项研究中,作者主张将EV作为溶瘤疫苗的全身递送工具,以增强抗癌效果。此外,作者证明封装到EV中不会改变OV感染癌细胞和诱导CD4+和CD8+ T细胞浸润的能力。总而言之,作者的研究深刻支持使用EV进行溶瘤疫苗的全身给药作为治疗原发性和转移性黑色素瘤的有效治疗策略。此外,所测试的方法可以进一步与检查点抑制剂相结合,以解决免疫抑制性肿瘤微环境问题并通过抑制T细胞激活来抵消。






