研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
这“惊人的机缘”终于轮到了“BC来源的外泌体”!掌握这波神奇机制,震惊科研圈!毕竟突破一呈现,Nature子刊你就有!
724 人阅读发布时间:2024-12-26 10:46
癌细胞分泌包被生物活性物质的细胞外囊泡(EV),以促进体内器官间的交流,并且正在成为肿瘤进展和转移的关键介质,这种情况通常伴随着胆固醇代谢失调。EVs是否参与肿瘤转移过程中胆固醇稳态的控制尚不明确,需要进一步研究。

湾湾今天分享的是发表在【Nature COMMUNICATIONS】(IF:14.7)上题为“Tumor-derived miR-9-5p-loaded EVs regulate cholesterol homeostasis to promote breast cancer liver metastasis in mice”的研究,该研究发现乳腺癌来源的外泌体miR-9-5p通过靶向肝脏中的INSIG1、INSIG2和ATF3基因诱导HMGCR和CH25H的表达,这两种酶参与胆固醇合成和从胆固醇到25羟基胆固醇的转化。值得注意的是,体内miR-9-5p拮抗剂治疗和遗传性CH25H消融可阻止乳腺癌小鼠模型中的肿瘤转移。本研究结果揭示了肿瘤来源的miR-95p在肝转移中的调控机制,通过连接氧甾醇代谢和Kupffer细胞极化,为未来癌症诊断和治疗的应用提供了线索。
研究结果
1.乳腺癌源性EV增强肝脏胆固醇生物合成
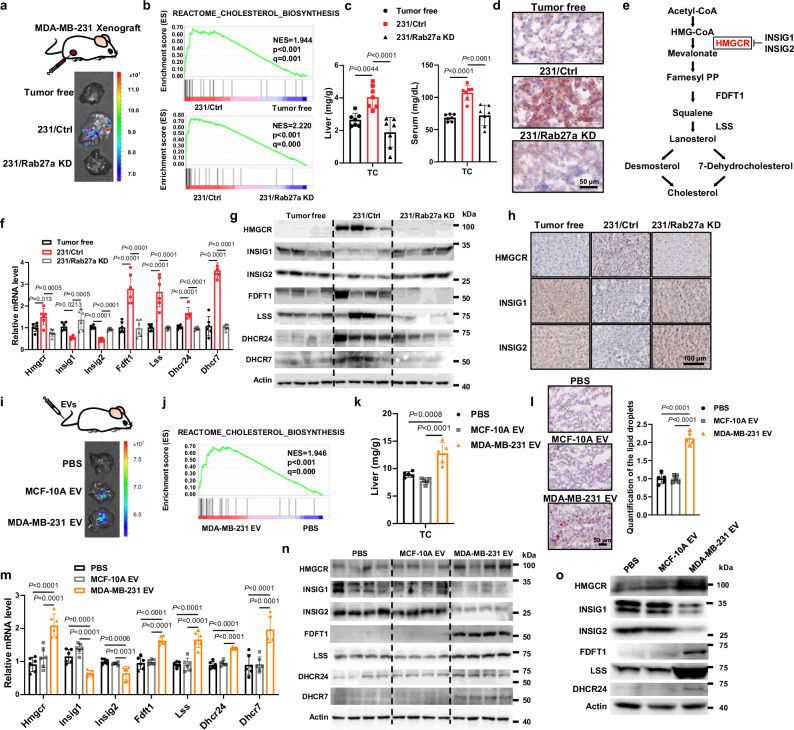
图1a:移植MDA-MB-231/Lck-GFP细胞(231/Ctrl)或MDA-MB-231/Rab27a KD/Lck-GFP细胞(231/Rab27a KD)和无瘤小鼠肝脏中GFP信号的代表性图像。
图1b:对231/Ctrl小鼠和231/ Rab27a KD小鼠和无肿瘤小鼠的肝脏组织进行为期50天的RNA测序和GSEA,发现与指示通路相关的基因富集。
图1c:各组肝脏和血清总胆固醇(TC)。
图1d:肝组织切片的油红O染色图片。
图1e:胆固醇合成途径示意图。
图1f:qRT-PCR显示各组肝脏相对mRNA水平。
图1g:Western blot分析各组肝脏中与胆固醇合成相关的蛋白质。
图1h:肝组织切片中各组蛋白的免疫组化的代表性图像。
图1i:小鼠接受尾静脉注射Lck -GFP标记的EVs后肝脏中的GFP信号。
图1j:对静脉注射EVs 5周的小鼠和对照小鼠的肝组织进行RNA-seq及GSEA检测,发现与胆固醇生物合成途径相关的基因组富集。
图1k:各组肝脏总胆固醇(TC)变化。
图1l:左:尾静脉注射EVs 的NSG小鼠肝切片油红O染色。右:肝脏脂滴定量。
图1m:采用qRT-PCR分析接受指定EVs治疗的NSG小鼠胆固醇合成途径中多个标志物的基因表达。
图1n:Western blot分析接受MCF-10A和MDA-MB-231衍生EVs治疗5周的小鼠肝脏样本的蛋白表达。
图1o:以PBS为对照,用指定的EVs治疗原代肝细胞,Western blo分析与胆固醇合成相关的蛋白表达。
这些结果表明,乳腺癌来源的EVs在体外和体内都增强了胆固醇的生物合成。
2.循环miR-9-5p通过靶向INSIG1和INSIG2诱导胆固醇生物合成
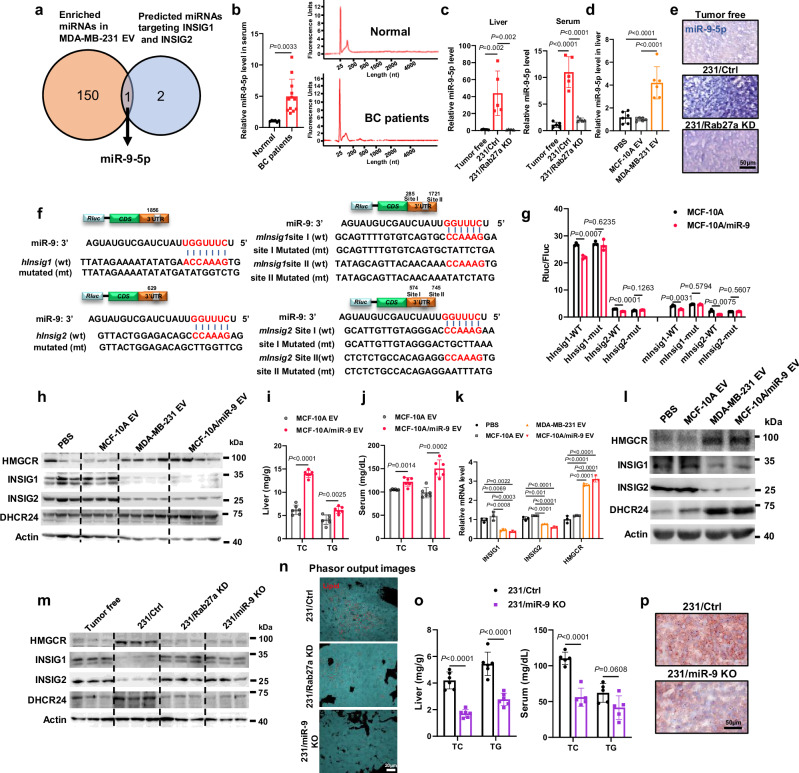
图2a:MDA-MB-231 EVs和MCF-10A EVs中富集的miRNA与Targetscan数据库中针对胆固醇通路INSIG1和INSIG2的miRNA池重叠。
图2b:左:qRT - PCR测定了从正常和乳腺癌患者血清中提取的等量 EVs中的miR-9-5p水平。右:血清EVs的RNA质量。
图2c:qRT - PCR测定接受指示的荷瘤或无瘤小鼠肝脏和血清中miR-9-5p水平。
图2d:qRT - PCR检测接受尾静脉注射指定EVs的小鼠肝脏中miR-9-5p水平。
图2e:原位杂交检测无肿瘤、231/Ctrl和231/Rab27a KD小鼠肝脏中miR-9-5p。
图2f:预测miR-9-5p在人和小鼠INSIGS基因中的结合位点(分别为INSIG1和INSIG2)。图中显示了WT和突变报告基因中相应的序列。
图2g:荧光素酶报告基因检测显示报告基因在MCF-10A和MCF10A/miR-9细胞中对转染的人和小鼠INSIG1或INSIG2的反应性。
图2h:Western blot分析接受EVs注射小鼠肝脏样本。
图2i-j:小鼠肝脏和血清总胆固醇(TC)和甘油三酯(TG)水平。
图2k:用qRT-PCR检测EVs /PBS处理48h后HL7702细胞的基因表达。
图2l:EVs /PBS处理48h后的HL7702细胞Western blot分析。
图2m:Western blot分析各组荷瘤小鼠肝脏样本。
图2n:根据相位图,在各组肝脏中分割LD区。
图2o:荷瘤小鼠肝脏和血清总胆固醇(TC)和甘油三酯(TG)水平。
图2p:肝脏切片采用油红O染色。
这些结果表明,BC来源的miR-9-5p诱导HMGCR表达,通过靶向肝组织中的INSIG1和INSIG2促进胆固醇合成。
3.循环miR-9-5p通过靶向ATF3促进胆固醇向25-HC转化
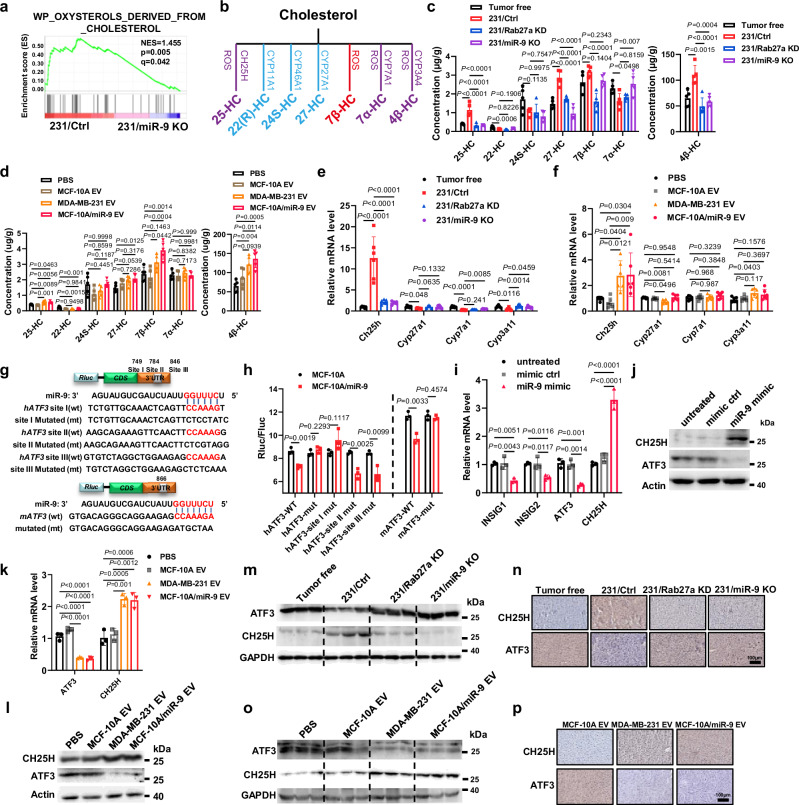
图3a:对移植了MDA-MB-231细胞和231/miR-9 KO细胞的小鼠肝脏进行RNA-seq和GSEA检测,发现与胆固醇途径产生的氧甾醇相关的基因富集。
图3b:胆固醇转化为氧甾醇的示意图。
图3c:LC-MS/ MS分析异种移植NSG小鼠肝脏中胆固醇来源的氧甾醇。
图3d:经尾静脉注射EVs的小鼠肝脏中来源于胆固醇的氧甾醇的LC-MS/MS分析。
图3e:异种移植NSG小鼠肝脏中基因表达的qRT-PCR定量分析。
图3f:qRT-PCR定量分析尾静脉注射EVs后NSG小鼠肝脏基因表达。
图3g:预测人和小鼠ATF3基因中miR-9-5p的结合位点。图中显示了WT和突变报告基因中相应的序列。
图3h:野生型和突变型ATF3 3'UTR报告基因在MCF-10A和MCF-10A/miR-9细胞中对miR-95p的响应性。荧光素酶报告细胞试验显示报告细胞对转染野生型和突变型ATF3 3'UTR在MCF-10A和MCF-10A/miR-9细胞中的响应性。
图3i:miR9-5p mimic或对照转染MCF-10A细胞的qRT-PCR定量基因表达。
图3j:转染miR-9-5p mimic和对照组的MCF-10A细胞的Western blot分析。
图3k:用qRT-PCR方法定量EVs /PBS处理48h后原代肝细胞的基因表达。
图3l:EVs/PBS处理48小时后原代肝细胞的Western blot分析。
图3m:异种移植小鼠肝脏Western blot分析。
图3n:异种移植小鼠肝组织中ATF3和CH25H的免疫组化分析。
图3o:小鼠尾静脉注射EVs后肝脏Western blot分析。
图3p:经尾静脉注射EVs的小鼠肝组织中ATF3和CH25H的免疫组化分析。
这些结果表明,BC源性外泌体miR-9-5p诱导CH25H表达,通过靶向ATF3促进胆固醇转化为25-HC。
4.肿瘤代谢物25-HC促进BC肝和肺转移
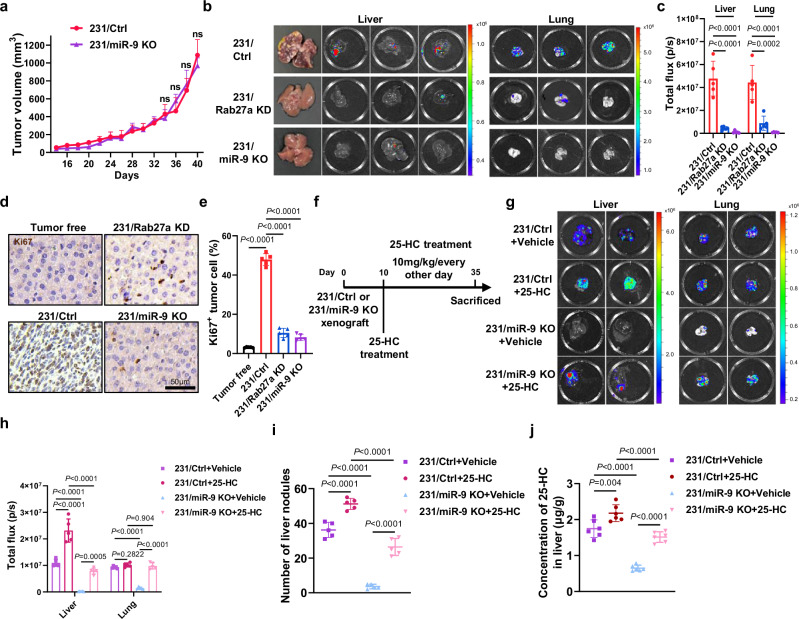
图4a:观察异种移植小鼠的肿瘤体积。
图4b-c:各组接种小鼠的代表性生物发光图像及定量分析。
图4d-e:代表性IHC图像显示Ki67染色和Ki67+肿瘤细胞的总体百分比。
图4f:25-HC处理小鼠模型示意图。
图4g-h:各组接种小鼠的代表性生物发光图像及定量分析。
图4i:肝结节的定量。
图4j:ELISA检测各组肝脏25-HC水平。
5.阻断CH25H抑制BC肝和肺转移
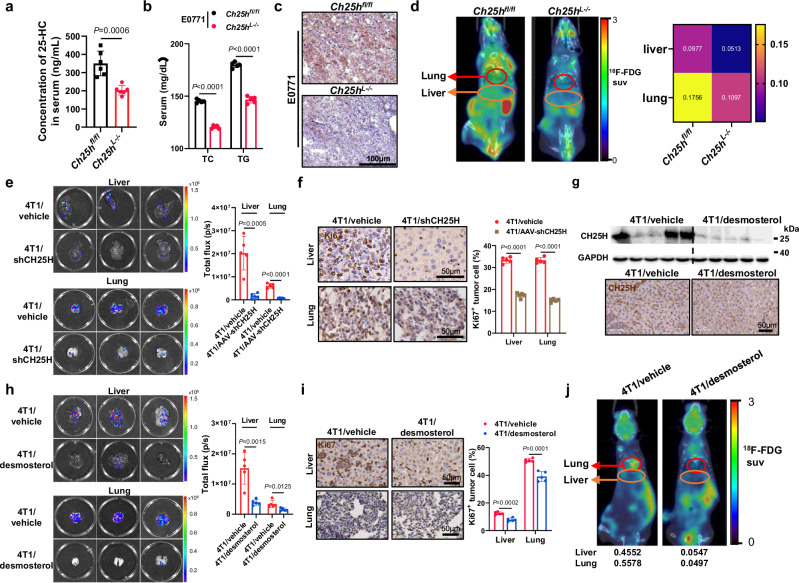
图5a:CH25H肝脏条件敲除(CH25HL - / -)和对照组(CH25Hfl/fl)小鼠血清25-HC的LC-MS/MS分析。
图5b:检测CH25H肝脏条件敲除(Ch25hL - / -)和对照(Ch25hfl/fl)小鼠总胆固醇(TC)和甘油三酯(TG)水平。
图5c:异种移植E0771的Ch25hL - / -和Ch25hfl/f小鼠肝脏切片用油红O染色。
图5d:在CH25H肝脏特异性KO和WT小鼠中,使用18F-FDG进行具有代表性的PET/CT成像以获取肝脏和肺的摄取并定量。
图5e:各组接种小鼠肝、肺转移部位的代表性生物发光图像及定量。
图5f:具有代表性的免疫组图显示Ki67染色和Ki67+肿瘤细胞在指定组中的总体百分比。
图5g:各组肝脏CH25H的Western blot分析(上);各组肝脏组织中IHC和CH25H的含量(下)。
图5h:各组接种小鼠肝、肺转移部位的代表性生物发光图像及定量。
图5i:具有代表性的免疫组图显示Ki67染色和指征组肝脏和肺部Ki67+肿瘤细胞的总体百分比。
图5j:用18F-FDG进行代表性PET/CT成像,以获取指示小鼠肝和肺的摄取和定量。
这些数据表明,25-HC促进了肝脏和肺转移,而敲除miR-9-5p或阻断CH25H表达完全消除了25-HC对肿瘤转移的影响。
6.25-HC通过提高MAFK水平诱导Kupffer细胞向M2型分化,促进肝转移
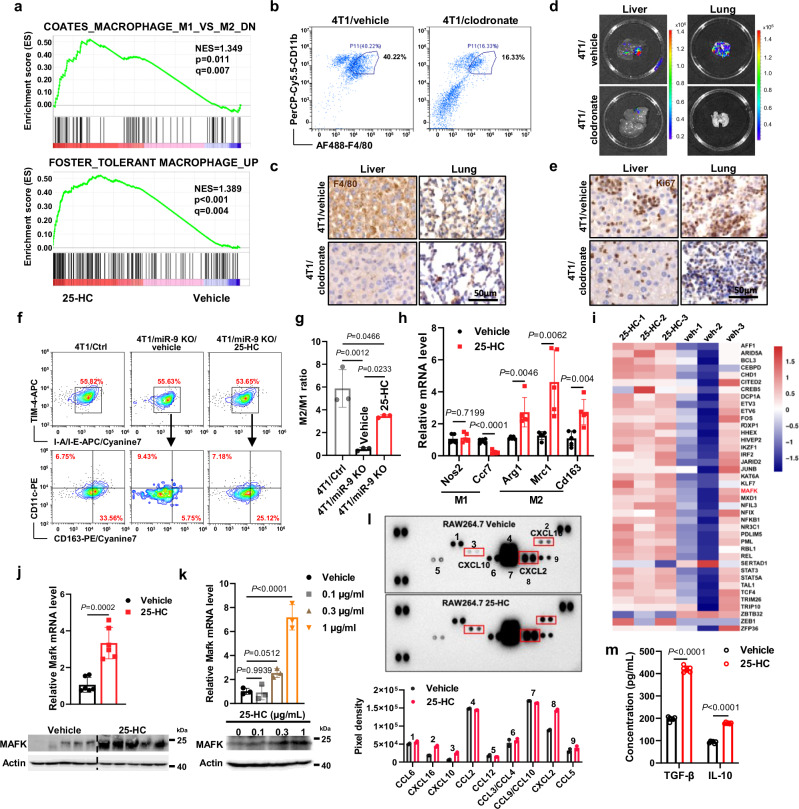
图6a:经25-HC和载体处理的RAW264.7细胞进行RNA-seq和GSEA检测,发现巨噬细胞通路相关基因组富集。
图6b:流式细胞术定量检测指定组纯化后表达CD11b+和F4/80+的Kupffer细胞。
图6c:各组肝、肺切片F4/80免疫组化分析。
图6d:各组肝、肺转移部位的代表性生物发光图像。
图6e:各组肝、肺切片Ki67免疫组化分析。
图6f:选择表达TIM4+、I-A/I-Eint的纯化Kupffer细胞,染色并进一步分析CD163和CD11c的表达的代表性的流式细胞术结果。
图6g:流式细胞术结果中M2/M1比值的定量。
图6h:qRT-PCR检测各组小鼠肝组织RNA水平。
图6i:热图显示了基于RNAseq数据的耐受巨噬细胞通路相关的选定基因的相对水平。
图6j:各小鼠肝脏中Mafk相对mRNA水平(上);Western blot分析各组小鼠肝脏(下)。
图6k:25-HC剂量依赖性处理48 h后RAW264.7细胞中Mafk的qRT-PCR分析(上);25-HC剂量依赖性处理48h后Raw264.7细胞的Western blot分析(下)。
图6l:采用小鼠趋化因子阵列试剂盒检测25-HC处理和对照raw264.7细胞培养基中各种趋化因子的不同表达和定量。
图6m:采用ELISA试剂盒检测载药和25-HC处理的BMDM细胞分泌的TGF-β和IL-10表达。
这些数据表明,25-HC诱导巨噬细胞向M2型极化,促进肺和肝转移。
7.外源性表达INSIGs和ATF3可阻断miR -9诱导的肿瘤转移
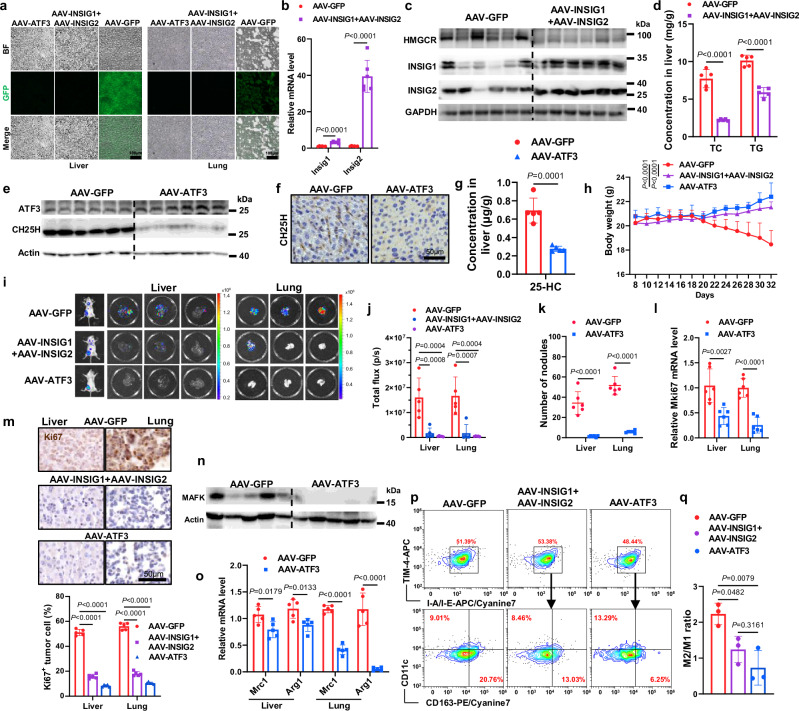
图7a:小鼠尾静脉注射AAV-GFP、AAV-ATF3和AAV-INSIG1 + INSIG2病毒后肝脏和肺部的GFP信号。
图7b:尾静脉注射AAV-GFP、AAVINSIG1和AAV-INSIG2病毒小鼠肝脏中基因表达的定量分析。
图7c:Western blot显示小鼠接受尾静脉注射AAV-GFP、AAV-INSIG1和AAV-INSIG2病毒后肝脏中与胆固醇合成相关的关键蛋白的表达。
图7d:AAV-GFP和AAV-INSIG1 + INSIG2组小鼠肝脏总胆固醇(TC)和甘油三酯(TG)。
图7e:Western blots显示接受尾静脉注射AAV-GFP和AAV-ATF3病毒的小鼠肝脏中蛋白表达。
图7f:代表性免疫组化图像显示CH25H染色。
图7g:AAV-GFP和AAV-ATF3组肝脏25-HC水平LC-MS/MS分析。
图7h:监测各组小鼠的体重。
图7i-j:各组小鼠的代表性生物发光图像及定量分析。
图7k:肝和肺转移结节的定量分析。
图7l:小鼠肝、肺组织中Mki67的RNA水平。
图7m:代表性IHC图像显示Ki67染色和Ki67+肿瘤细胞的总体百分比。
图7n:Western blots显示小鼠接受尾静脉注射AAV-GFP和AAV-ATF3病毒后肝脏中的蛋白表达。
图7o:AAV-GFP和AAV-ATF3组小鼠肝脏和肺部M1和M2标记基因RNA水平。
图7p:选择表达TIM4+、I-A/I-Eint的纯化Kupffer细胞,染色并进一步分析CD163和CD11c的表达。显示了代表性的流式细胞术结果。
图7q:流式细胞术结果中M2/M1比值的定量。
这些数据表明,miR-9-5p介导的胆固醇稳态调节的显著恢复。
8.miR-9-5p沉默减弱了25-HC介导的肿瘤转移
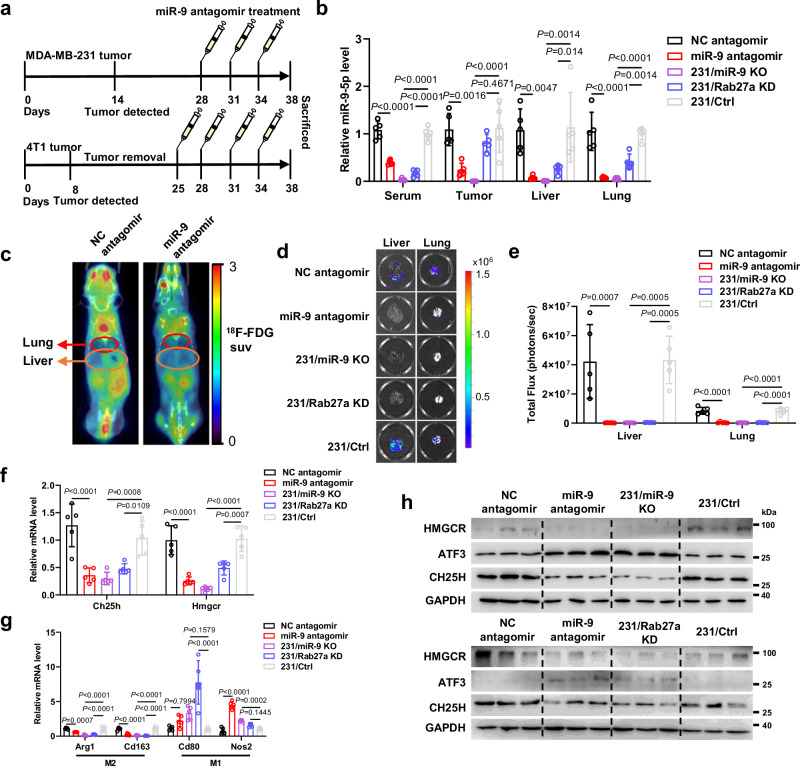
图8a:antagomir处理小鼠模型示意图。
图8b:RT-QPCR检测经antagomir和231/Ctrl、231/Rab27a KD和231/miR-9 KO处理的231/Luc细胞异种移植小鼠血清、肿瘤、肝脏和肺部miR-9-5p水平。
图8c:使用18F-FDG进行代表性PET/CT成像,以获取经antagomir处理的4T1/Luc细胞异种移植小鼠的肝和肺摄取和定量。
图8d:antagomir和231/Ctrl、231/Rab27a KD和231/miR-9 KO处理的异种移植小鼠肝脏和肺转移部位的代表性生物发光图像。
图8e:用antagomir和231/Ctrl、231/Rab27a KD和231/miR-9 KO处理的异种移植小鼠的肝和肺转移的定量。
图8f:用antagomir和231/Ctrl、231/Rab27a KD和231/miR-9 KO处理的异种移植小鼠肝脏中基因表达的定量。
图8g:异种移植小鼠肝脏基因表达的定量分析。
图8h:Western blot分析使用antagomir和231/Ctrl、231/ Rab27a KD和231/miR-9 KO处理的异种移植小鼠的肝脏样本。
这些数据表明,miR-9-5p的沉默通过改变巨噬细胞极化减弱了25-HC介导的肿瘤转移,表明靶向循环miR9-5p和25-HC生物合成的潜在治疗应用。
9.循环miR-9-5p与BC患者转移相关
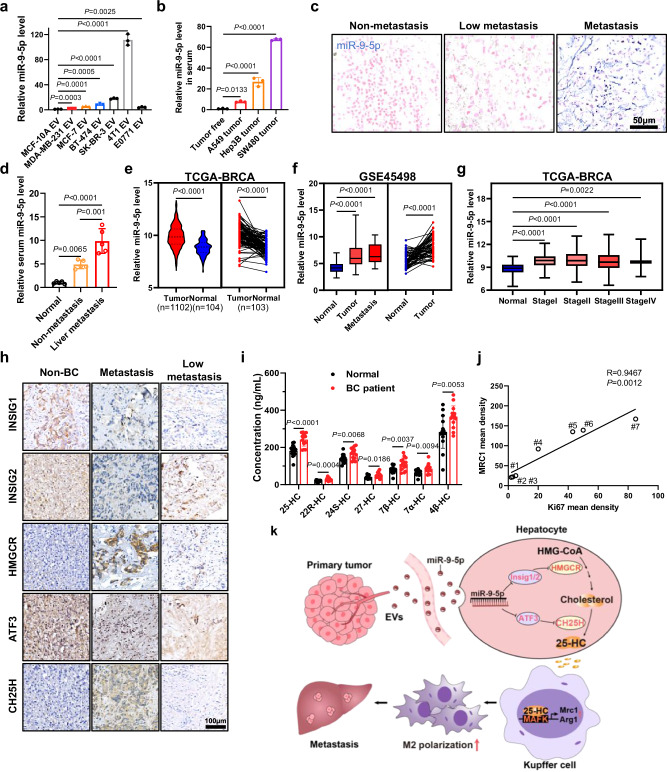
图9a:RT-QPCR测定来自各细胞的等量EVs中的miR-9-5p水平。
图9b:RT-QPCR检测异种移植小鼠血清中miR-9-5p水平。
图9c:乳腺癌患者肝转移灶miRNA原位杂交(miRNA- ish)的代表性图像。
图9d:rt - qpcr检测正常或有无转移的BC患者血清中miR-9-5p水平。
图9e:TCGA数据库中BRCA肿瘤样本中miR-9-5p的表达水平。
图9f:GEO数据库中BRCA肿瘤样本miR - 9-5p的表达水平。
图9g:miR-9-5p在不同分期BRCA肿瘤样本中的表达水平。
图9h:HMGCR、CH25H、INSIG1、INSIG2和ATF3在BC和非BC个体肝转移中的表达的免疫组化分析。
图9i:LC-MS/MS分析正常和BC患者血清中来源于胆固醇的氧甾醇。
图9j:BC转移性肝患者MRC1与Ki67表达的相关性分析。
这些数据表明,循环中的miR-9-5p调节胆固醇稳态和25-羟基胆固醇作为肿瘤代谢物通过调节肝脏中的Kupffer细胞极化诱导BC转移。
总结
该研究揭示了利用miR-9-5p作为一种新的基于血液的生物标志物来识别BC转移高风险患者的可能性,以指导预防性筛查和早期干预。考虑到CH25H在我们的模型中是调节肿瘤转移的关键酶,靶向其表达或阻断其活性可能是一种有效的临床应用策略。靶向蛋白水解嵌合体(PROTAC)正在成为一种新兴的治疗方式,具有治疗致病蛋白的潜力,这些蛋白在历史上一直是传统小分子靶向治疗的高度挑战。因此,PROTACs靶向CH25H的研究将是下游临床应用治疗癌症的有力策略。






