研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
觉醒吧—我的大脑!国自然热点“细胞外囊泡”延缓大脑功能减退,15+的绝妙思路!
394 人阅读发布时间:2024-12-27 14:18
阿尔茨海默病 (AD) 会引起认知和情绪障碍相关的病理变化,目前的 AD 治疗策略并不能有效减缓其进展。因此,能够有效抑制多种病理变化(包括神经炎症信号级联)的进展,并在初始AD诊断后长时间维持更好的认知和情绪功能的新疗法具有重要意义。研究发现,源自人类诱导多能干细胞 (hiPSC)的神经干细胞 (NSC)的抗炎细胞外囊泡 (EVs)(hiPSC-NSC-EVs)具有强大的治疗特性。此外,EVs也可以用于非侵入性的鼻内给药(IN),用于治疗神经退行性疾病,EV在IN给药后迅速渗透到整个大脑。

湾湾今天分享的是一篇发表在【J EXTRACELL VESICLES】(IF:10.5)上题为“Extracellular vesicles from human-induced pluripotent stem cell-derived neural stem cells alleviate proinflammatory cascades within disease-associated microglia in Alzheimer's disease”的研究,该研究首次证明了 hiPSC-NSC-EV 通过诱导激活的小胶质细胞和反应性星形胶质细胞的转录组变化来抑制AD模型中的神经炎症信号级联反应。
研究成果
1. 来自人诱导多能干细胞来源的神经干细胞的细胞外囊泡(hiPSC-NSC-EVs)掺入引发5xFAD小鼠小胶质细胞(DAM)内的转录组变化
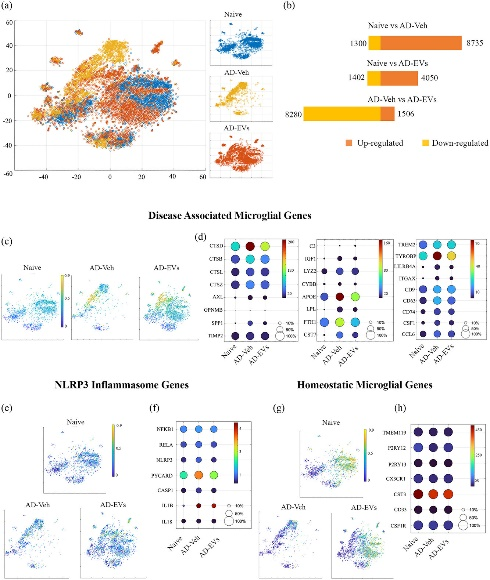
图1经鼻给予来自人诱导多能干细胞来源的神经干细胞的细胞外囊泡(hiPSC-NSC-EVs)改变了与疾病相关的小胶质细胞(DAM)相关的基因表达,以及给予72小时后5x 家族性 AD (5xFAD) 小鼠小胶质细胞中NOD-, LRR-和含热蛋白结构域的蛋白3 (NLRP3)炎症小体的激活。
图1a:naïve、AD-Veh和AD-EVs组小胶质细胞的不同t-SNE散点图。
图1b:与naïve组相比,AD-Veh和AD-EVs组中上调和下调的小胶质细胞基因的总数。
图1c-d:naïve、AD-Veh、AD-EVs组小胶质细胞不同DAM基因的Ucell评分散点图和点图。
图1e-f:不同组小胶质细胞中不同NLRP3炎症小体基因的Ucell评分散点图和点图。
图1g-h:不同组小胶质细胞内不同稳态小胶质细胞基因的Ucell评分散点图和点图。
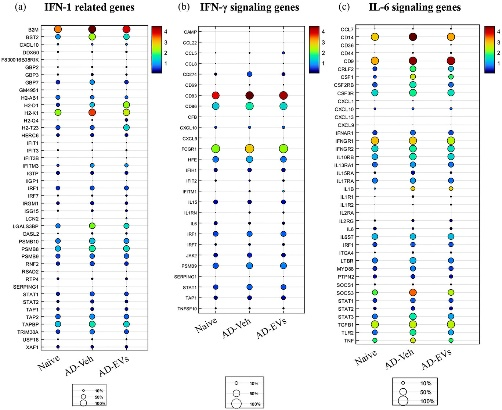
图2鼻内施用hiPSC-NS-EVs的细胞外囊泡改变了与干扰素-1 (IFN-1)、干扰素-γ (IFN-γ)、白介素-6 (IL-6)相关的基因的表达。
图2a:naïve、AD-Veh和AD-EVs组之间与IFN-1信号传导通路相关的多个基因的表达。
图2b:naïve、AD-Veh和AD-EVs组之间与IFN-γ信号传导通路相关的多个基因的表达。
图2c:naïve、AD-Veh和AD-EVs组之间与IL-6信号传导通路相关的多个基因的表达。
图1结果表明在5xFAD小鼠中注射hiPSC-NSC-EVs会导致小胶质细胞和星形胶质细胞发生显著的转录组变化,含热蛋白结构域的蛋白3(NLRP3)、干扰素-1 (IFN-1)、干扰素-γ (IFN-γ)和白介素-6(IL-6)信号传导的增加得到缓解。
图2表明与naïve组相比,AD-Veh组中大多数基因的表达上调,但与AD-Veh组相比,AD-EVs治疗组中大多数基因的表达降低。
2. hiPSC-NSC-EVs可降低Aβ42诱导的人小胶质细胞活化
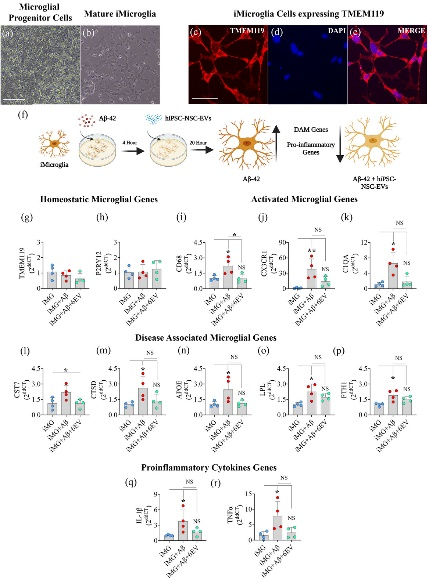
图3鼻内施用人诱导多能干细胞衍生的神经干细胞 (hiPSC-NSC-EVs) 的细胞外囊泡抑制了Aβ42诱导的hiPSC衍生的小胶质细胞的激活。
图3a-b:hiPSC的祖细胞和成熟小胶质细胞。
图3c-e:成熟小胶质细胞中TMEM119的表达。
图3f:涉及Aβ42暴露于iMicroglia随后进行hiPSC-NSC-EVs治疗的实验的图示。
图3g-r:条形图分别比较稳态基因、激活的小胶质细胞基因、疾病相关小胶质细胞(DAM)基因和促炎基因的表达对照、Aβ42暴露、Aβ42暴露和hiPSC-NSC-EVs处理的培养物之间iMicroglia中的细胞因子基因。
结果表明在雄性和雌性5xFAD小鼠3个月大时进行hiPSC-NSC-EVs干预,可预防5个月大时认知和情绪障碍的发生。
3. hiPSC-NSC-EVs给药可保留5月龄时的认知、记忆和情绪功能,且能减少海马体中的小胶质细胞簇和数量
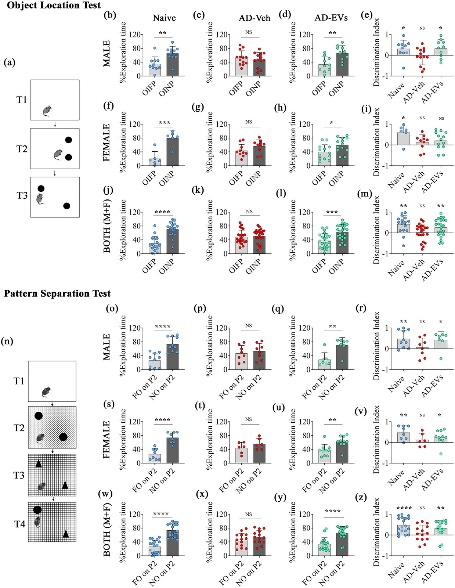
图4 hiPSC-NSC-EVs的细胞外囊泡经鼻给5xFAD小鼠保留了认知功能。
图4a:描绘了物体定位测试(OLT)中的不同试验(T1-T3)。
图4b-d:柱状图比较了在naïve、AD-Veh和AD-EVs组中,雄性小鼠在熟悉位置(OIFP)的探索时间百分比vs .在新位置(OINP)的探索时间百分比。
图4e:条形图使用单样本t检验比较雄性小鼠的OINP辨别指数 (DI)。
图4f-h:柱状图比较了在naïve、AD-Veh和AD-EVs组中,雌性小鼠在熟悉位置(OIFP)的探索时间百分比vs .在新位置(OINP)的探索时间百分比。
图4i:条形图使用单样本t检验比较雌性小鼠的OINP辨别指数 (DI)。
图4j-l:柱状图比较了在naïve、AD-Veh和AD-EVs组中,两性小鼠在熟悉位置(OIFP)的探索时间百分比vs .在新位置(OINP)的探索时间百分比。
图4m:条形图使用单样本t检验比较两性小鼠的OINP辨别指数 (DI)。
图4n:模式分离测试 (PST) 中的不同试验 (T1-T4)。
图4o-q:柱状图比较了在naïve、AD-Veh和AD-EVs组中,雄性小鼠对熟悉物体(P2)的探索时间百分比(FO)以及对P2的探索时间百分比(NO)。
图4r:条形图使用单样本t检验比较雄性小鼠的P2NO的辨别指数 (DI)。
图4s-u:柱状图比较了在naïve、AD-Veh和AD-EVs组中,雌性小鼠对熟悉物体(P2)的探索时间百分比(FO)以及对P2的探索时间百分比(NO)。
图4v:条形图使用单样本t检验比较雌性小鼠的P2NO的辨别指数 (DI)。
图4w-y:柱状图比较了在naïve、AD-Veh和AD-EVs组中,两性小鼠对熟悉物体(P2)的探索时间百分比(FO)以及对P2的探索时间百分比(NO)。
图4z:条形图使用单样本t检验比较两性小鼠的P2NO的辨别指数 (DI)。
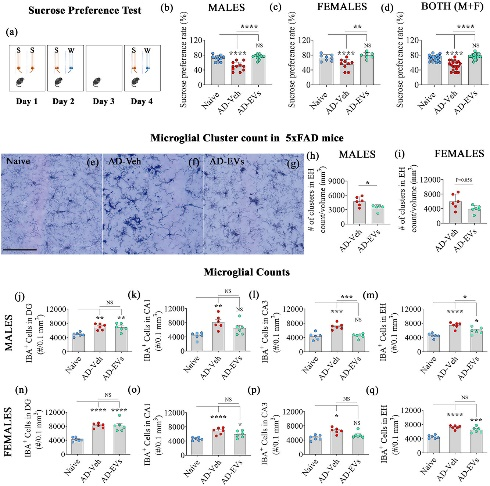
图5将hiPSC-NSC-EVs的细胞外囊泡鼻内给予5xFAD小鼠可防止快感缺失并减少小胶质细胞簇和数量。
图5a:蔗糖偏好测试所采用的实验设计。
图5b-d:条形图比较了naïve组、AD-Veh组和AD-EVs组中雄性、雌性和雄性+雌性的蔗糖偏好率(SPR)。
图5e-g:naïve组、AD-Veh和AD-EVs组中小胶质细胞簇的代表性图像。
图5h-i:条形图比较每mm3的小胶质细胞簇数量naïve组、AD-Veh组和AD-EVs组中雄性和雌性的海马单位面积。
图5j-q:条形图比较了齿状回、CA1亚区、CA3亚区和每 0.1 mm 3区域的雄性和雌性中小胶质细胞的数量,naïve组、AD-Veh组和AD-EVs组之间的整个海马体。
结果表明,在雄性和雌性5xFAD小鼠3个月大时进行hiPSC-NSC-EVs干预,可预防5个月大时认知和情绪障碍的发生;hiPSC-NSC-EVs治疗减少了雄性5xFAD小鼠的小胶质细胞簇和数量。
4. hiPSC-NSC-EVs处理可在较长时间内维持DAM基因的低表达
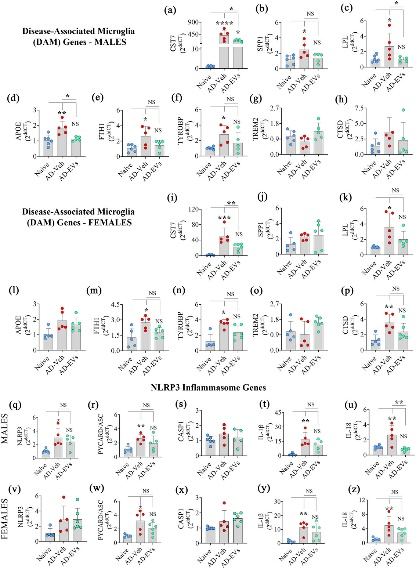
图6将hiPSC-NSC-EVs的细胞外囊泡鼻内给予5xFAD小鼠,可使与疾病相关DAM和炎症小体激活相关的基因表达正常化。
图6a-p:条形图比较了naïve、AD-Veh和AD-EVs组中雄性和女性雌性海马体中DAM基因(cst7、spp1、lpl、apoe、fth1、tyrobp、trem2、ctsd)的表达组。
图6q-z:条形图比较了雄性海马体中与NOD-、LRR-和Pyrin结构域蛋白3 (NLRP3) 炎性体激活 (nlrp3、pycard、casp1、il-1β、il-18) 相关的基因的表达以及naïve组、AD-Veh组和AD-EVs组之间的雌性。
结果在EVs给药后72小时观察到的hiPSC-NSC-EVs治疗对DAM基因的调节作用持续到EVs治疗后2个月。
5. hiPSC-NSC-EVs可持久抑制NLRP3炎症小体的活化
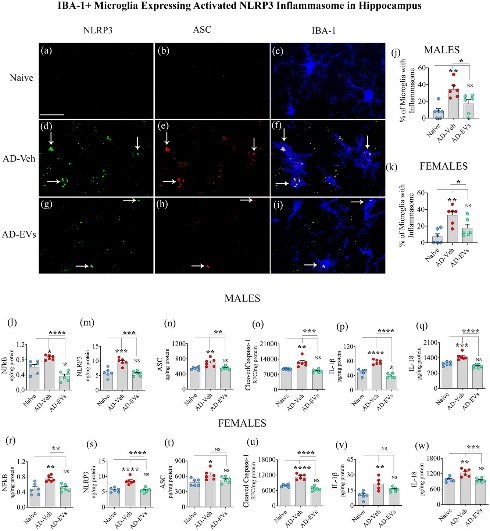
图7将hiPSC-NSC-EVs的细胞外囊泡鼻内给予5xFAD小鼠,可抑制含NOD、LRR和 NLRP3炎性体复合物的形成和激活。
图7a-i:NLRP3炎性体复合物的例子,该复合物在来自海马CA3亚区的IBA-1+小胶质细胞(蓝色)中共表达NLRP3(绿色)和包含CARD(ASC,红色)的凋亡相关斑点样蛋白。
图7j-k:条形图比较了雄性和雌性中小胶质细胞与炎性复合体的百分比。
图7l-w:条形图比较了NLRP3炎性体激活介质的浓度(NF-kB、NLRP3、ASC 和 cleaved caspase-1,naïve组、AD-Veh组和AD-EVs组之间雄性和雌性的最终产物(IL-1β、IL-18)。
综上结果表明,hiPSC-NSC-EVs可持久抑制NLRP3炎症小体的活化。
6. hiPSC-NSC-EVs治疗防止p38/MAPK信号传导过度激活,诱导cGAS-STING信号传导的持久抑制
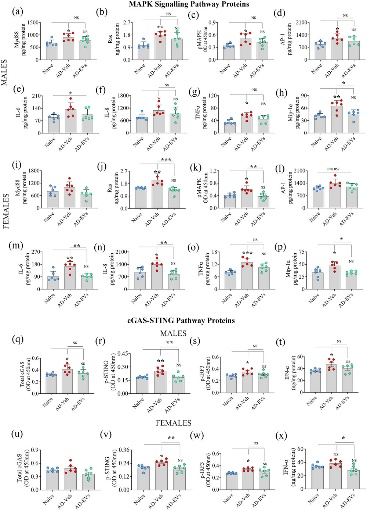
图8将hiPSC-NSC-EVs的细胞外囊泡鼻内给予5xFAD小鼠,可阻止p38/MAPK和环GMP-AMP合酶 (cGAS)以及磷酸化刺激物的激活干扰素基因 (p-STING)信号传导。
图8a-p:条形图比较了p38/MAPK激活的各种成分(MyD88、Ras、pMAPK、AP-1)和naïve组、AD-Veh组和AD-EVs组之间的雄性和雌性中的最终产物(IL-6、IL-8、TNFα、Mip-1α)。
图8q-x:条形图比较雄性和雌性组中总环GMP-AMP合酶 (cGAS)、干扰素基因刺激物 (p-STING)、p-干扰素调节因子 3 (p-IRF3)、IFN -α。
图8a-p发现抑制hNSC-EVs介导的NLRP3炎性体激活可防止p38/MAPK信号下游的过度激活;在EVs给药后 72 小时观察到的hiPSC-NSC-EVs对IFN-1信号传导的调节作用持续到EVs治疗后约2个月(图8q-x)。
7. hiPSC-NSC-EVs给药减少淀粉样斑块负荷和海马组织裂解物中的p-tau
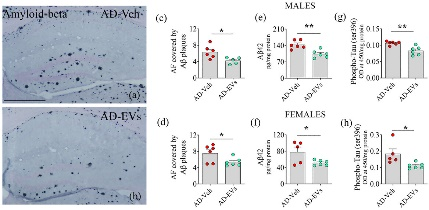
图9将hiPSC-NSC-EVs的细胞外囊泡鼻内给予5xFAD小鼠,可减少淀粉样斑块和磷酸化 tau蛋白。
图9a-b:接受载体Veh或 hiPSC-NSC-EVs的5xFAD小鼠海马中淀粉样斑块的分布。
图9c-h:条形图比较了在AD-Veh和AD-EVs组之间的雄性和雌性中淀粉样斑块的面积分数、可溶性Aβ42和p-tau的浓度。
结果发现hiPSC-NSC-EVs介导的神经炎症级联反应减少导致5xFAD小鼠大脑中淀粉样斑块、Aβ42产生和p-tau减少。
结论
本研究的结果在雄性和雌性5xFAD小鼠模型中,首次提供了证据证明在AD的早期阶段给予hiPSC-NSC-EVs可以抑制神经炎症信号级联反应,抑制海马中的Aβ斑块和p-tau的程度,从而在疾病的晚期阶段保持更好的认知和情绪功能。






