研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
解析Wnt信号肽,推动外泌体研究飞跃!IF:11.7优质佳作,还等什么?赶紧上车!
352 人阅读发布时间:2025-01-02 09:34
有研究表明,外泌体EVs表面分泌不同的Wnt蛋白,并且EVs-Wnt完全能够在靶细胞中引发适当的信号传导,虽然EVs对于长距离Wnt信号传导发挥着重要作用,但Wnt如何与这些迁移细胞器连接仍未可知。

湾湾今天分享的是一篇发表在【SCIENCE ADVANCES】(IF:11.7)上题为“Identification of the Wnt signal peptide that directs secretion on extracellular vesicles”的研究,研究发现Wnt7a在肌肉损伤后在细胞外囊泡(EVs)表面长距离分泌。且在Wnt中定义了EVs分泌所需的信号肽区域,称为外泌体结合肽(EBP)。将EBP添加到一种不相关的蛋白中,直接在EVs上分泌。Wnt7a-EV的分泌不需要棕榈酰化和信号肽。Coatomer被鉴定为EBP的EVs结合蛋白。对共晶结构、结合热力学和诱变的分析发现,一个双赖氨酸基序介导EBP与涂层的结合,在Wnt家族中具有保守功能。作者发现EBP是Wnt7a再生过程中体内表达生物活性所必需的。总的来说,该研究已经阐明了Wnt在EVs分泌的结构基础和独特性,替代规范分泌,为创新的治疗靶向策略和全身蛋白质递送开辟了道路。
研究成果
1.肌肉损伤后Wnt7a在EVs上分泌
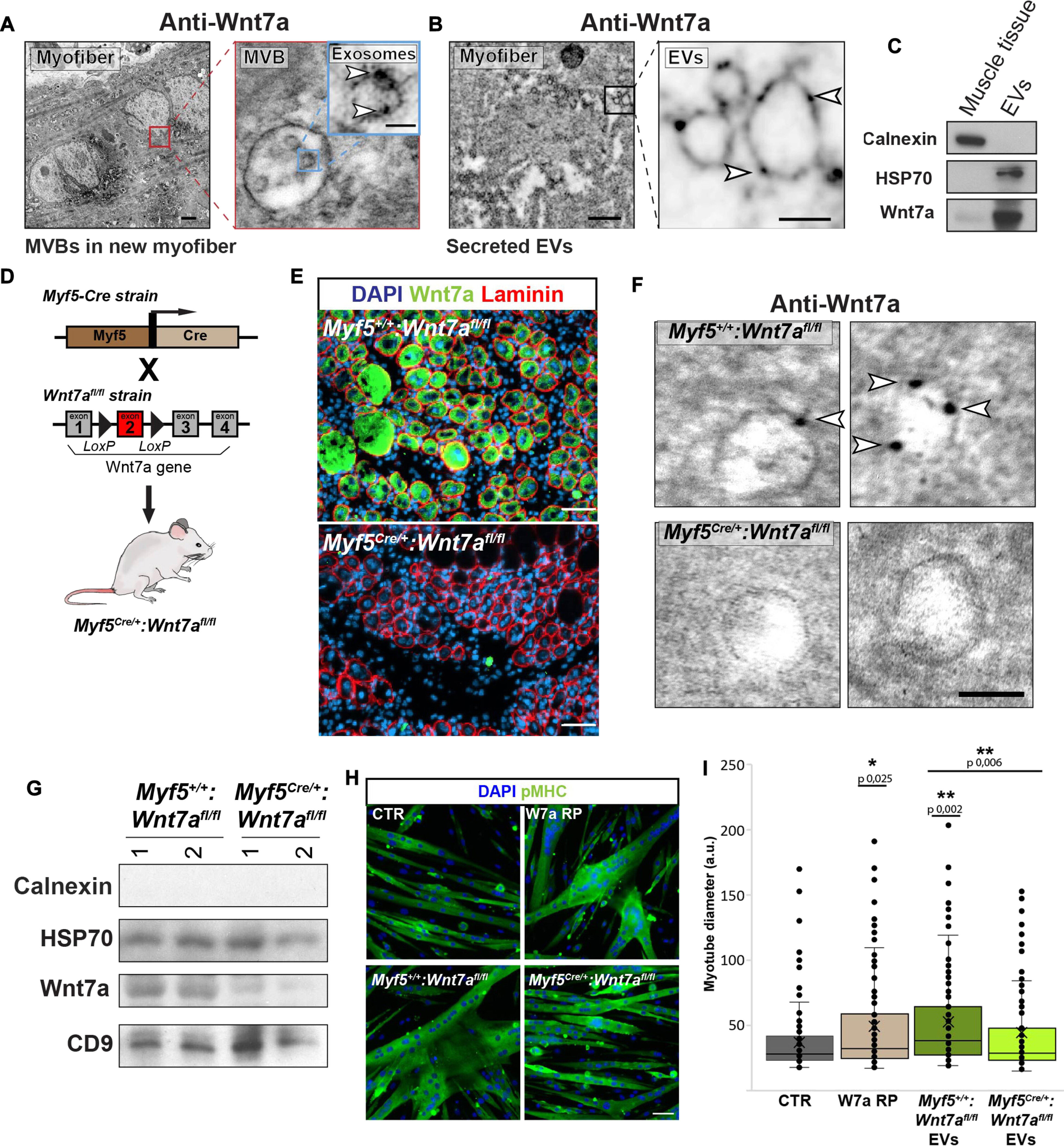
图1肌肉损伤会触发EVs表面Wnt7a的分泌。
图1A:野生型(WT)小鼠心脏毒素 (CTX)损伤后96小时,新再生肌纤维的抗Wnt7a标记的免疫金电子透射显微镜 (iTEM)显示多泡体(MVBs)中包含的腔内囊泡上有Wnt7a分泌。
图1B:纯化野生型(WT)小鼠受损胫骨前肌(TA)肌肉的抗Wnt7a标记的iTEM显示,浸润在新再生肌纤维周围受损组织的EVs上存在Wnt7a。
图1C:对来自肌肉的EVs部分进行免疫印迹分析,显示Wnt7a表达。
图1D:用于在表达Myf5的细胞中产生条件Wnt7a floxed的小鼠品系的示意图。
图1E:Myf5 (Cre/+)中 Wnt7a 表达消除的免疫荧光证实: CTX 损伤后 96 小时, Wnt7a (fl/fl)损伤 TA。
图1F:EV 的抗 Wnt7a 标记的 iTEM,显示来自Myf5 (Cre/+) : Wnt7a (fl/fl)小鼠肌肉外植体的 EV 中 Wnt7a 表达的消除。比例尺,100 nm。
图1G:从 Myf5 (Cre/+)分离的EVs中Wnt7a表达废除的免疫印迹验证:CTX损伤后96小时的Wnt7a (fl/fl)后肢肌肉。
图1H:含有Wnt7a的肌肉EVs刺激后肥大肌管的泛肌球蛋白重链免疫荧光代表性图像。
图1I :用来自肌肉的EV处理的小鼠原代肌管的肥大测定减少了Wnt7a缺失后的肥大。
这些数据表明,肌肉损伤后分泌在EVs上的Wnt7a在体内的再生肌肉反应中有积极的作用。
2. EVs上的Wnt7a分泌受内部序列调节
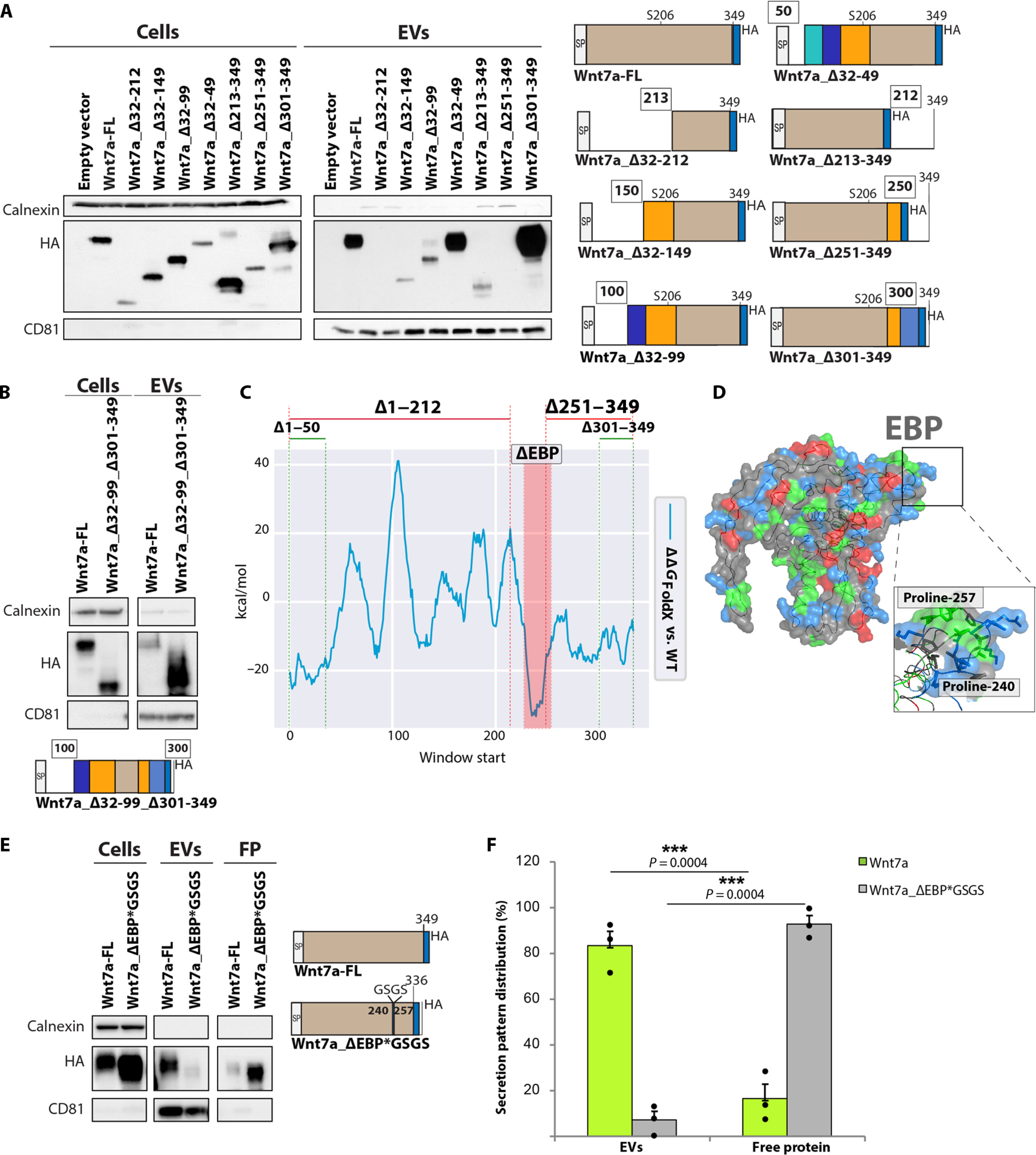
图2 EVs上的Wnt7a分泌受到内部肽序列的调节。
图2A:免疫印迹分析显示,在位置100氨基酸删除后,EVs分泌中断,但在位置300之后则不会。
图2B:免疫印迹分析显示,Wnt7a的内部100至300个氨基酸序列足以进行EVs分泌。
图2C:Wnt7a的Δ G FoldX表明Δ1-49和Δ301-349不影响折叠并且功能不会丢失。Δ1–212 影响蛋白质折叠。Δ251-349不影响折叠,但功能会丢失,因为EBP的一个区域被截断。
图2D:Wnt7a的表面,带负电的残基为红色,带正电的残基为蓝色,疏水性残基为绿色; 外泌体结合肽(EBP)带正电。
图2E:免疫印迹分析表明,用连接结构域GSGS连接子替换EBP会消除EVs分泌,有利于非EVs Wnt7a 分泌。
图2F:在有和没有EBP的情况下对EVs和非EVs蛋白片段上的Wnt7a表达进行定量。
综上结果表明EVs上的Wnt7a分泌受内部序列调节。
3. EBP足以为EVs提供靶向性
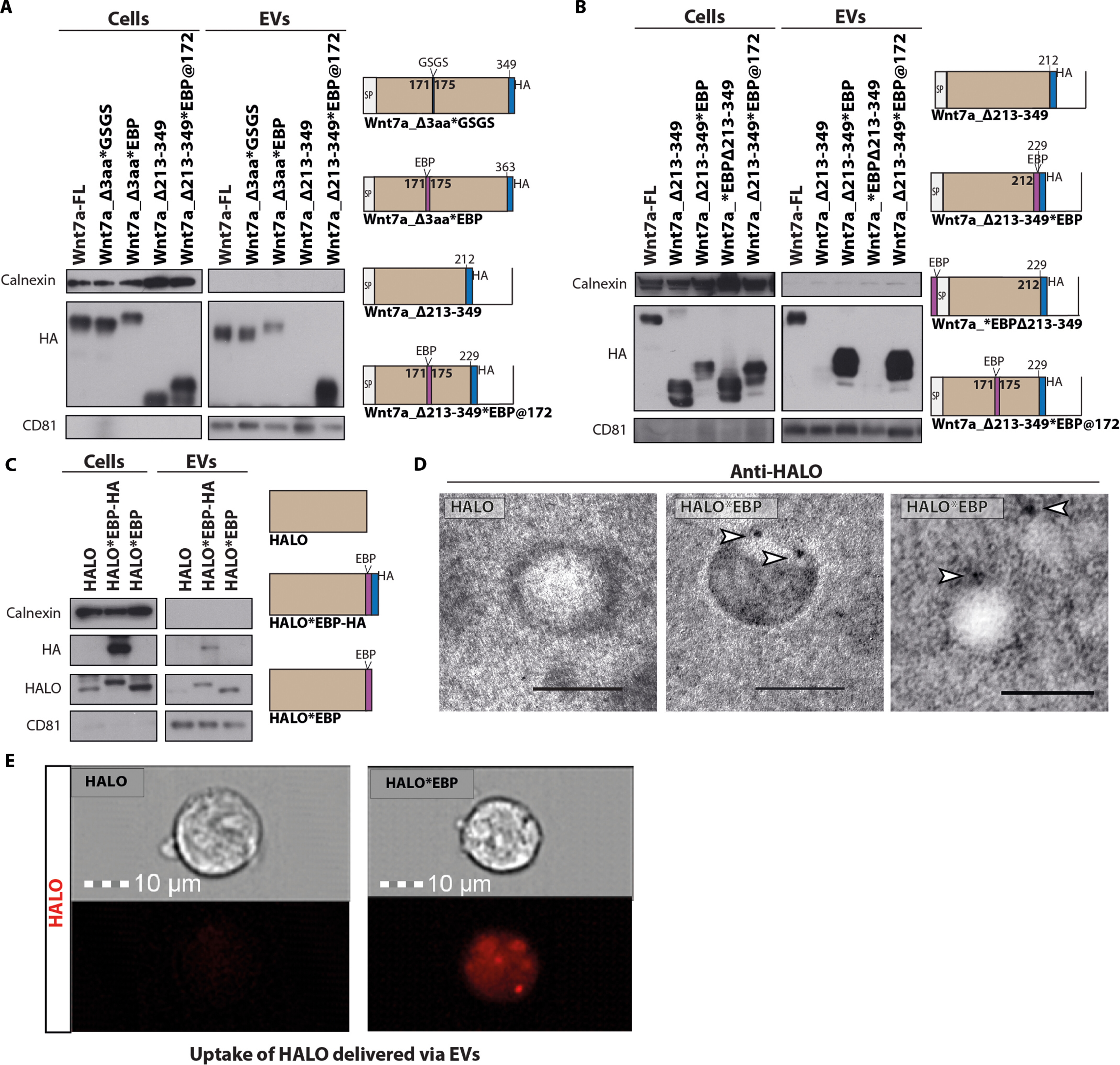
图3 EBP足以为EVs提供靶向性
图3A:通过将EBP插入EVs上不分泌的 Wnt7a截短片段的上游结构域来恢复EVs分泌。图3B:C端连接的EBP但N端连接的EBP将 Wnt7a-Δ213-249 靶向至EVs。
图3C:EBP HALO荧光标记蛋白的连接导致EVs分泌。
图3D:EVs的iTEM图像,具有抗HALO免疫染色,显示EVs表面上HALO*EBP的表达。
图3E:用HALO*EBP EVs处理后,与源自用不同Wnt7a-HA和HALO标记截短体转染的 HEK293T细胞衍生的HALO EVs处理后,通过HEK293T细胞内的荧光检测HALO。
以上结果表明EBP足以介导蛋白质靶向到EVs,然后递送到受体细胞。
4. Wnt7a-EVs的分泌不需要SP或棕榈酰化,Wnt7a结合外膜蛋白
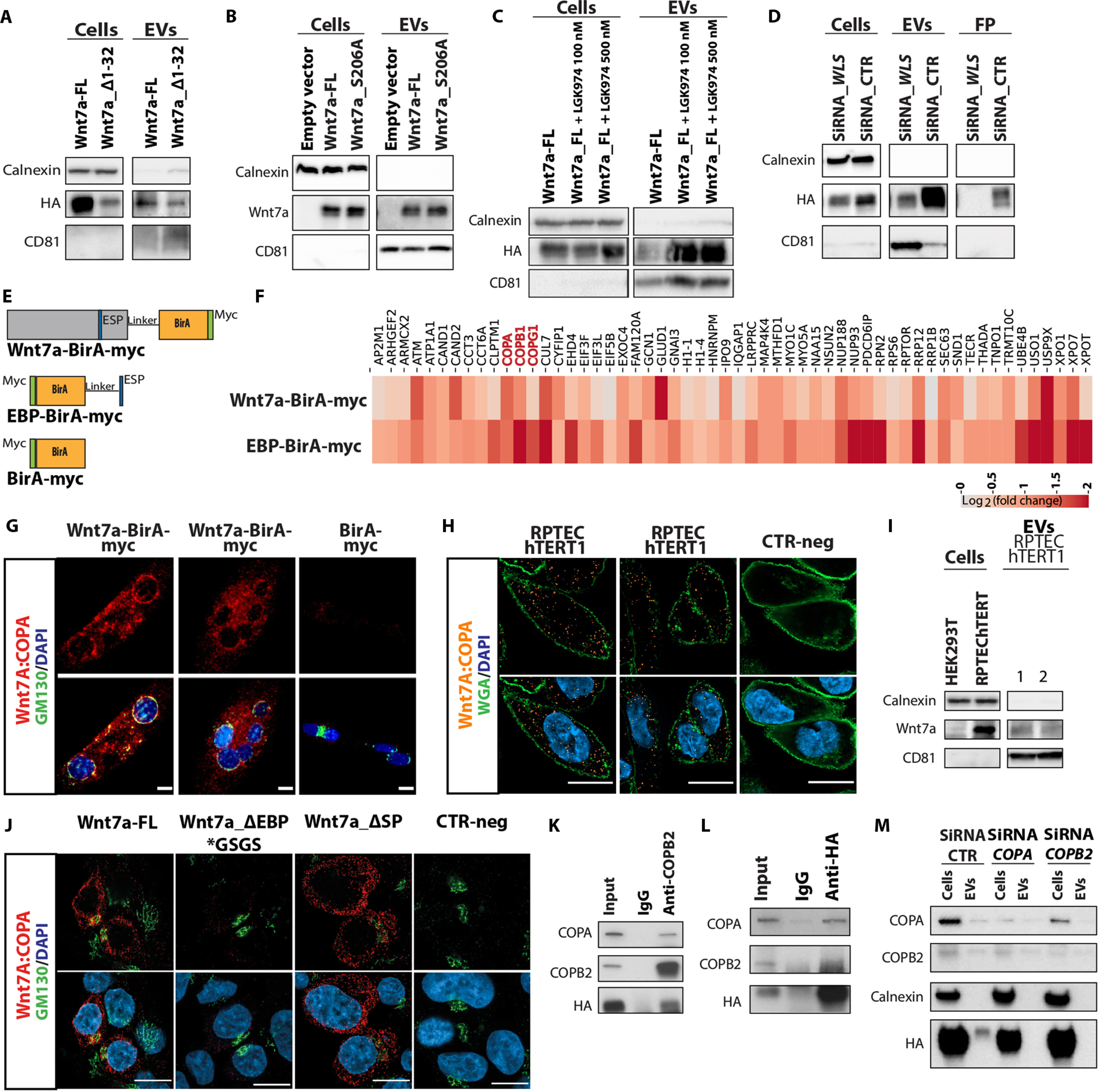
图4 Wnt7a在EVs上的分泌不依赖于经典途径,需要EBP的EVs结合蛋白(Coatomer)。
图4A:转染的人胚胎肾 HEK293T细胞中的EVs-Wnt7a分泌不需要N末端信号肽SP。
图4B:缺乏棕榈酰化位点的突变体Wnt7a_S206A在转染的HEK293T细胞的EVs上分泌。 图4C:化学抑制剂PORCN的药物抑制不影响EVs上Wnt7a的分泌。
图4D:siRNA 中WLS的敲低部分影响EVs上Wnt7a的分泌,但消除了非EVs Wnt7a 的分泌。
图4E:用于BioID分析的生物素连接酶BirA构建体。
图4F:热图显示质谱中富集蛋白质的倍数变化。
图4G:Wnt7a:COPA PLA(红色)在表达Wnt7a-BirA或BirA的小鼠原代肌管中进行。
图4H:Wnt7a:COPA PLA(橙色)在RPTEC-hTERT1细胞中进行。
图4I:Wnt7a分泌于源自RPTEC-hTERT1细胞的EVs上。
图4J:Wnt7a:COPA PLA(红色)在表达Wnt7a-FL、Wnt7a_ΔEBP*GSGS或Wnt7a_ΔSP的 HEK293T细胞中进行。
图4K-L:Wnt7a -血凝素(HA)与COPA和COPB2相互作用,用COPB2抗体免疫沉淀过表达Wnt7a-HA的HEK293T细胞或用HA抗体免疫沉淀。
图4M:siRNA敲低COPA和COPB2后Wnt7a的免疫印迹EVs分泌分析显示转染的 HEK293T细胞中Wnt7a-EVs分泌受到破坏。
综上,图4A-D的结果表明Wnt7a-EVs的分泌不需要SP或棕榈酰化;Wnt7a通过与外膜蛋白相互作用而被转运到EVs的另一种分泌机制(图4E-M)。
5. KxK基序介导外泌体结合肽(EBP)与外涂剂的结合
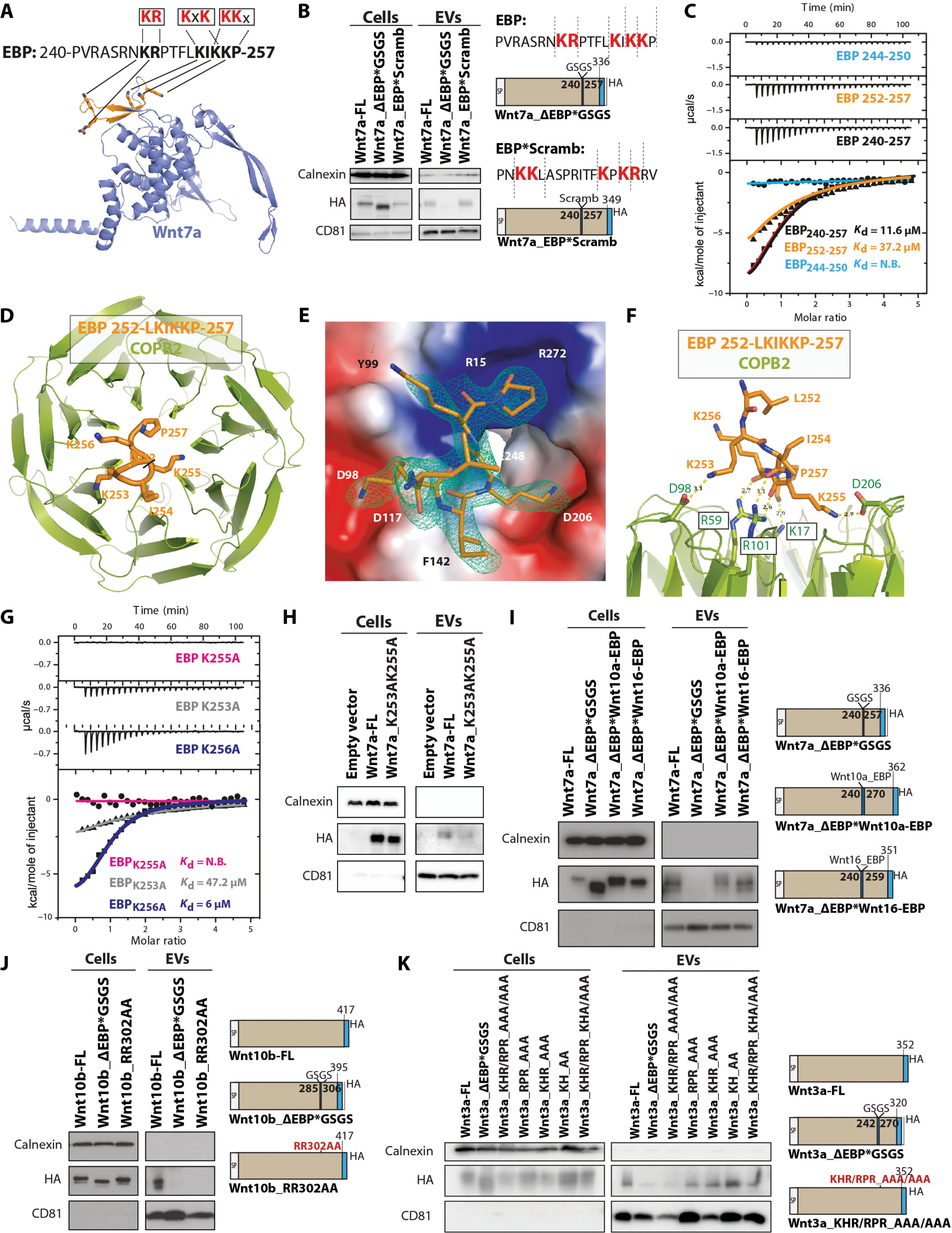
图5 Wnt7a结合Coatomer蛋白。
图5A:AlphaFold中预测的Wnt7a 结构(蓝色),其中EBP区域以橙色突出显示,以及EBP 内的三个带正电荷的基序(红色)。
图5B:Wnt7a-ESP*Scramble突变体保留了二赖氨酸基序并且对EVs分泌没有表现出损害。 图5C:等温滴定量热法(ITC)测量COPB2 1-304与EBP内潜在的二赖氨酸/精氨酸基序的结合。WT COPB2 1-304与LKIKKP亚区结合。
图5D:COPB 1-304 WD重复结构域的顶视图(绿色)与带状表示中的LKIKKP肽(橙色)。 图5E:LKIKKP肽的特写视图,具有通过省略肽计算的差异电子密度图,并在3σ处绘制轮廓(蓝色网格)。
图5F:具有氢键和距离的结合基序的侧视图。
图5G:基于结构的点突变证实ITC检测中KxKx基序的分子识别。
图5H:丙氨酸对K253和K255的双赖氨酸突变破坏了Wnt7a-EVs的分泌。
图5I:用包含KR和RR基序的Wnt10a-EBP或Wnt16 EBP替换Wnt7a-EBP(右)。用 Wnt10a-EBP或Wnt16 EBP替换可以挽救Wnt7a-EVs的分泌。
图5J:EBP去除或EBP内双精氨酸突变后Wnt10b的EVs分泌分析(右)。双精氨酸突变会破坏EVs上Wnt10b的分泌,其程度与去除整个Wnt10b EBP序列相同。
图5K:EBP去除或EBP内整个带正电基序RPR、KHR和KH突变后Wnt3a的分泌分析(右)。只有RPR和KHR基序的同时突变才会破坏EVs上Wnt3a的分泌,其程度与去除整个Wnt3a EBP序列相同。
这些结果表明,外膜蛋白通过EBP结构域内的正电荷基序与Wnt家族成员直接结合。
6. Wnt7a与Coatomer的相互作用是肌肉再生反应所必需的
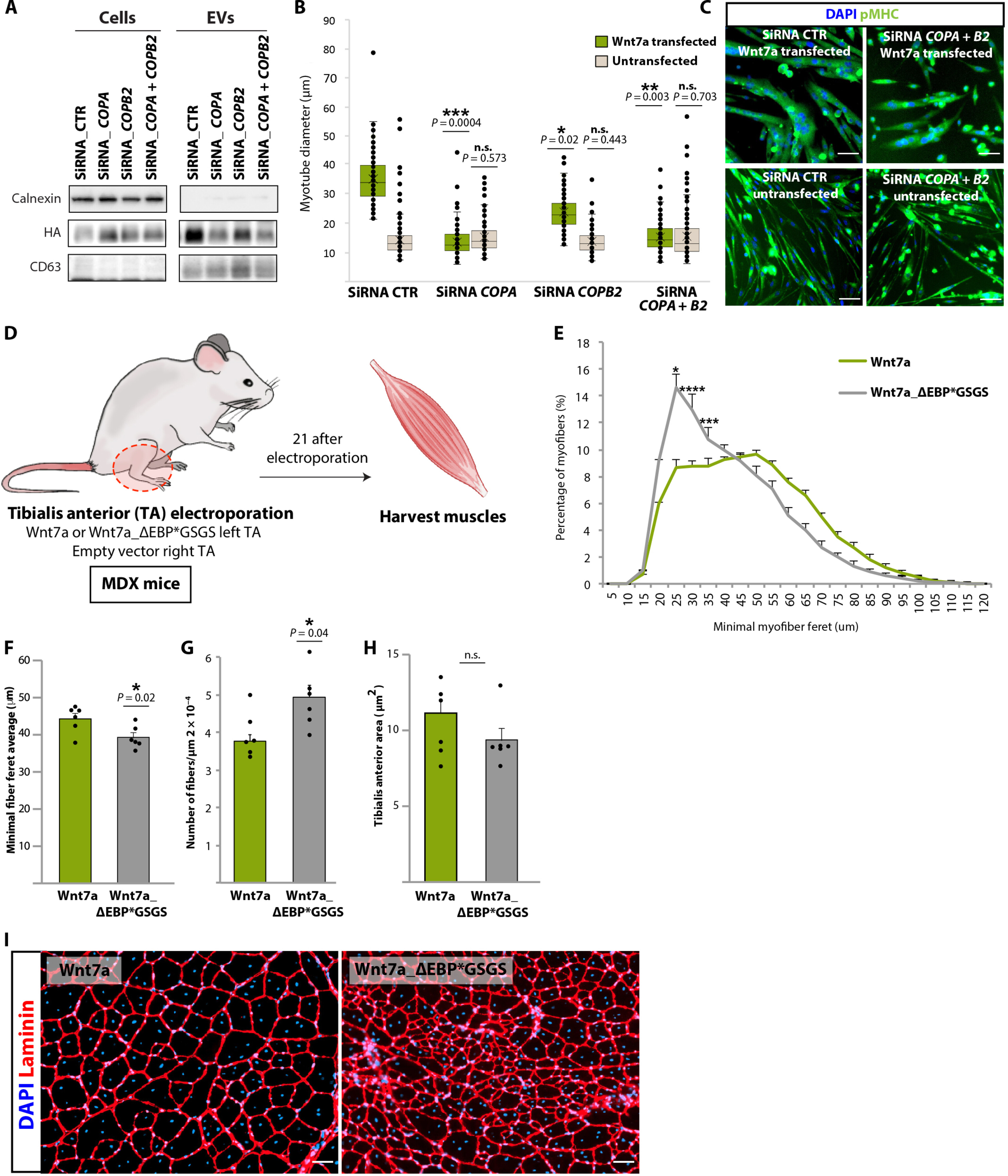
图6 Wnt7a与Coatomer的相互作用是肌肉再生反应所必需的。
图6A:使用siRNA敲低COPA和COPB2会破坏稳定表达Wnt7a的原代成肌细胞中的 Wnt7a-EVs分泌。
图6B:COPA和COPB2的敲低减少了Wnt7a转染的肌管的肥大。相反,敲低并不影响不表达Wnt7a的肌管的肥大。
图6C:肌管中COPA和COPB2同时siRNA敲低后的代表性图像。
图6D:体内工作流程的示意图。
图6E:比较用Wnt7a(绿色)与Wnt7a_ΔEBP*GSGS(灰色)电穿孔的TA的肌纤维口径分布。
图6F:比较用Wnt7a(绿色)与Wnt7a_ΔEBP*GSGS(灰色)电穿孔的TA的平均最小纤维细度。
图6G:比较用Wnt7a(绿色)与Wnt7a_ΔEBP*GSGS(灰色)电穿孔的TA的纤维数量量化。
图6H:比较用Wnt7a(绿色)与Wnt7a_ΔEBP*GSGS(灰色)电穿孔的TA的肌肉面积定量。
图6I:TA肌肉切片显示,将Wnt7a_ΔEBP*GSGS电穿孔至MDX的TA肌肉后,肌纤维口径减小,肌纤维数量增加。
这些数据表明Wnt7a在肌肉再生过程中的分泌是体内Wnt7a生物活性所必需的。
结论
该研究发现Coatomer成分在EVs急性损伤时分泌Wnt的额外作用。研究已经阐明了Wnt7a与Coatomer结合并在EVs外表面分泌的结构基础。该已经确定了Wnt-Coatomer相互作用的序列要求,并表明EVs分泌多种Wnt的机制类似。此外,研究实验表明,在肌肉再生过程中,体内Wnt7a的生理分泌是由EVs介导的,这阐明了Wnt在体内长距离信号传递的能力。
本研究实验表明,装载在EVs上的Wnt7a全身递送代表了治疗神经肌肉疾病的潜在疗法。利用EBP来指导货物蛋白在EVs表面的呈现,为多种治疗应用打开了大门。该研究的结果将成为更复杂的递送系统的起点,能够为理解病理背景下的Wnt分泌提供重要的见解。






