研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
钙化大师脆弱拟杆菌细胞外囊泡的究极奥秘,14+的惊艳之作!
251 人阅读发布时间:2025-01-17 11:48
2型糖尿病(T2D)的血管钙化(VC)严重威胁患者的生命和健康。然而,其发病机制尚不清楚,导致缺乏对根本原因的有效治疗。发现T2D VC患者肠道脆弱拟杆菌(Bacteroides fragilis, BF)和外周血M2单核/巨噬细胞均显著升高。
M2巨噬细胞被认为是T2D VC的重要危险因素。BF及其胞外囊泡(EV)均能促进T2D VC,促进巨噬细胞M2极化。巨噬细胞清除可显著拮抗BF EV诱导的小鼠T2D VC。机制上,富含EV的双链DNA (dsDNA)激活干扰素反应刺激因子cGAMP相互作用因子1 (Sting),促进肌细胞增强因子2D (Mef2d)磷酸化,上调tribbles pseudokinase 1 (Trib1)表达,诱导巨噬细胞M2极化。同时,Mef2d被EV靶向激活,上调促钙化因子Serpine1的表达,从而加重T2D VC。临床研究表明,T2D VC患者外周血Serpine1明显升高,与T2D VC密切相关。

湾湾今天分享的是发表在《Advanced Science》(IF:14.3)上题为“Bacteroides Fragilis Exacerbates T2D Vascular Calcification by Secreting Extracellular Vesicles to Induce M2 Macrophages”本研究揭示肠道BF通过EV-Sting-Mef2d通路促进Trib1表达,诱导巨噬细胞M2极化,上调serpin家族E成员1 (Serpine1)表达,从而加重T2D VC。研究结果为优化T2D VC的防治策略提供了新的理论和实验依据。
研究结果
1.T2D VC相关肠道细菌及作用途径分析
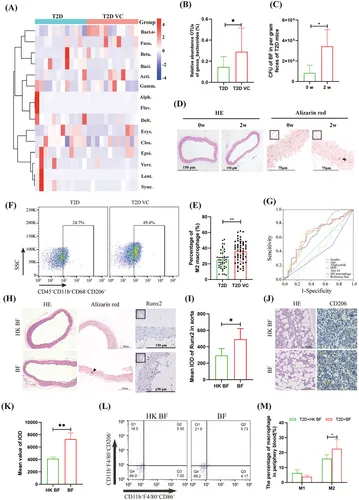
图1A:T2D和T2D VC患者肠道细菌丰度的16s rRNA测序分析。
图1B:T2D和T2D VC患者BF水平分析。
图1C:qRT-PCR分析T2D进展对肠道BF的影响。
图1D:病理分析T2D进展对主动脉钙化的影响。
图1E-F:流式细胞术分析T2D和T2D VC患者外周血M2单核/巨噬细胞表达变化及统计学分析。
图1G:T2D VC相关显著因素AUC的ROC分析。
图1H-I:病理和免疫组化分析BF移植对T2D小鼠主动脉的影响以及统计学分析。
图1J-K:病理和免疫组化分析BF移植对T2D小鼠骨髓细胞的影响及并统计学分析。
图1L-M:流式细胞术分析BF移植对外周血单核/巨噬细胞极化的影响及统计学分析。
这些结果表明BF是一种与T2D VC相关的肠道细菌,并与M2巨噬细胞水平有关。
2.分析BF EV对VC和巨噬细胞极化的影响
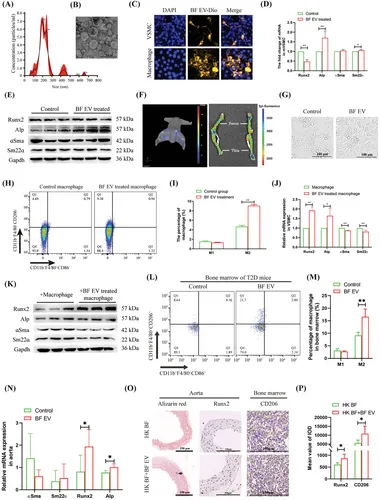
图2A:BF囊泡大小分布的NTA分析。
图2B:BF EV结构的扫描电镜分析。
图2C:巨噬细胞和VSMCs摄取BF EV的观察。
图2D:qRT-PCR分析BF EV对VSMC成骨标记基因的影响。
图2E:Western blotting分析BF EV对VSMC成骨标志物基因的影响。
图2F:小动物体内成像分析BF EV在体内的分布。
图2G:光镜下分析BF EV对巨噬细胞形态的影响。
图2H-I:流式细胞术分析BF EV对巨噬细胞极化的影响及统计学分析。
图2J:qRT-PCR分析BF EV活化巨噬细胞对VSMC成骨标记基因的影响。
图2K:Western blotting分析BF EV活化巨噬细胞对VSMC成骨标志基因影响。
图2L-M:流式细胞术分析BF EV对T2D小鼠骨髓巨噬细胞极化的影响及统计学分析。
图2N:qRT-PCR分析BF EV对T2D小鼠主动脉钙化的影响。
图2O-P:病理和免疫组化分析BF EV拮抗HKBF对T2D小鼠主动脉钙化和骨髓M2巨噬细胞的抑制作用及统计学分析。
这些结果表明BF通过EV诱导巨噬细胞M2极化,从而促进主动脉钙化。
3.分析巨噬细胞清除对BF - EV加重小鼠T2D VC的影响
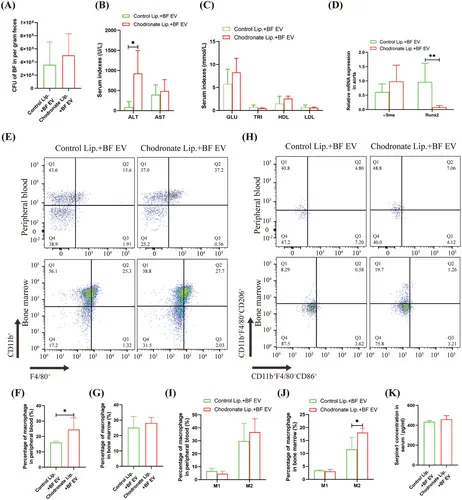
图3A:qRT-PCR检测粪便BF的表达。
图3B:血清肝功能指标检测。
图3C:血清血糖、血脂指标检测。
图3D:qRT-PCR检测主动脉成骨分化标志基因的表达。
图3E-G:外周血和骨髓巨噬细胞总量流式细胞术分析及统计学分析。
图3H-J:外周血和骨髓中M1/M2巨噬细胞的流式细胞术分析及统计学分析。
图3K:ELISA法检测血清中丝氨酸pine1的水平。
这些结果表明巨噬细胞是BF - EV促进T2D VC的关键靶细胞。
4.BF EV激活Sting-Mef2d信号,促进巨噬细胞M2极化
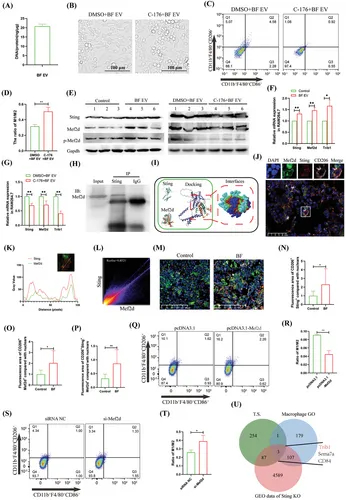
图4A:BF EV中DNA含量的检测。
图4B:光学显微镜观察,抑制Sting活性可拮抗BF EV诱导的巨噬细胞M2极化。
图4C-D:流式细胞术分析Sting活性拮抗BF EV诱导的巨噬细胞M2极化的抑制作用及统计学分析。
图4E:Western blotting分析BF EV和C-176 + BF EV处理对巨噬细胞基因表达的影响。
图4F:qRT-PCR分析BF EV对巨噬细胞基因表达的影响。
图4G:qRT-PCR分析C-176 + BF EV处理对巨噬细胞基因表达的影响。
图4H:Co-IP分析Sting与Mef2d相互作用。
图4I:Sting与Mef2d对接的生物信息学分析。
图4J-L:组织免疫荧光分析BF移植对T2D小鼠骨髓基因分布的影响, Sting与Mef2d共定位曲线及共定位散点图分析。
图4M-P:组织免疫荧光分析BF移植对T2D小鼠骨髓基因表达的影响,并对CD206+Sting+、CD206+Mef2d+、CD206+Sting+Mef2d+进行统计分析。
图4Q-R:流式细胞术分析Mef2d过表达对巨噬细胞极化的影响及统计学分析。
图4S-T:流式细胞术分析Mef2d抑制表达对巨噬细胞极化的影响及统计学分析。
图4U:Mef2d调控基因的转录组测序及生物信息学分析。
这些结果表明Sting是BF EV诱导巨噬细胞M2极化的关键基因,Mef2d是BF EV激活的重要下游功能基因。
5.Mef2d促进巨噬细胞M2极化和细胞因子分泌的机制分析
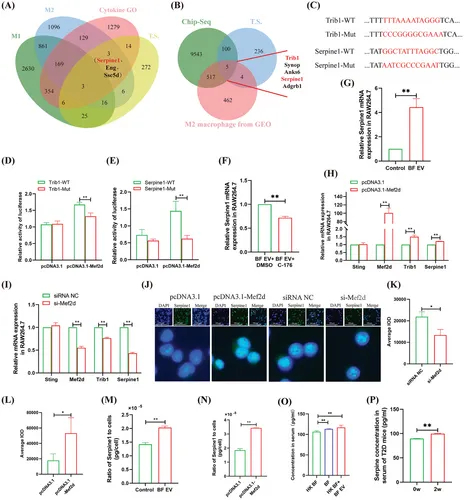
图5A:BF EV诱导M2巨噬细胞分泌细胞因子的维恩图分析。M1和M2是巨噬细胞极化诱导后GEO衍生的人单核细胞的转录组数据(GSE157182)。TS是处理RAW264.7细胞转录组测序数据的BF EV。
图5B:Venn图分析Mef2d调控的靶基因。Chip-Seq为Mef2d的测序数据。
图5C:Mef2d结合位点和突变位点在Trib1和Serpine1的非编码区。
图5D:双荧光素酶法分析Mef2d与Trib1非编码区的结合。
图5E:双荧光素酶试验分析Mef2d与Serpine1非编码区的结合。
图5F:qRT-PCR分析BF EV对巨噬细胞细胞因子表达的影响。
图5G:qRT-PCR分析C-176 + BF EV对巨噬细胞细胞因子表达的影响。
图5H:qRT-PCR分析Mef2d过表达对基因表达的影响。
图5I:qRT-PCR分析转染si-Mef2d对巨噬细胞基因表达的影响。
图5J-L:免疫荧光分析转染pcDNA3.1-Mef2d或si-Mef2d对巨噬细胞Serpine1表达的影响及统计学分析。
图5M-P:ELISA检测BF EV处理的巨噬细胞、pcDNA3.1-Mef2d转染的巨噬细胞培养上清、BF/BF EV移植的T2D小鼠、疾病进展期间T2D小鼠血清中Serpine1的水平。
这些结果表明Serpine1是Mef2d促进M2巨噬细胞分泌的关键蛋白。
6.分析Serpine1对T2D小鼠VC的影响
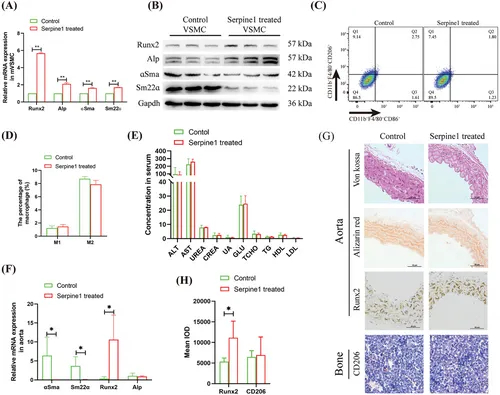
图6A:qRT-PCR分析Serpine1对VSMC成骨分化标志基因表达的影响。
图6B:Western blotting分析Serpine1对VSMC成骨分化标志基因表达的影响。
图6C-D:流式细胞术分析Serpine1对巨噬细胞极化的影响及统计学分析。
图6E:生化检测Serpine1输注对T2D小鼠肝肾功能的影响。
图6F:qRT-PCR分析Serpine1输注对T2D小鼠主动脉成骨分化相关基因表达的影响。
图6G-H:病理和免疫组化分析Serpine1输注对T2D小鼠主动脉Runx2和骨髓CD206+细胞的影响及统计学分析。
这些结果表明Serpine1促进T2D小鼠血管成骨分化。
7.血清Serpine1与T2D VC关系的临床水平分析
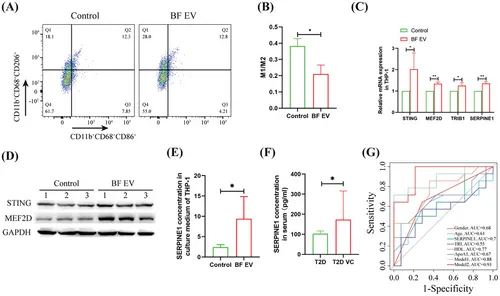
图7A-B:流式细胞术分析BF EV对THP -1源性巨噬细胞极化的影响及统计学分析。
图7C:qRT-PCR分析BF EV对THP -1源性巨噬细胞基因表达的影响。
图7D:Western blotting分析BF EV对THP -1源性巨噬细胞基因表达的影响。
图7E:ELISA分析BF EV对THP -1源性巨噬细胞Serpine1分泌的影响。
图7F:T2D VC患者血清Serpine1的ELISA分析。
图7G:Logistic回归分析Serpine1与T2D VC的相关性。
这些结果表明巨噬细胞M2极化和Serpine1分泌是T2D VC的重要危险因素。
结论
综上所述,该研究表明,T2D相关肠道BF分泌的EVs促进巨噬细胞M2极化并释放Serpine1,进而促进VC。临床研究进一步证实外周血M2单核细胞/巨噬细胞和外周血Serpine1是T2D相关VC的两个重要危险因素。本研究为优化T2D患者VC的防治策略提供了新的理论和实验基础。






