研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
14+神篇来袭!单细胞代谢分析+外泌体+糖酵解,发文易如反掌,速度上车!!
843 人阅读发布时间:2025-01-22 16:31
急性髓系白血病 (AML) 是一种克隆性疾病,源自罕见的骨髓 (BM) 来源的白血病干细胞 (LSC)。由于细胞内在的化疗耐药机制,使得AML成为一种具有高复发率的侵袭性疾病,细胞代谢和代谢适应的变化是包括AML在内的许多癌症的标志特征,可以作为潜在的治疗靶点。因此,揭示代谢脆弱性和可用于临床的生物标志物对于AML的治疗极为重要。

湾湾今天分享的是一篇发表在【Nature Communications】(IF:14.7)上题为“Parallel single-cell metabolic analysis and extracellular vesicle profiling reveal vulnerabilities with prognostic significance in acute myeloid leukemia”的研究,该研究开发了一种策略,用于在外周血 (PB)中直接并行探索急性髓系白血病 (AML)细胞的代谢景观和外泌体(EV)的特征,并使用循环EV进行功能研究,以证明它们有能力调节白血病干细胞 (LSC)的代谢重编程。
研究成果
1.循环CD34+CD38low/-干/祖细胞AML细胞表现出独特的代谢特征,抗氧化分子GSH和线粒体电位(MITO)水平升高
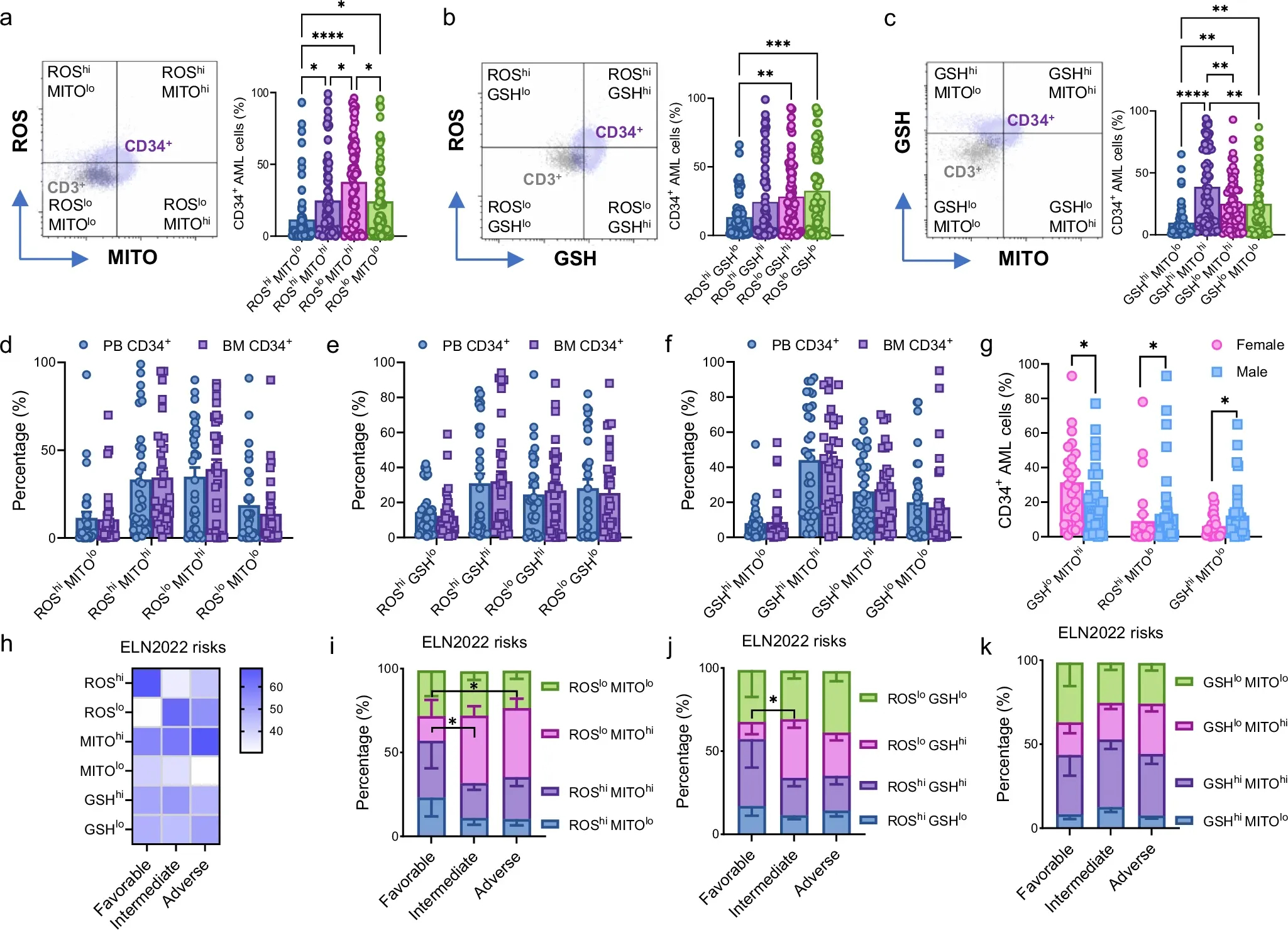
图1a-c:左侧,代表点图说明了基于CD3+细胞的CD34+细胞的门控策略。右侧为初诊时AML患者血液中ROS/MITO、ROS/GSH、GSH/MITO染色的CD34+细胞百分比。
图1d-f:根据ROS/MITO (d)、ROS/GSH (e)和GSH/MITO (f)组合,从配对的PB和BM全血中分析AML CD34+细胞的图表。
图1g:报告以下CD34+细胞部分的性别差异:GSHlo MITOhi, ROShi MITOlo, GSHhi MITOlo考虑女性AML患者与男性AML患者。
图1h:热图报告CD34+细胞中ROS、MITO和GSH的平均百分比差异,考虑到每个标志物在根据欧洲白血病网 (ELN)风险分层的AML患者中的高表达和低表达。
图1i-k:同一AML患者中根据ROS/MITO, ROS/GSH和GSH/MITO的ELN风险分层的AML CD34+细胞的代谢特征。
结果表明,AML患者的CD34+细胞比例显著增加,平衡活性氧 (ROS)水平降低,抗氧化分子GSH和线粒体电位MITO水平升高。AML患者的白血病造血室显示出向较低活性氧(ROS)水平和较高线粒体电位和GSH水平的转变,表明疾病更具侵袭性,数据还表明代谢标志物的组合可能有助于AML患者的风险分层和临床预测。
2. 使用SCENITH方法对循环CD34 + AML细胞进行代谢分析,揭示了具有预后意义的高葡萄糖依赖性和糖酵解能力
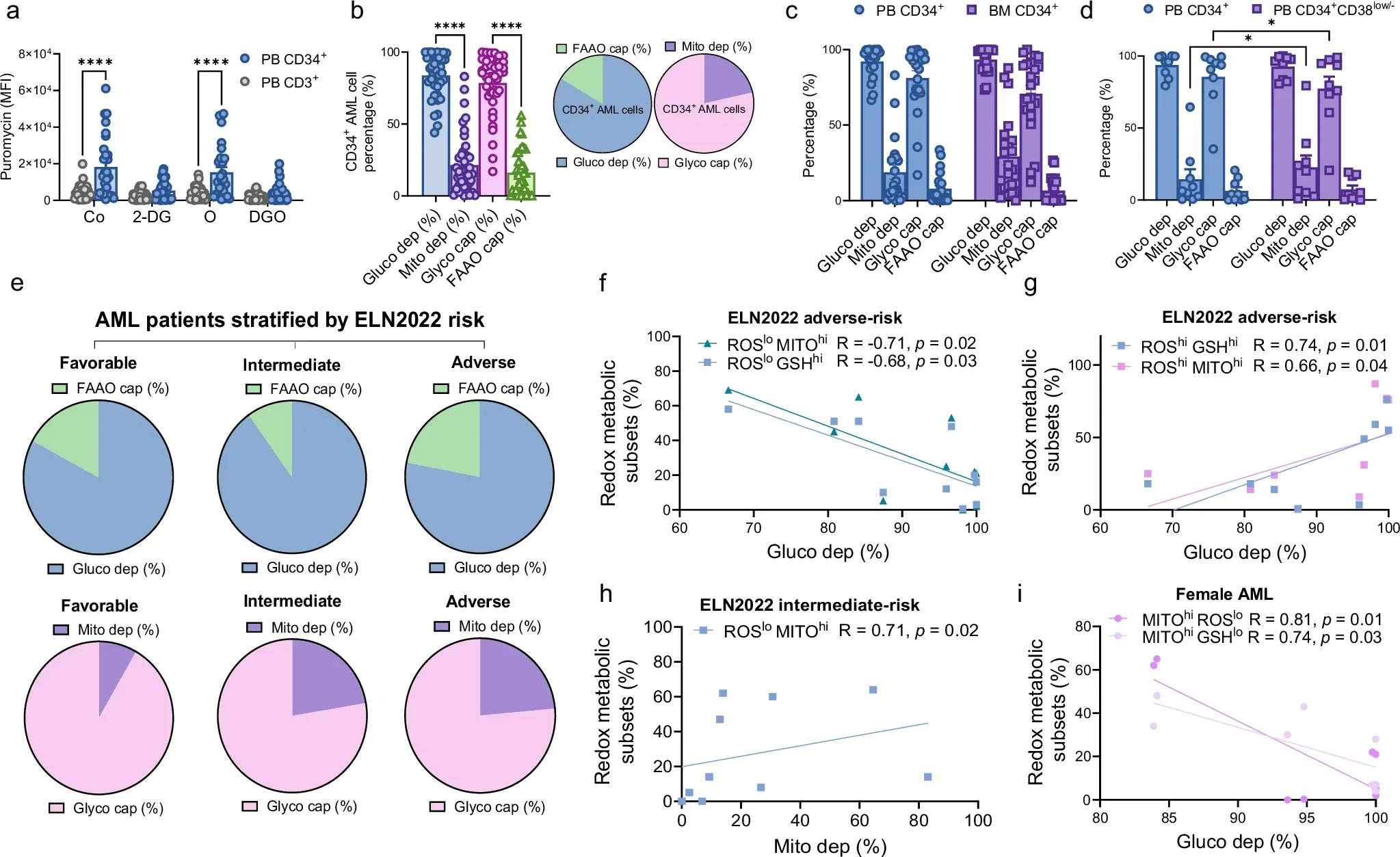
图2a:比较每例患者配对的AML CD34+和CD3+细胞,用Co, 2-脱氧-d -葡萄糖(2DG),寡霉素A (O)或两者(DGO)抑制代谢通路后,嘌呤霉素值表达的翻译水平。
图2b:AML CD34+细胞的代谢轮廓以百分比表示,对应的饼状图代表测量的2 × 2依赖参数,即脂肪酸和AA氧化能力的葡萄糖依赖和糖酵解能力的线粒体依赖。
图2c:根据来源的代谢参数,比较配对的AML PB CD34+细胞和BM CD34+细胞。
图2d:AML患者外周血CD34+和配对外周血CD34+CD38low/-之间代谢参数的差异。
图2e:根据ELN风险分层的代表AML患者代谢轮廓的饼状图。
图2f:通过SCENITH测定的AML CD34+细胞中的葡萄糖依赖性(%)与来自不良风险AML患者的ROSlo MITOhi或ROSlo GSHhi CD34+细胞的百分比呈负相关。
图2g:AML CD34+细胞的葡萄糖依赖(%)与来自不良风险AML患者的ROShi GSHhi和ROShi MITOhi CD34+细胞呈正相关。
图2h:中危AML患者ROSlo MITOhi CD34+细胞与CD34+细胞的线粒体依赖性(%)呈正相关。
图2i:在女性AML患者中MITOhi ROSlo CD34+细胞和MITOhi GSHlo之间的负相关。
以上这些数据证实了新鲜全血实时代谢研究的临床相关性。尽管诊断时AML总CD34 +细胞对葡萄糖高度依赖且优先偏向糖酵解,但更不成熟的白血病部分显示出显著的线粒体依赖性,这似乎与AML风险分层相关。
3. 对诊断时AML患者循环中细胞外信号的分析显示,EV AML的体积、蛋白质含量增加,并且存在谷胱甘肽过氧化物酶3 (GPX3)
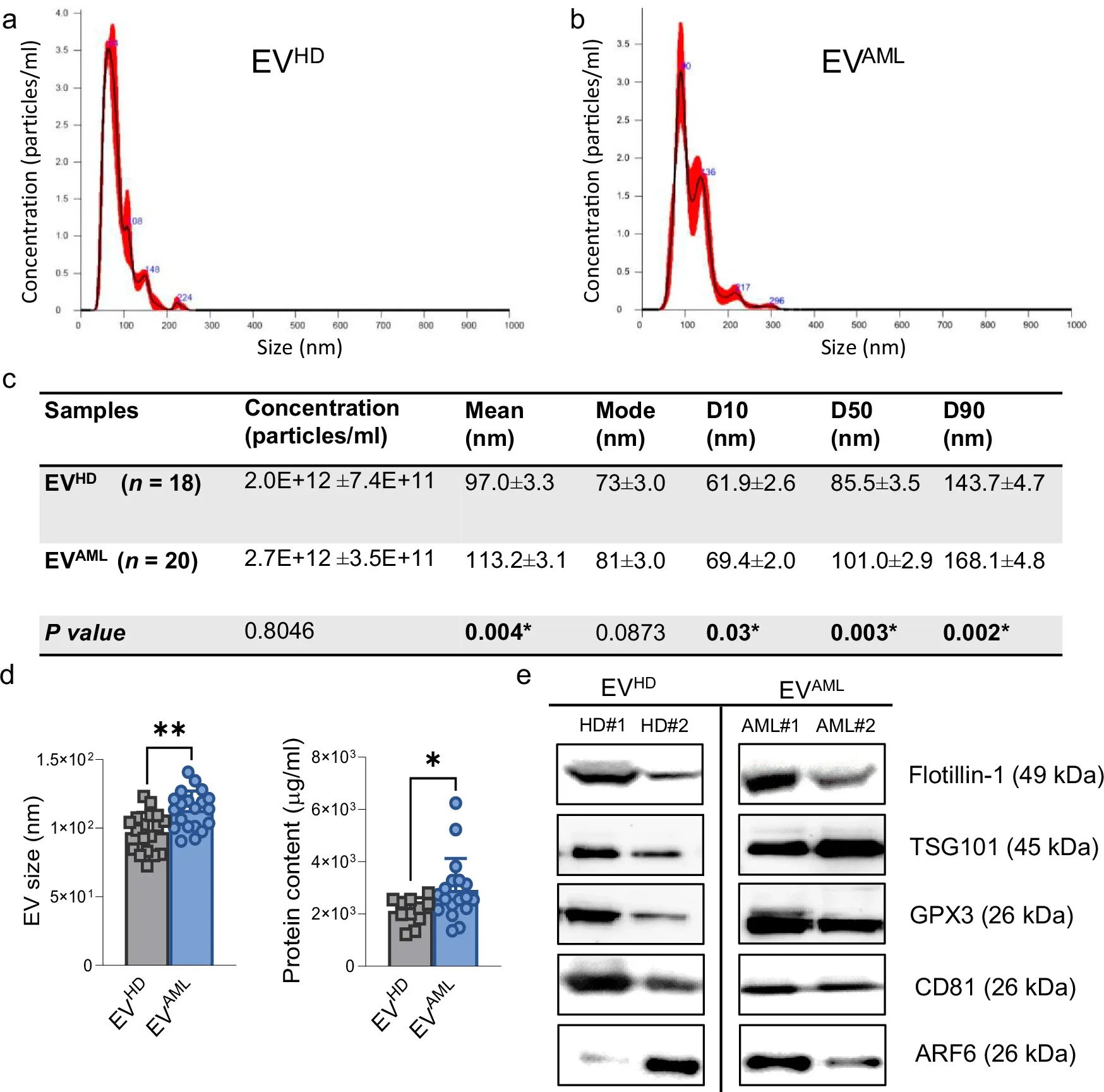
图3a-b:通过纳米颗粒跟踪分析 (NTA)测量的EV HD和EV AML的血浆来源EV分布的代表性直方图。
图3c:每组NTA数据的汇总表报告。
图3d:通过NTA测量的血浆来源的EV大小和使用Bradford测定法测量AML患者的EV 蛋白含量和HD。
图3e:每组两个个体中特定EV标记物(Flotillin-1、TSG101、CD81、ARF6)和抗氧化剂 GPX3的代表性蛋白质印迹分析。
数据结果中分离的EVAML显示出典型的EV特征和抗氧化剂GPX3的负载,促使作者进一步研究基于EV的AML液体活检及其潜在的代谢作用。
4. 新诊断的AML患者的循环EV主要富含CD44,多重蛋白分析揭示潜在的预后价值
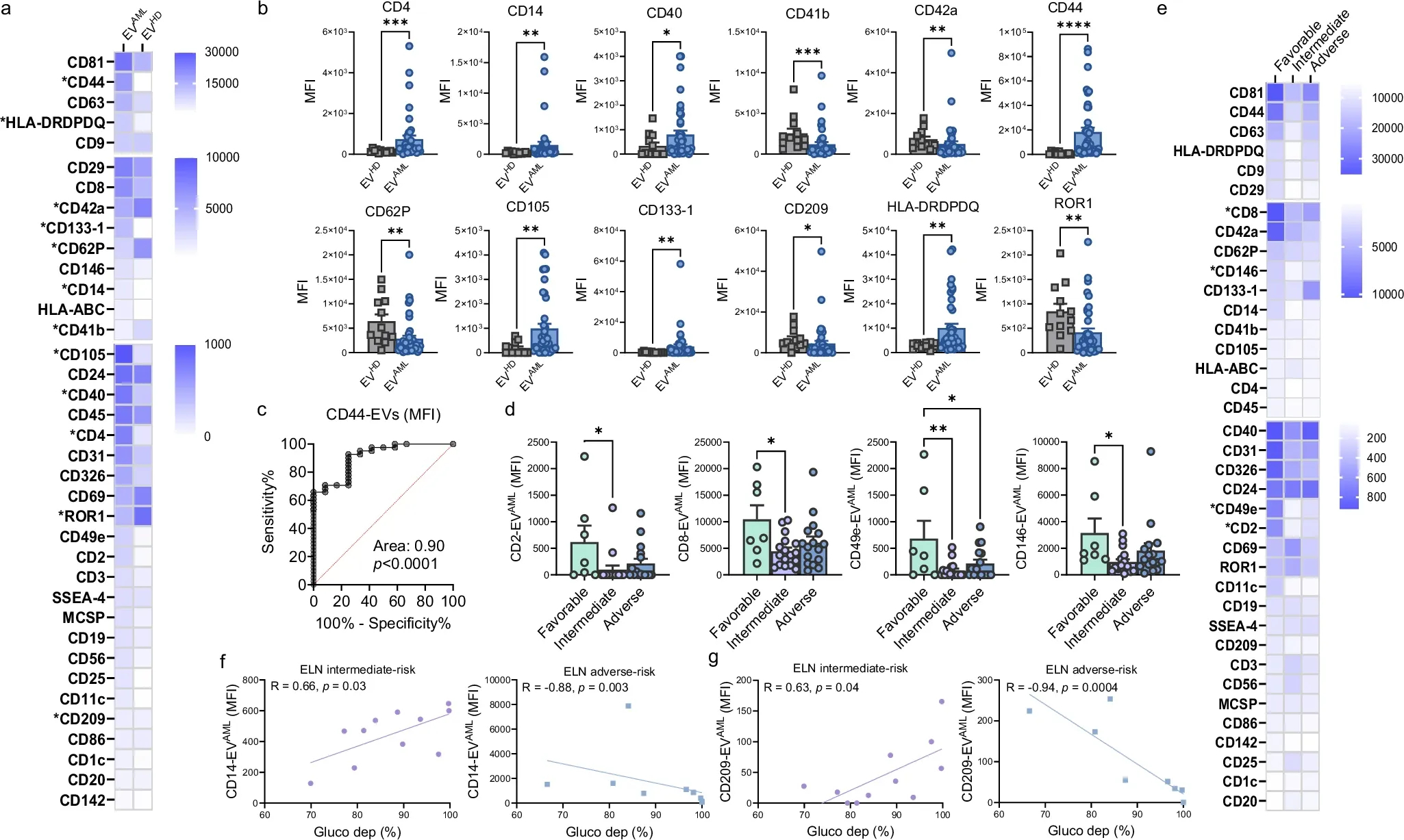
图4a:EV HD 和EV AML上表达的37个EV表面标记物的表达热图。
图4b:与EV HD和EV AML相比,表面标记物的背景校正中值APC荧光强度显著不同。
图4c:用于区分 AML 患者与 HD 受试者的EV CD44表达的ROC曲线下面积 。
图4d:低危AML患者与中危或高危患者相比,表面标志物(CD2,CD8,CD49e,CD146)的背景校正的中位别藻蓝蛋白(APC)荧光强度有显著差异。
图4e:根据ELN风险分层进行分层的患者EV AML上表达的37种EV表面标志物的表达热图。
图4f:中等风险患者或不良风险患者的EV AML CD14 MFI之间的Spearman 相关性报告了使用SCENITH测量的AML CD34 +细胞的葡萄糖依赖性 (%) 。
图4g:中等风险患者或不良风险患者的EV AML CD209 MFI 与葡萄糖依赖之间的Spearman 相关性(%) 报告了AML CD34 +细胞。
结果表明EVAML的表型具有异常特征,与 EV HD 相比,EV AML的癌症干细胞标记物CD44高度富集。此外,EV标记的表达与细胞代谢密切相关,而去除EV上特定标记可界定中危和不良风险患者,因此证实具有潜在预后功效的EV特征。
5. 在 EV AML中检测到独特的脂质组学特征,并突出显示AML分层的假定生物标志物
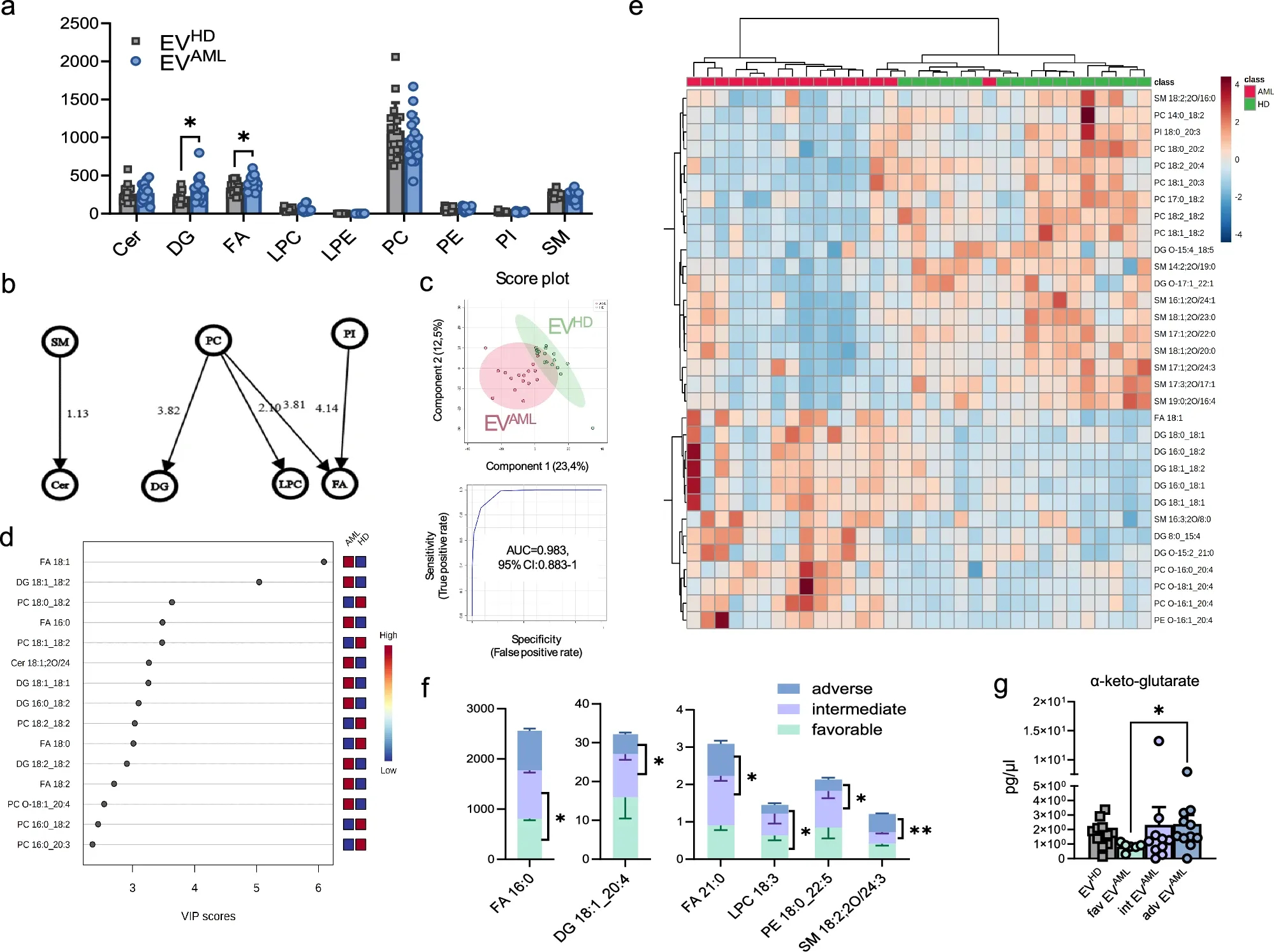
图5a:在EV AML和EV HD 中检测到的九种脂质类别的图表。
图5b:脂质类别之间的转换网络。
图5c:对EV AML与EV HD中差异表达的脂质种类进行偏最小二乘判别分析(PLS-DA) ,并对AML患者和HD之间的EV脂质组数据集进行多变量ROC分析。
图5d:EV AML和EV HD中脂质种类的PLS-DA 投影(VIP)分数的可变重要性。右侧的彩色框表示相应脂质种类的相对浓度。
图5e:脂质种类的相应热图。
图5f:选定的脂质种类水平在EV中差异表达。
图5g:EV AML与EV HD 的目标代谢组学数据。
循环EV的脂质组学分析识别了AML患者EV的基于脂质的异常特征,并表明EV脂质组的改变与诊断时的风险分层相关。
6. 不同AML风险的EV AML对OCI-AML3和MOLM-13有不同的代谢影响,不良风险EV AML增强MOLM-13在体内的植入
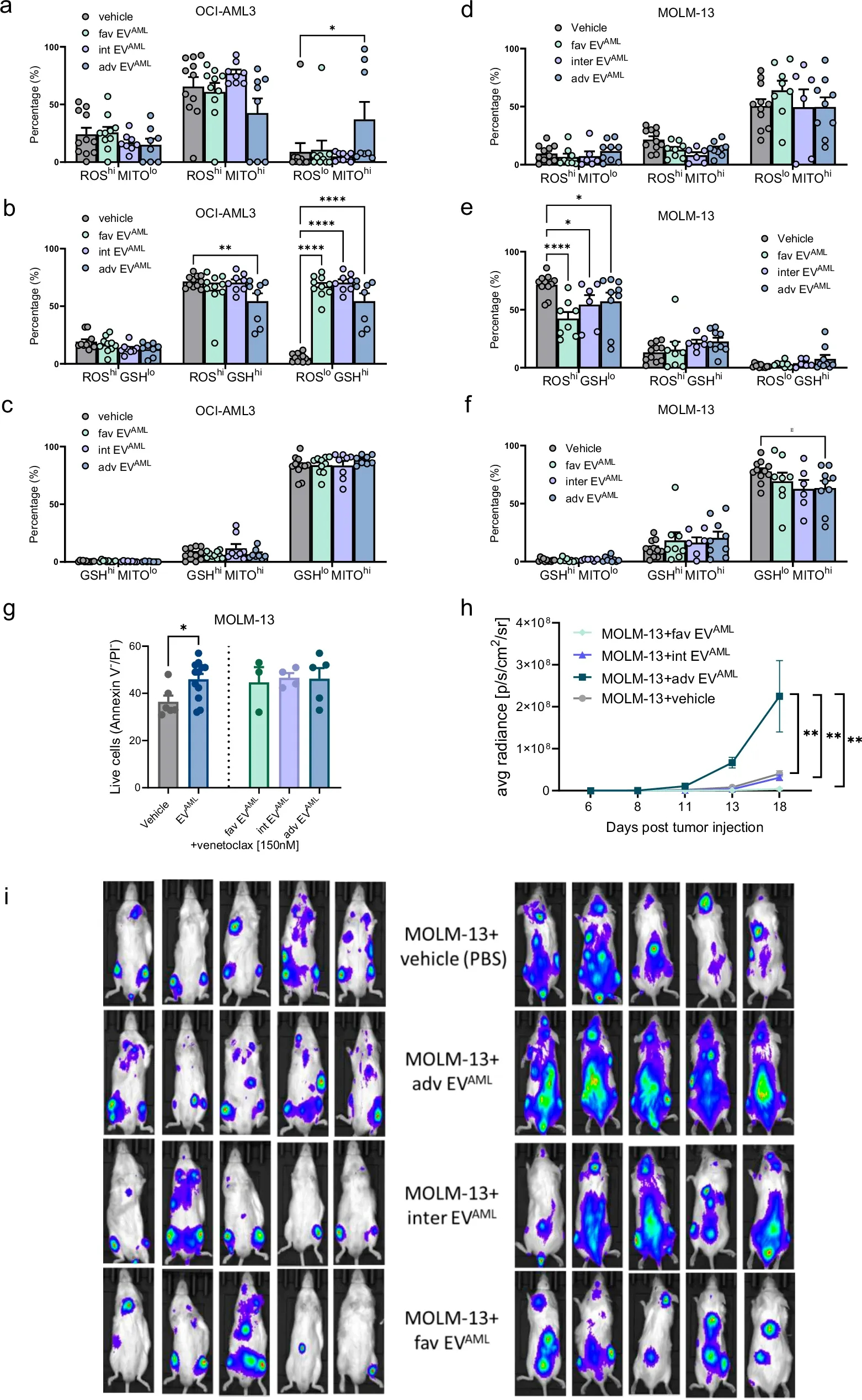
图6a-f:OCI-AML3(a, b, c)或MOLM-13细胞系(d, e, f)采用来自8个独立生物实验的EVAML,低危EVAML,中等EVAML或不良EVAML。
图6g:MOLM-13用EVAML预处理4 h,再加入BCL-2 选择性抑制剂Venetoclax处理24 h。
图6h-i:将预处理24小时的luc-mCherry MOLM-13细胞移植到小鼠体内,其中包括对照组、不良风险EVAML、中风险EVAML和低风险EVAML。h图中显示了起始后从第6天到第18天每秒平均总光子通量的生物发光定量,从第18天开始的全动物生物发光成像,各组小鼠的腹侧(左)和背侧视图图像(右)。在每个时间点(i)定义每只动物的感兴趣区域(ROI)。
体外与体内的研究结果表明,与来自中危或低危AML患者的EVAML相比,来自不良风险AML患者的EVAML可能具有更强的加速体内白血病细胞植入的能力。
7. 来自AML患者的EV改变CD34 + AML细胞的氧化还原代谢,调节GSH/GPX4轴
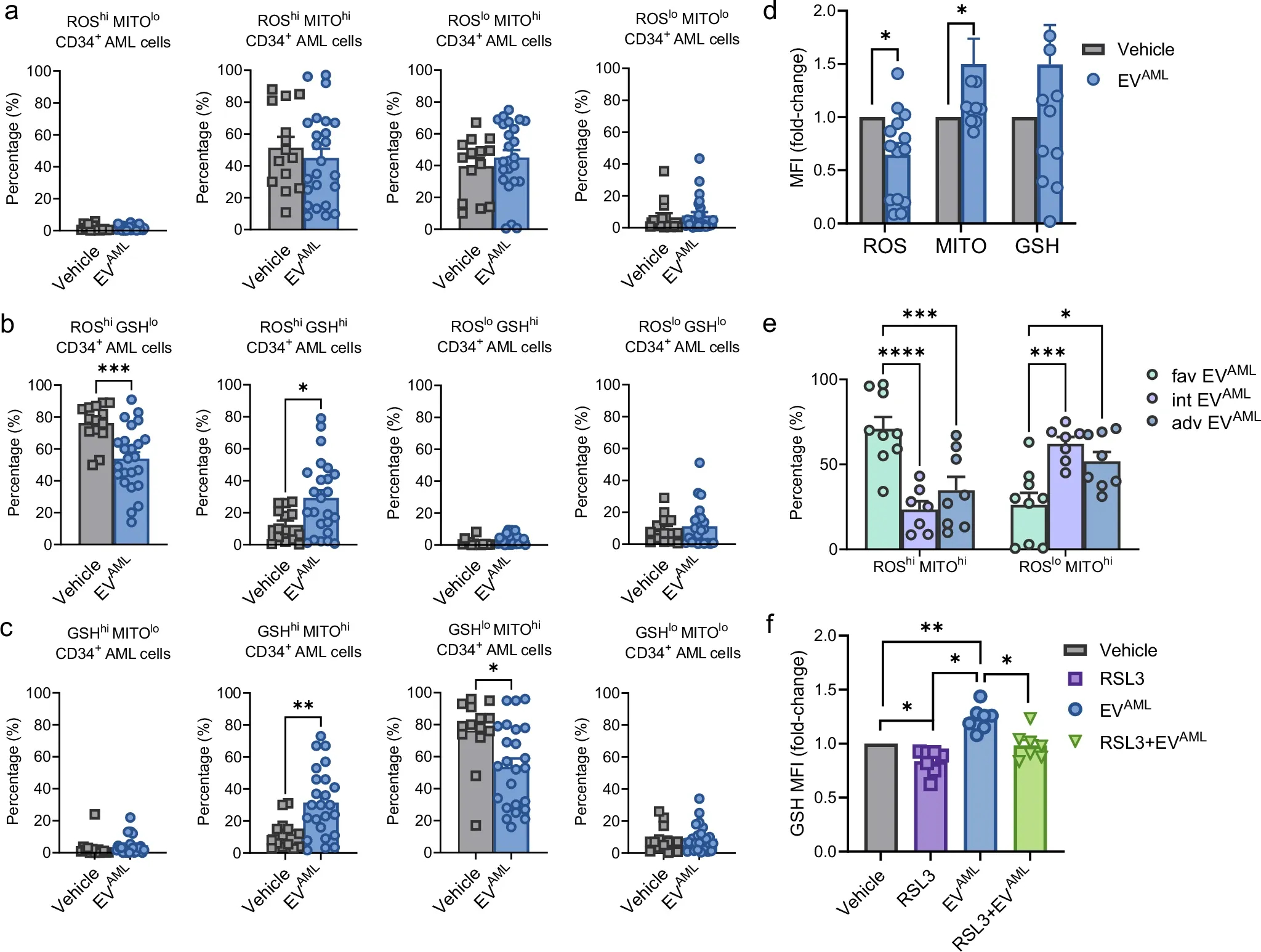
图7a-c:从诊断时的AML患者中分离出的CD34+细胞百分比在与载体(PBS)或EVAML共培养24h后进行ROS/MITO染色。(a):ROShi MITOlo,ROShi MITOhi,ROSlo MITOhi和ROSlo MITOlo亚群;(b):ROS/GSH测定ROShi GSHlo、ROShi GSHhi、ROSlo GSHhi和ROSlo GSHlo亚群;(c):GSH/MITO:GSHhi MITOlo,GSHhi MITOhi,GSHlo MITOhi,以及GSHlo MITOlo子集。
图7d:ROS的表达水平。
图7e:CD34 +的ROS hi MITO hi和 ROS lo MITO hi的百分比使用来自 10 次独立实验的低 EV AML 、中等 EV AML或不利EV AML 处理的AML细胞 。
图7f:用载体(PBS)、RSL3、EVAML或用RSL3预处理6小时后再加入EVAML,每个标记物的表达水平。
数据结果表明,来自AML患者的循环EV可能会触发 CD34 + AML细胞线粒体电位和GSH水平增加,降低ROS水平,并显示出通过GPX4抑制部分恢复的白血病依赖性机制。了解来自不同ELN风险组的EV介导的代谢依赖性可以帮助开发旨在利用新的代谢脆弱性的定制治疗策略。
8. 与循环EV AML共培养的CD34 + AML细胞中线粒体依赖性增加,破坏能量代谢
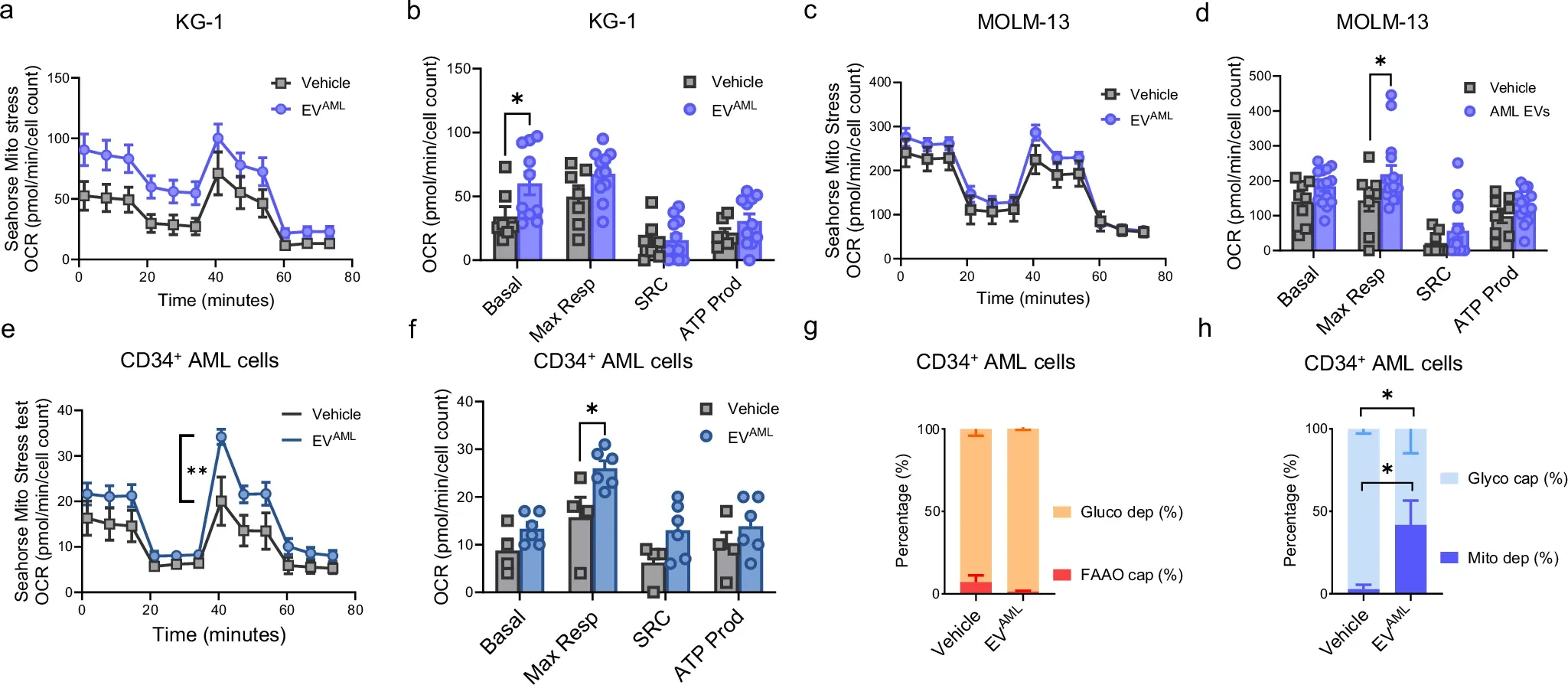
图8a-d:Seahorse XFp细胞线粒体应激谱和KG-1或MOLM-13细胞分析;(a-c):KG-1 ( a ) 或MOLM-13 (c)的耗氧率(OCR) 。从OCR图中提取的生物能参数:KG-1( b)和MOLM -13的基础呼吸(basal)、最大呼吸(Max Resp)、备用呼吸能力(SRC)和ATP相关OCR(ATP prod)(d)。
图8e-f:AML CD34 +细胞的Seahorse XFp细胞线粒体应激谱和从耗氧率 (OCR) 图中提取的相对生物能参数。
图8g-h:使用分析翻译抑制(SCENITH)在与载体(PBS)或EV AML共培养的MNC中进行代谢分析,然后进行CD34 +染色。
数据表明循环EV AML影响CD34 + AML细胞的代谢特征,且循环EV AML的影响可能颠覆AML全血样本中报告的代谢依赖性。
结论
在这项研究中,作者绘制了诊断时AML患者循环中CD34 + (CD38 low/- ) AML细胞的代谢谱和细胞外泌体特征。CD34 + AML细胞表现出高抗氧化谷胱甘肽水平和增强的线粒体功能,两者都与不良的临床结果相关。虽然CD34 +AML细胞高度依赖葡萄糖氧化和糖酵解来获取能量,但来自中危和不良风险患者的细胞显示出线粒体依赖性增加。AML的细胞外泌体主要富含干细胞标记物并表达抗氧化剂GPX3,其特征显示出潜在的预后价值。细胞外泌体通过谷胱甘肽/GPX4轴增强线粒体功能和对CD34+AML细胞的依赖性。总之,该研究强调了AML氧化还原代谢与EV特征之间的联系,对AML具有潜在的预后相关性。






