研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“国自然热点”高分速递!外泌体+氧化应激+细胞凋亡,贴脸开大冲击10+,速学速发!
542 人阅读发布时间:2025-03-07 15:01
心血管疾病是2型糖尿病患者死亡和发病的主要原因,患有糖尿病的成人患缺血性心脏病的风险是未患糖尿病的成人的两到四倍。有研究报道糖尿病脂肪细胞来源的小外泌体(sEV)可通过促进心肌细胞凋亡加重心肌再灌注(MI/R)损伤,然而,糖尿病衍生的Adipo-sEV诱导心肌细胞凋亡的分子机制尚不清楚。

湾湾今天分享的是一篇发表在【Redox Biology】(IF:10.7)上题为“Adipocyte-derived small extracellular vesicles exacerbate diabetic ischemic heart injury by promoting oxidative stress and mitochondrial-mediated cardiomyocyte apoptosis”的研究,该研究证实了糖尿病衍生外泌体促进氧化应激和线粒体介导的心肌细胞凋亡,加重心肌缺血再灌注损伤。
研究成果
1. 高脂肪饮食 (HFD)显著增加了血浆和脂肪细胞衍生的sEV的数量和大小
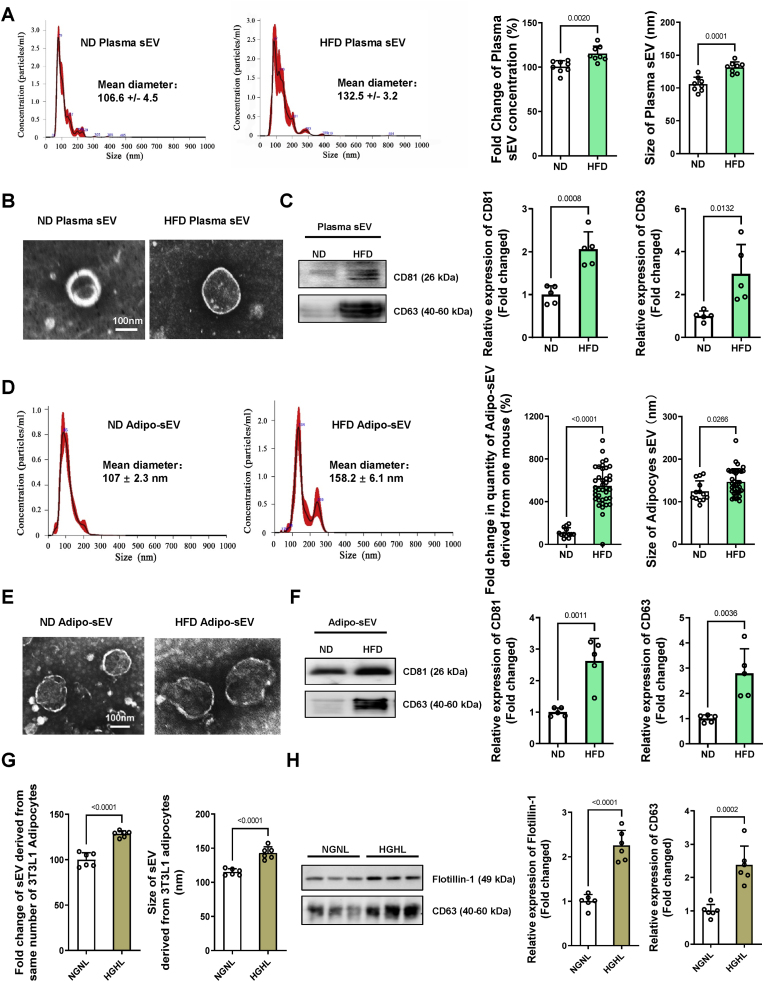
图1 HFD小鼠中血浆和脂肪细胞衍生的sEV的数量和大小增加。
图1A、D、G:使用Nanosight跟踪分析进行粒径分布和数量分析。
图1B、E:采用透射电子显微镜(TEM)对其形貌进行表征。
图1C、F、H:Western blot分析外泌体标志物CD63、CD81和Flotillin-1。
实验结果表明,糖尿病期间的高血糖/高脂血症刺激脂肪细胞sEV产生,导致血浆sEV异常。
2. 体内和体外实验结果表明,糖尿病sEV通过激活线粒体介导的细胞凋亡途径促进心肌细胞凋亡
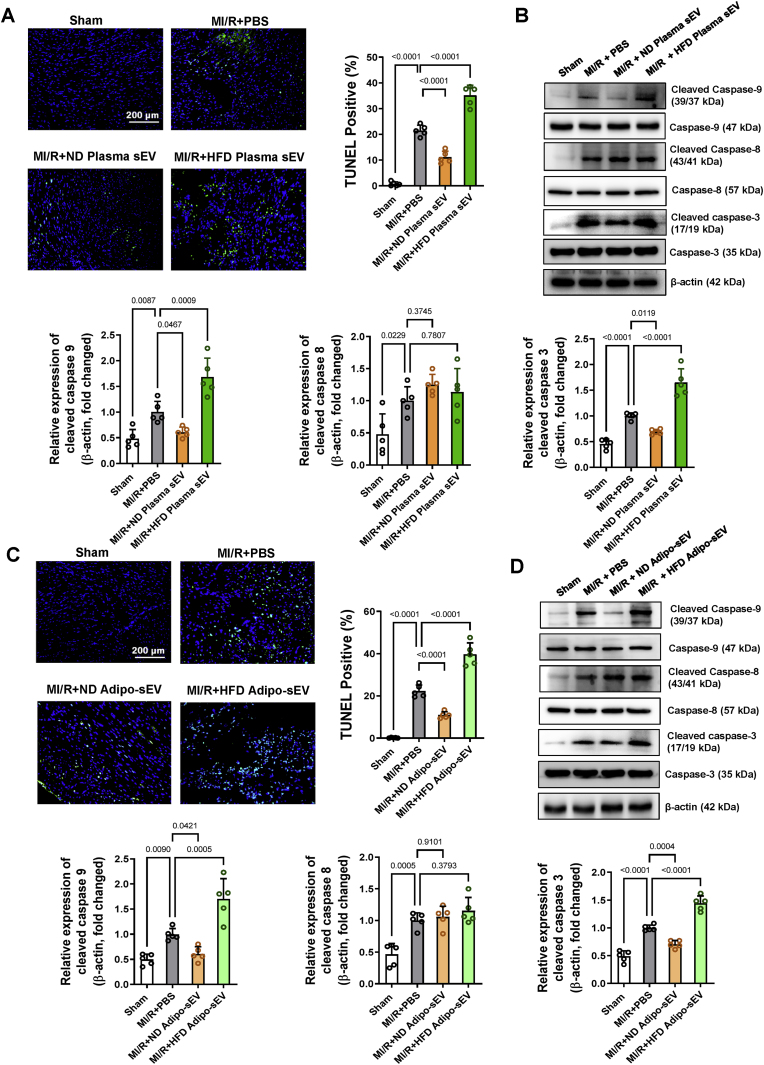
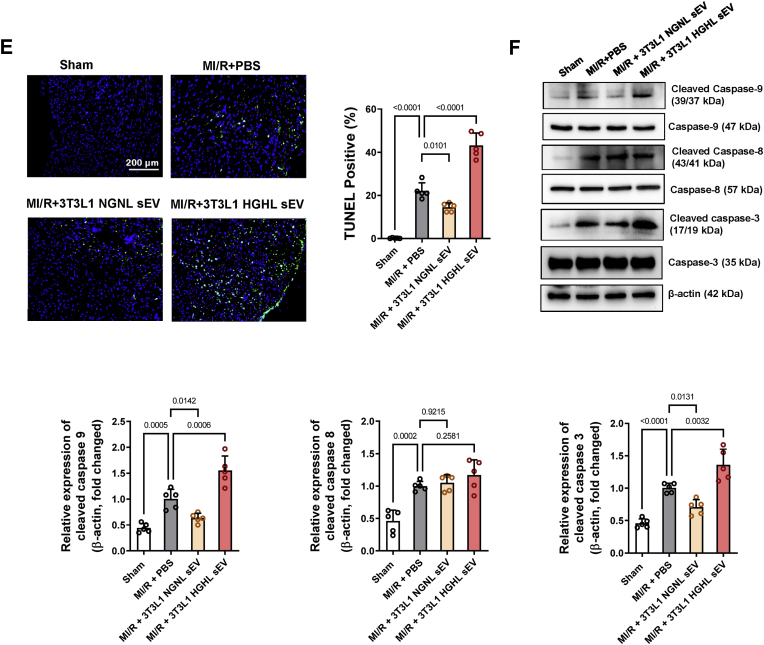
图2糖尿病sEV通过激活具有MI/R表现的非糖尿病小鼠中线粒体介导的细胞凋亡途径来促进心肌细胞凋亡。
图2A:心肌内注射正常常规饮食 (ND) /高脂饮食(HFD)血浆sEV,注射后48 h,对非糖尿病小鼠进行MI/R。再灌注3h后,采用TUNEL染色法检测心肌细胞凋亡通路。
图2B:心肌内注射ND/HFD血浆sEV,Western blot法检测cleaved caspase-3、8、9蛋白表达。
图2C:心肌内注射ND/HFD Adipo-sEV,注射后48 h,对非糖尿病小鼠进行MI/R。再灌注3h后,采用TUNEL染色法检测心肌细胞凋亡通路。
图2D:心肌内注射ND/HFD Adipo-sEV,Western blot法检测cleaved caspase-3、8、9蛋白表达。
图2E:心肌内注射NGNL/HGHL 3T3L1 sEV后48 h,对非糖尿病小鼠进行MI/R。再灌注3 h后,采用TUNEL染色法检测心肌细胞凋亡通路。
图2F:心肌内注射NGNL/HGHL 3T3L1 sEV,Western blot法检测cleaved caspase-3、8、9蛋白表达。
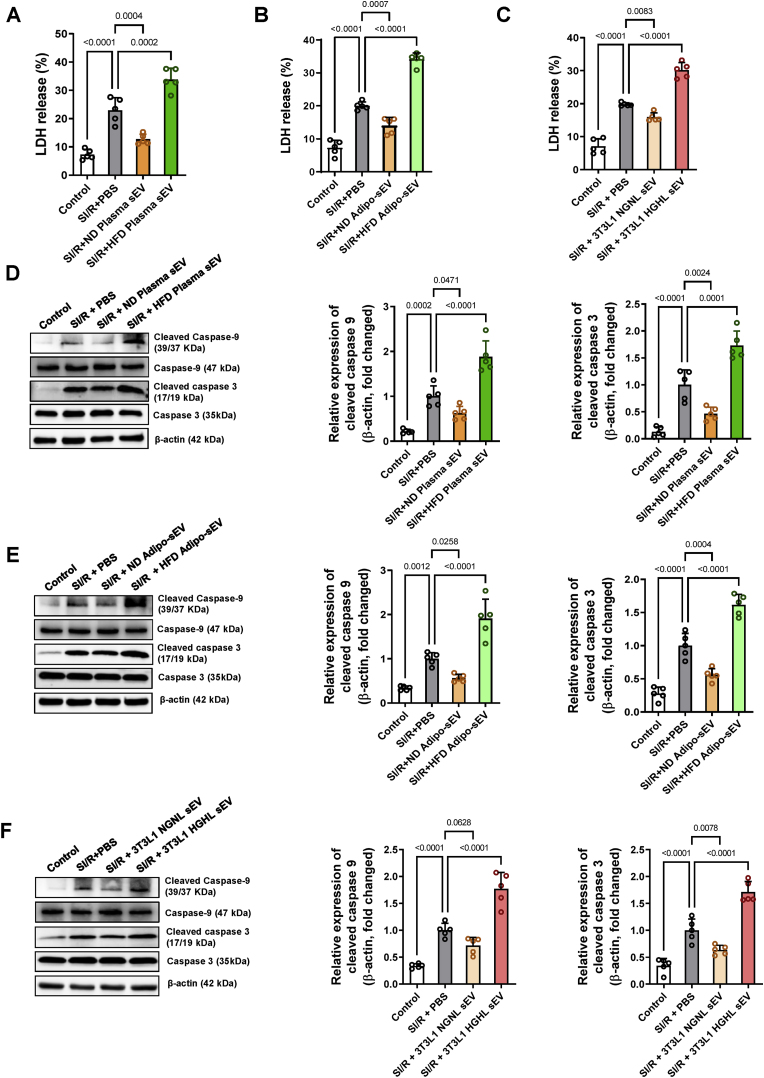
图3糖尿病sEV通过激活线粒体介导的凋亡通路促进缺血再灌注损伤大鼠NRVM心肌细胞凋亡。
图3A-C:采用乳酸脱氢酶(LDH)释放量测定细胞凋亡
图3D-F:采用Western blot法测定cleaved caspase-3、8、9表达量测定细胞凋亡。
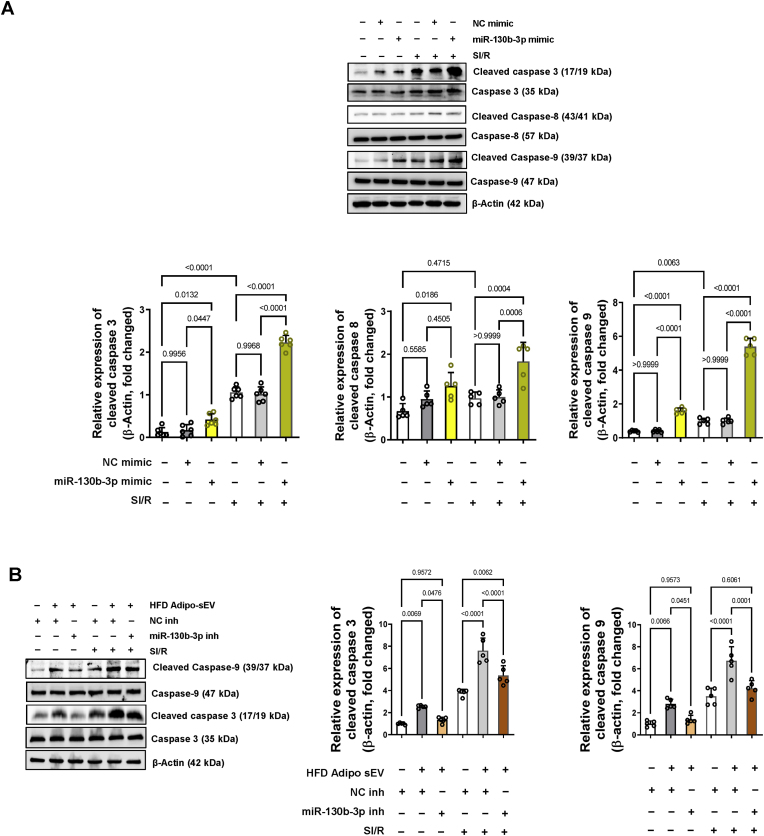
图4 HFD脂肪细胞携带的miR-130b-3p加剧了NRVM中模拟缺血/再灌注(SI/R)诱导的线粒体介导的细胞凋亡。
图4A:在用miR-130b-3p或阴性对照(NC)模拟物转染24小时并接受SI/R给药的NRVM细胞中检测到裂解的caspase-3、8、9的表达。通过蛋白质印迹测定评估蛋白质水平。
图4B:在HFD Adipo-sEV + SI/R给药之前,在过表达miR-130b-3p抑制剂 (inh)的NRVM 细胞中检测到裂解的caspase-3,8,9的表达。在HFD Adipo-sEV处理前24小时用miR-130b-3p inh或NC inh转染细胞,然后在HFD Adipo-sEV处理后24小时进行SI/R。通过蛋白质印迹测定评估蛋白质水平。
图2体内实验的结果表明,糖尿病sEV通过线粒体途径促进缺血性心脏凋亡;图3结果证实了糖尿病sEV通过激活线粒体介导的凋亡通路促进MI/R损伤大鼠NRVM心肌细胞凋亡;图4数据结果表明HFD脂肪细胞携带的miR-130b-3p加剧了NRVM中SI/R诱导的线粒体介导的细胞凋亡。
3. PGC-1α是负责糖尿病sEV诱导的心肌细胞caspase-9激活的miR-130b-3p靶标
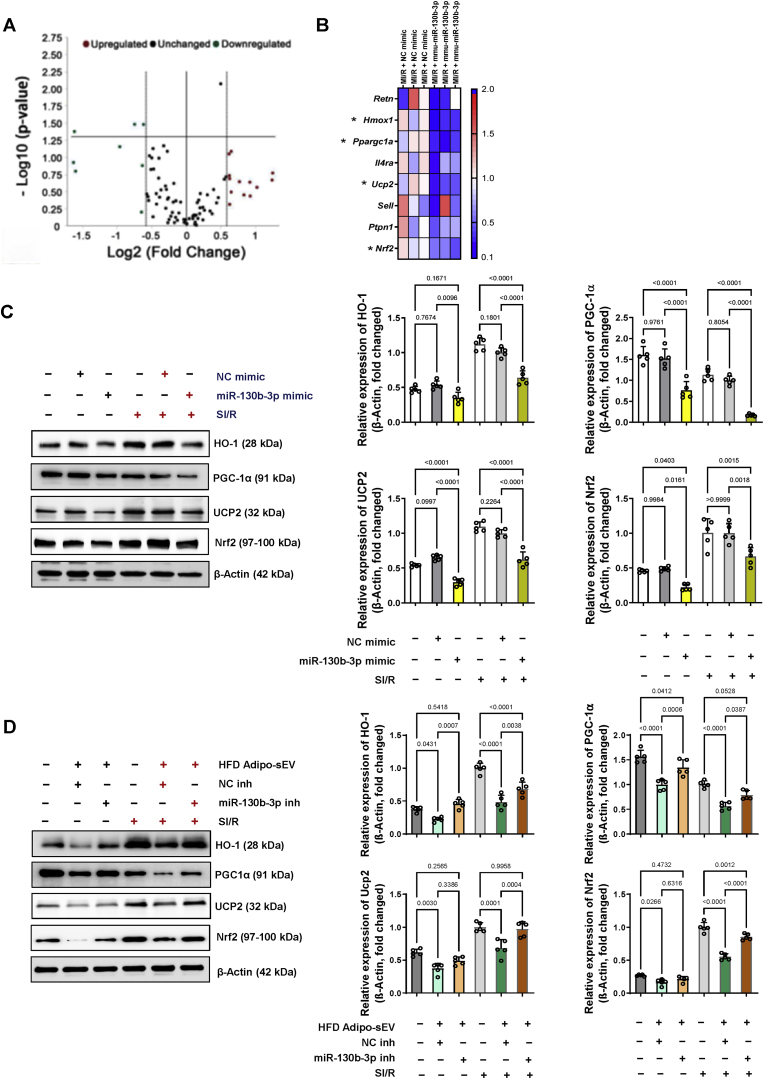
图5 miR-130b-3p降低糖尿病相关基因的表达。
图5A – B:miR-130b-3p 降低了一系列糖尿病相关基因的表达。 RT Profiler™ PCR Array Mouse Diabetes检测预给药NC模拟物或miR-130b-3p模拟物后MI/R心脏中的转录物水平。火山图(A)和下调差异基因热图(B)展示了变化的基因。
图5C:在用miR-130b-3p或NC模拟物转染24小时并接受SI/R给药的NRVM细胞中检测到蛋白质表达。
图5D:在HFD Adipo-sEV + SI/R给药之前,在过表达miR-130b-3p抑制剂 (inh) 的NRVM 细胞中检测到蛋白质表达。通过蛋白质印迹测定评估蛋白质水平。
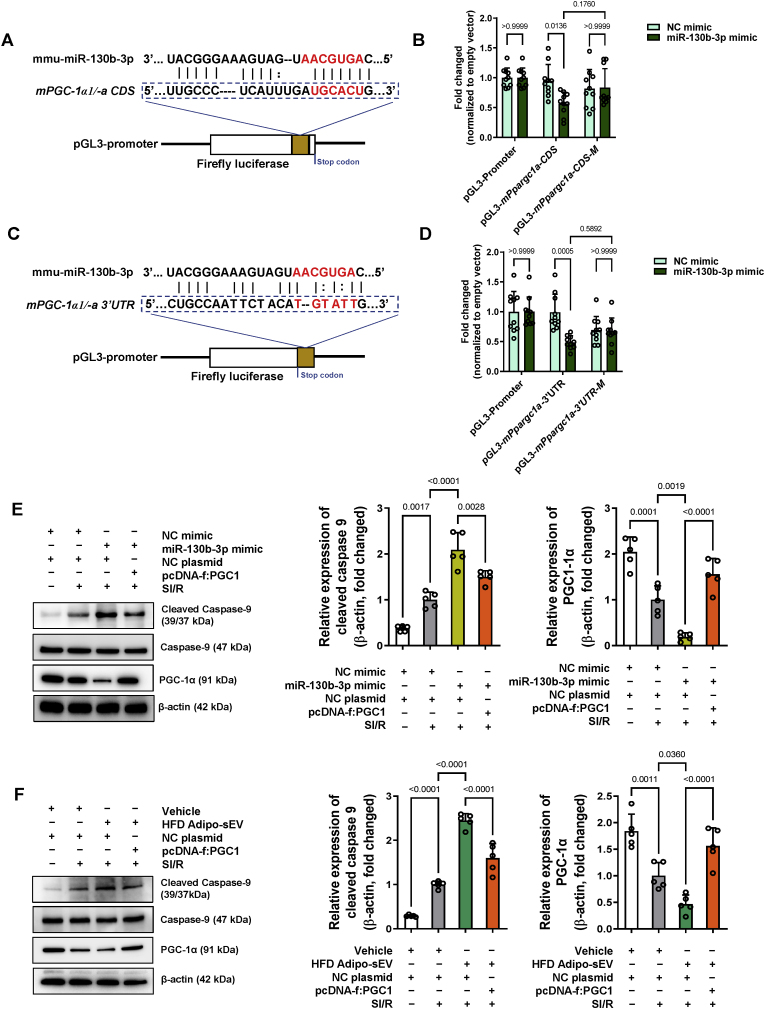
图6 miR-130b-3p介导的PGC-1α下调负责糖尿病sEV诱导的心肌细胞caspase-9激活。
图6A – D:通过报告基因分析鉴定了miR-130b-3p对小鼠PGC-1α的直接影响。将miRNA模拟物和报告质粒转染293T细胞48小时。通过萤火虫/海肾荧光素酶活性评估调节效果。
图6E:通过miR-130b-3p模拟物加SI/R给药,PGC-1α过表达恢复了NRVM细胞中裂解的 caspase-9蛋白水平。质粒pcDNA-f:PGC1 转染后24小时,用NC或miR-130b-3p模拟物转染细胞。然后在miR-130b-3p模拟物转染24小时后对细胞进行SI/R,并通过蛋白质印迹测定法测定caspase-9激活。
图6F:PGC-1α过表达通过HFD Adipo-sEV加SI/R给药恢复了NRVM细胞中裂解的caspase-9蛋白水平。质粒pcDNA-f:PGC1转染后24小时,在存在或不存在糖尿病Adipo-sEV的情况下对细胞进行SI/R。通过蛋白质印迹测定评估蛋白质水平。
图5结果表明PGC-1α是miR-130b-3p模拟物和糖尿病Adipo-sEV最显著下调的蛋白质,且被miR-130b-3p抑制剂保留;图6数据结果表明携带miR-130b-3p的糖尿病脂肪细胞来源的sEV可能通过抑制PGC-1α破坏线粒体质量控制网络或线粒体稳态失调。
4. 糖尿病脂肪细胞衍生的sEV促进线粒体线粒体活性氧(ROS)产生,这是一种可通过PGC-1α过表达逆转的病理效应
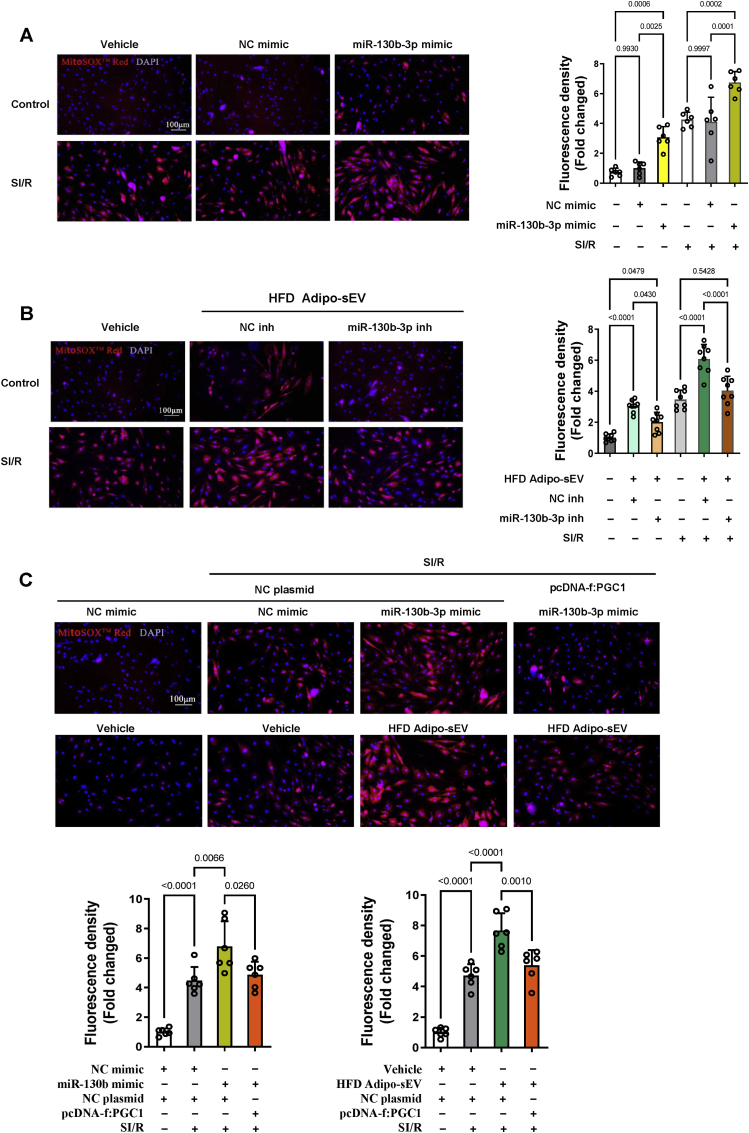
图7糖尿病ADIOP-sEV通过miR-130b-3p介导的PGC-1α下调促进线粒体ROS的产生。
图7A:红色荧光强度表明线粒体ROS的产生miR-130b-3p促进了NRVM中的SI/R诱导的线粒体ROS的产生。
图7B:miR-130b-3p抑制剂利用HFD Adipo - sEV诱导的线粒体ROS生成增强SI/R刺激的NRVM。
图7C:过表达PGC-1α恢复了在SI/ R的NRVM中miR -130b-3p或HFD Adipo - sEV诱导的线粒体ROS生成模拟物。用Image J软件分析所有红色荧光强度。
数据表明糖尿病Adipo-sEV促进线粒体超氧化物生成主要是由于miR-130b-3p抑制PGC-1α。
5. 糖尿病脂肪细胞衍生的sEV加剧了心脏损伤
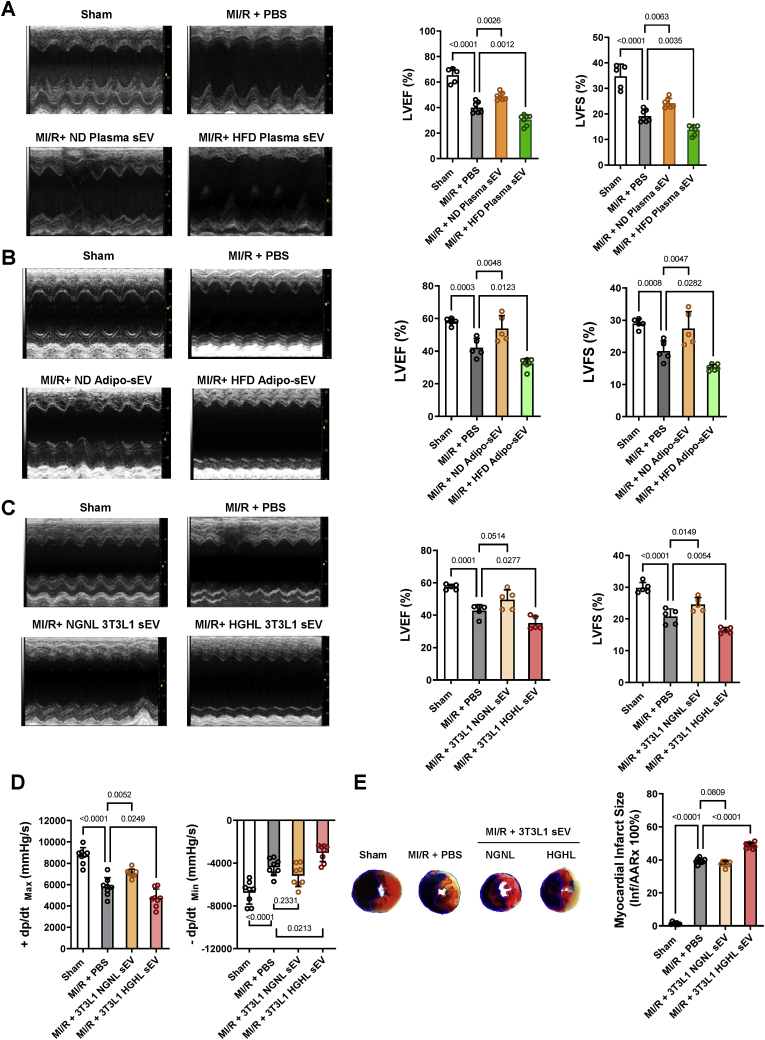
图8糖尿病脂肪细胞源性sEV加重心肌损伤。
图8A-C:测定再灌注24 h后的心功能(LVEF和LVSF)。
图8D:通过血流动力学检测评估心功能。
图8E:心肌Evans blue/TTC双染色法鉴定心肌损伤。
图8F:来自HFD 附睾白色脂肪组织 (eWAT)的miR -130b-3p富集的Adipo-sEV增强MI/R诱导的线粒体ROS生成和线粒体介导的心肌细胞凋亡示意图。
结果表明糖尿病脂肪细胞源性sEV加重了小鼠心肌损伤。
结论
该研究首次证明糖尿病sEV促进氧化应激和线粒体介导的心肌细胞凋亡,加重MI/R损伤。这些病理表型是通过miR-130b-3p抑制PGC-1α表达介导的。预防糖尿病脂肪细胞sEV生成、PGC-1α过表达或减少线粒体ROS生成可能是阻断sEV介导的脂肪-心脏病理通讯,减轻糖尿病心脏损伤的有效治疗措施。






