研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Free Radic Biol Med】7+,外泌体“泌”招,抑制铁死亡,椎间盘退变“变”轻松!
651 人阅读发布时间:2025-03-19 17:04
慢性腰痛(LBP)是全球常见疾病,而椎间盘退变(IVDD)是其主要病因,严重影响人们生活。当前IVDD治疗方法主要是手术和药物,只能缓解症状,无法有效延缓或阻止疾病进展。因此,探索IVDD的发病机制并寻找新的治疗方法至关重要。
近年来发现的铁死亡与IVDD的发展密切相关,铁死亡在退变的椎间盘组织中异常表达,且铁过载会促进IVDD。间充质干细胞(MSC)来源的外泌体(EXOs)在再生医学中具有潜力,能保留MSC的治疗特性,还可抑制铁死亡,但EXOs在抑制铁死亡缓解IVDD方面的研究较少,机制也不明确。

湾湾今天分享的是发表在【Free Radic Biol Med】(IF:7.1)上题为“Exosomes inhibit ferroptosis to alleviate intervertebral disc degeneration via the p62-KEAP1-NRF2 pathway”的研究。该研究旨在探讨EXOs是否通过抑制铁死亡来缓解IVDD,并揭示其潜在机制,为IVDD的治疗提供新方向。
研究结果
1、退变的IVD组织中铁死亡标记物的异常表达
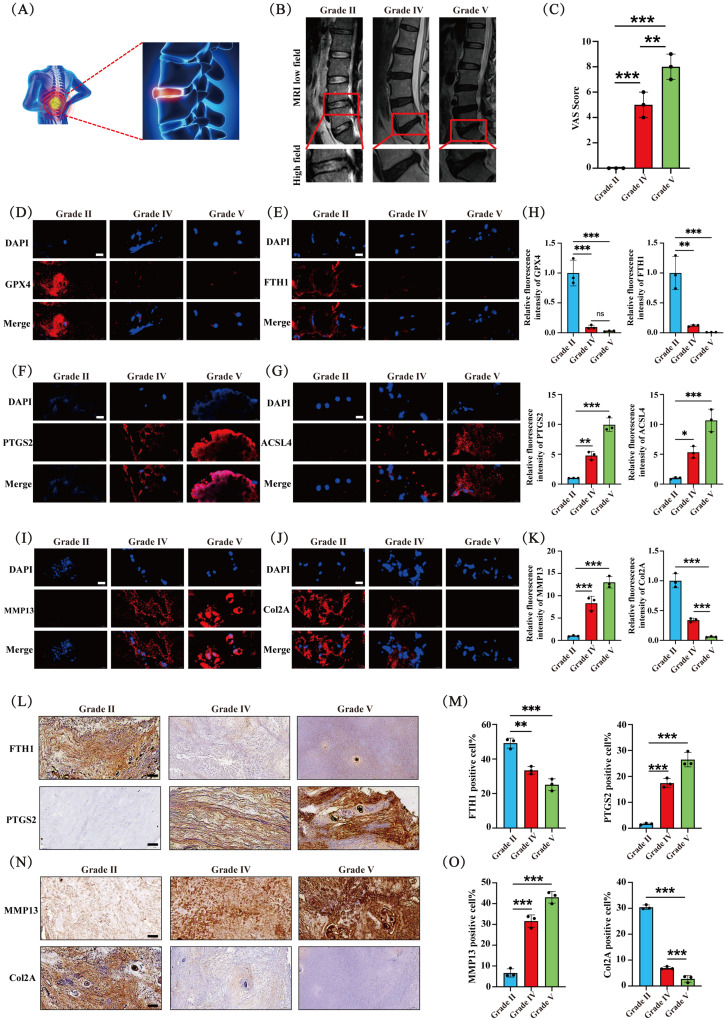
图1A:展示了IVDD患者腰痛的示意图。
图1B:不同等级IVDD患者的MRI图像(Pfirrmann分级)。
图1C:不同等级IVDD患者腰痛的视觉模拟评分(VAS),结果显示疼痛严重程度随IVDD退变增加。
图1D-H:免疫荧光(IF)检测FTH1、GPX4、PTGS2、ACSL4的表达,随退变等级增加,FTH1和GPX4表达逐渐降低,PTGS2和ACSL4表达逐渐增加。
图1I-K:IF检测MMP13和Col2A的表达,MMP13表达与IVD退变程度正相关,Col2A表达与退变程度负相关。
图1L-M:免疫组化(IHC)检测FTH1和PTGS2的表达,FTH1表达随退变等级增加而降低,PTGS2表达增加。
图1N-O:IHC检测MMP13和Col2A的表达,结果与IF检测一致。
这些结果表明,铁死亡标记物在退变的IVD组织中异常表达,提示铁死亡可能在IVDD的发展和进展中发挥作用,同时ECM降解与IVDD进展相关。
2、铁死亡参与TBHP诱导的细胞死亡
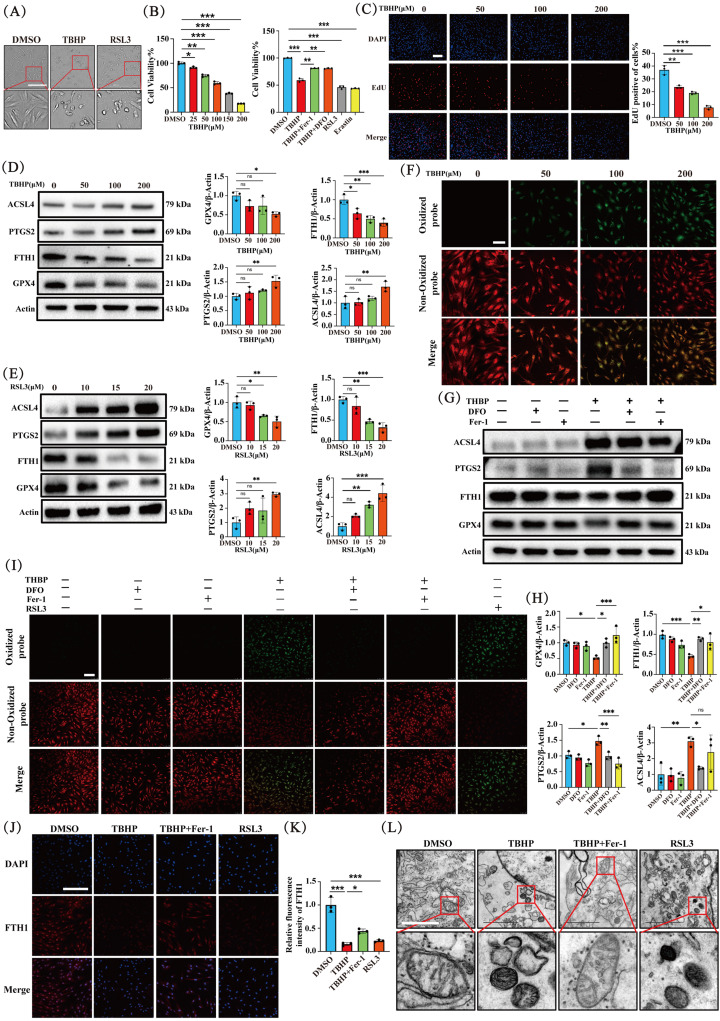
图2A:显微镜下观察到TBHP(150μM)和RSL3(15μM)处理3小时后NP细胞的形态变化,呈现铁死亡特征的“气球样”表型。
图2B:MTT检测不同浓度TBHP处理3小时对NP细胞活力的影响,以及TBHP、RSL3、erastin处理后细胞活力变化,还有Fer-1和DFO预处理6小时对TBHP损伤细胞的保护作用,结果显示NP细胞活力随TBHP浓度增加而降低,Fer-1和DFO可提高被TBHP抑制的细胞活力,RSL3和erastin降低细胞活力。
图2C:EdU检测不同浓度TBHP处理的NP细胞增殖情况,细胞增殖随TBHP浓度增加而逐渐减少,DFO可逆转TBHP对细胞增殖的抑制作用,RSL3与TBHP作用相似。
图2D:Western blot分析不同浓度TBHP处理3小时后NP细胞中FTH1、GPX4、PTGS2、ACSL4蛋白水平变化,GPX4和FTH1表达下降,ACSL4和PTGS2表达增加。
图2E:Western blot分析不同浓度RSL3处理3小时后NP细胞中相关蛋白水平变化,趋势与TBHP处理相似。
图2F:检测不同浓度TBHP处理的NP细胞脂质过氧化水平,TBHP处理后脂质过氧化水平增加。
图2G-H:Western blot分析DFO和Fer-1预处理6小时对TBHP处理的NP细胞中相关蛋白水平的影响,DFO和Fer-1可逆转TBHP诱导的FTH1和GPX4表达下降,以及ACSL4和PTGS2表达增加。
图2I:检测上述不同处理的NP细胞脂质过氧化水平,结果与蛋白水平变化一致。
图2J-K:IF检测不同处理下NP细胞中FTH1的表达,Fer-1和TBHP处理组FTH1荧光强度高于TBHP单独处理组,Erastin处理组FTH1荧光强度较低。
图2L:透射电镜(TEM)观察不同处理下NP细胞线粒体形态变化,TBHP和RSL3刺激使线粒体收缩、嵴密度增加、外膜破裂,Fer-1处理可改善TBHP诱导的线粒体形态变化。
这些结果表明,铁死亡在氧化应激诱导的NP细胞死亡中起关键作用。
3、EXOs减轻TBHP和RSL3诱导的NP细胞铁死亡
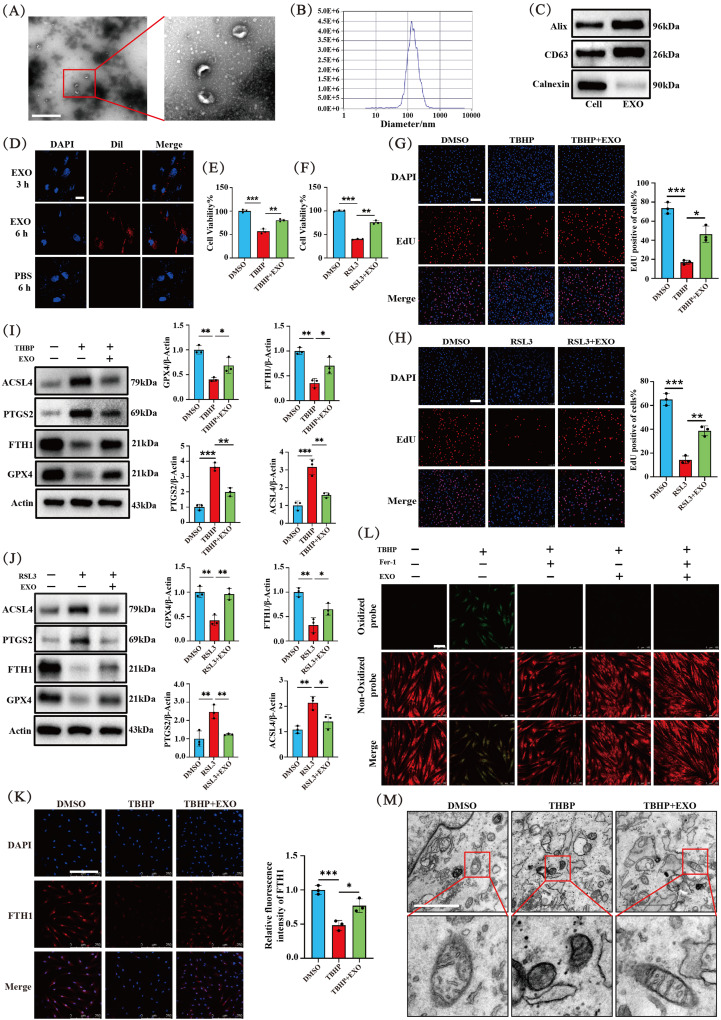
图3A:TEM观察EXOs形态,呈杯状或球形。
图3B:纳米颗粒跟踪分析(NTA)显示EXOs粒径主要在50-200nm之间。
图3C:Western blot检测EXO标记蛋白Alix、CD63和内质网蛋白Calnexin,结果显示提取的纳米颗粒富含Alix和CD63,缺乏Calnexin。
图3D:Dil染色显示EXOs可随时间被NP细胞内化。
图3E-F:MTT检测TBHP或RSL3处理3小时对NP细胞活力的影响,以及EXO预处理6小时的保护作用,EXOs显著抑制TBHP和RSL3诱导的NP细胞活力下降。
图3G-H:EdU检测TBHP或RSL3处理3小时的NP细胞增殖情况,以及EXO预处理6小时的保护作用,EXOs可逆转TBHP或RSL3导致的NP细胞增殖减少。
图3I-J:Western blot分析TBHP或RSL3处理3小时,有无EXO预处理6小时的NP细胞中FTH1、GPX4、PTGS2、ACSL4蛋白水平变化,EXOs显著逆转TBHP或RSL3诱导的FTH1和GPX4下调,以及ACSL4和PTGS2上调。
图3K:IF检测不同处理下NP细胞中FTH1的表达,趋势与Western blot结果相似。
图3L:检测不同处理下NP细胞脂质过氧化水平,TBHP显著诱导脂质过氧化,EXOs和/或Fer-1干预可逆转该过程。
图3M:TEM观察不同处理下NP细胞线粒体形态变化,EXO处理可挽救TBHP诱导的线粒体形态变化。
这些结果表明,EXOs可减轻TBHP或RSL3诱导的NP细胞铁死亡。
4、TBHP诱导NP细胞退变,铁死亡抑制剂和EXOs可减轻该过程
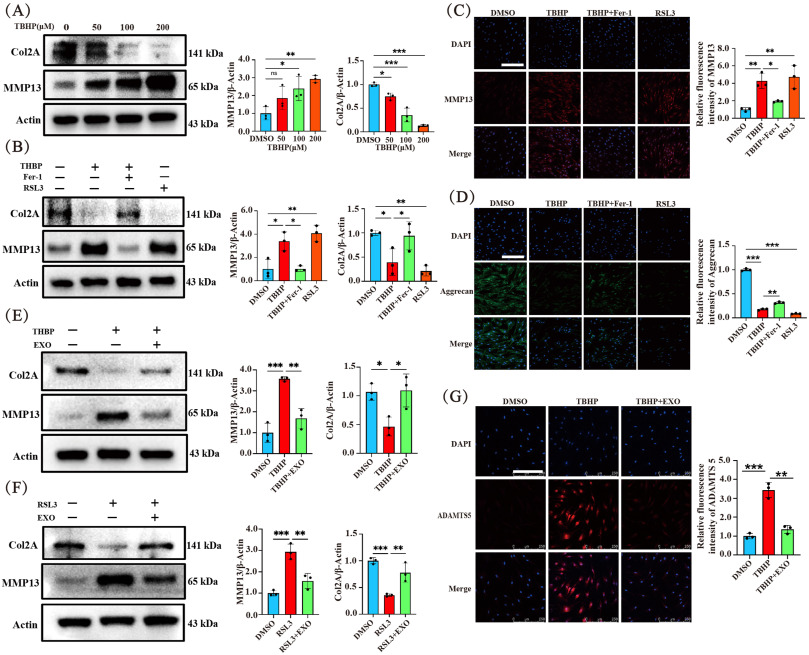
图4A:Western blot分析不同浓度TBHP处理3小时后NP细胞中Col2A和MMP13蛋白水平变化,MMP13表达逐渐增加,Col2A表达逐渐减少。
图4B:Western blot分析TBHP或RSL3处理3小时,以及Fer-1预处理6小时对NP细胞中Col2A和MMP13蛋白水平的影响,Fer-1可逆转TBHP诱导的蛋白表达异常,RSL3诱导蛋白表达异常。
图4C-D:IF检测不同处理下NP细胞中MMP13和Aggrecan的表达,TBHP或RSL3处理使MMP13荧光强度增加,Aggrecan荧光强度降低,Fer-1干预可逆转这些效应。
图4E-F:Western blot分析TBHP或RSL3处理3小时,以及EXO预处理6小时对NP细胞中MMP13和Col2A蛋白水平的影响,EXOs可逆转TBHP或RSL3诱导的MMP13表达增加和Col2A表达减少。
图4G:IF检测不同处理下NP细胞中ADAMTS5的表达,结果与上述蛋白变化一致。
这些结果表明,TBHP诱导NP细胞退变,铁死亡抑制剂和EXOs可减轻这一过程,EXOs可能通过抑制细胞外基质降解来减缓IVDD进展。
5、EXOs通过调节p62/KEAP1/NRF2轴减轻NP细胞氧化应激诱导的铁死亡
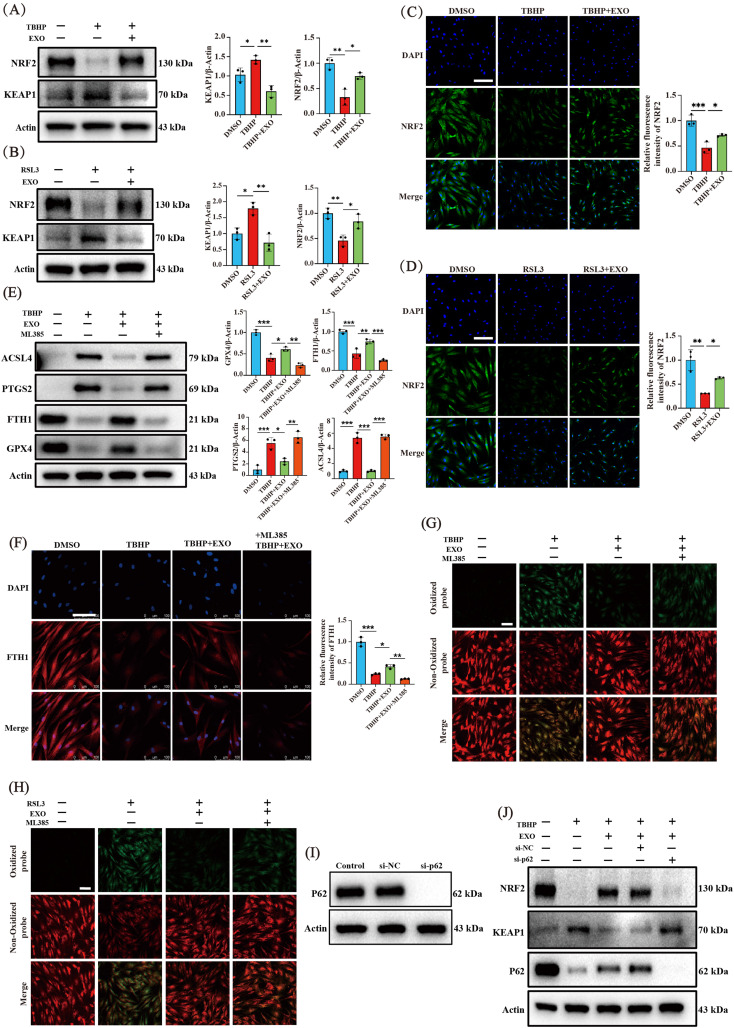
图5A-B:Western blot分析TBHP或RSL3处理3小时,以及EXO预处理6小时对NP细胞中NRF2和KEAP1蛋白水平的影响,TBHP和RSL3增加KEAP1表达,降低NRF2表达,EXO干预激活NRF2表达,降低KEAP1表达。
图5C-D:IF检测不同处理下NP细胞中NRF2的表达,结果与Western blot一致。
图5E:Western blot分析ML385共处理后NP细胞中FTH1、GPX4、PTGS2、ACSL4蛋白水平变化,ML385逆转了EXOs对铁死亡标记蛋白的抑制作用。
图5F:IF检测ML385共处理后NP细胞中FTH1的表达,结果与Western blot相似。
图5G-H:检测不同处理下NP细胞脂质过氧化水平,TBHP或RSL3单独处理诱导脂质过氧化,EXOs显著抑制,但ML385预处理可逆转这种抑制作用。
图5I:验证p62敲低效果。
图5J:Western blot分析p62敲低后NP细胞中NRF2、KEAP1和p62蛋白水平变化,p62敲低逆转了EXOs对KEAP1表达的抑制作用和对NRF2的激活作用。
这些结果表明,EXOs可能通过调节p62/KEAP1/NRF2轴减轻NP细胞氧化应激诱导的铁死亡。
6、EXOs有效减轻IVDD的进展
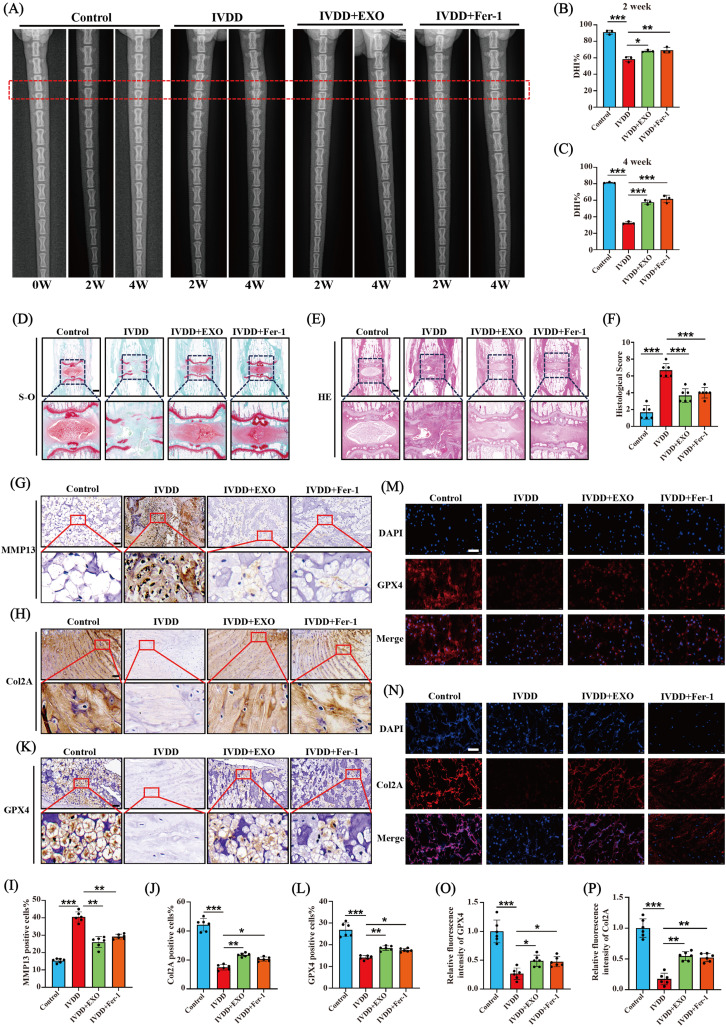
图6A:X射线图像显示大鼠尾椎间盘穿刺后0、2、4周的高度变化,穿刺诱导的IVDD组椎间盘间隙变窄,EXO处理组和Fer-1处理组部分恢复。
图6B-C:穿刺后2周和4周椎间盘高度指数(DHI)统计分析,结果与X射线图像一致。
图6D:S-O染色显示大鼠尾椎间盘形态,EXO和Fer-1处理改善了细胞结构和形态。
图6E:HE染色显示大鼠尾椎间盘形态,结果与S-O染色相似。
图6F:基于NP形态和细胞结构的IVDD进展组织学评分,EXO和Fer-1处理组评分低于IVDD模型组。
图6G-J:免疫组化染色检测大鼠尾椎间盘组织中MMP13、Col2A和GPX4的表达,IVDD组MMP13表达升高,Col2A表达降低,EXO干预降低MMP13表达,增加Col2A表达,与Fer-1处理效果相似。
图6K-L:免疫组化检测IVDD组织中GPX4的表达,IVDD组NP组织中无GPX4阳性细胞,EXO干预后GPX4表达增加,Fer-1干预效果类似。
图6M-P:IF染色检测大鼠尾椎间盘组织中Col2A和GPX4的表达,结果与免疫组化一致。
这些结果表明,EXOs可抑制IVD组织中的ECM降解,抑制铁死亡,从而减轻IVDD的发生和进展。
结论
本研究在组织水平发现铁死亡标记物在退变的IVD组织中异常表达;体外实验表明铁死亡参与TBHP诱导的NP细胞死亡,且可被铁死亡抑制剂抑制;EXOs可减轻NP细胞铁死亡,减缓其退变过程,机制与调节p62/KEAP1/NRF2轴有关;在动物模型中,EXOs有效减轻IVDD和铁死亡。综上,铁死亡与IVDD的发展和进展密切相关,EXOs通过p62/KEAP1/NRF2信号通路抑制NP细胞铁死亡,减缓IVDD进展,是IVDD潜在的治疗策略。






