研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
14+爆文深挖,外泌体搭载神奇“小钥匙”,开启免疫调节新大门
320 人阅读发布时间:2025-03-28 14:52
银屑病是一种慢性炎症性皮肤病,由免疫系统过度激活引发,传统治疗方法如甲氨蝶呤和环孢素因感染、患恶性肿瘤等风险受限,靶向细胞因子的生物制剂虽有效但难以完全治愈疾病。间充质干细胞来源的细胞外囊泡(MSC-EVs)因免疫调节和抗炎特性在银屑病治疗中展现潜力,但单独使用效果不佳且机制不明。研究发现精氨酸酶1(Arg1)/多胺在银屑病患者和小鼠中过表达,诱导自身抗原原位积累。

湾湾今天分享的是一篇发表在【Advanced Science】(IF:14.3)上题为“Engineered Mesenchymal Stem Cell-Derived Extracellular Vesicles Scavenge Self-Antigens for Psoriasis Therapy via Modulating Metabolic and Immunological Disorders”的研究,本研究制备了装载Arg1抑制剂nor-NOHA的工程化MSC-EVs(nor@MSC-EVs),旨在探究其治疗银屑病的效果和机制。
研究成果
1.Arg1/多胺介导银屑病的发展
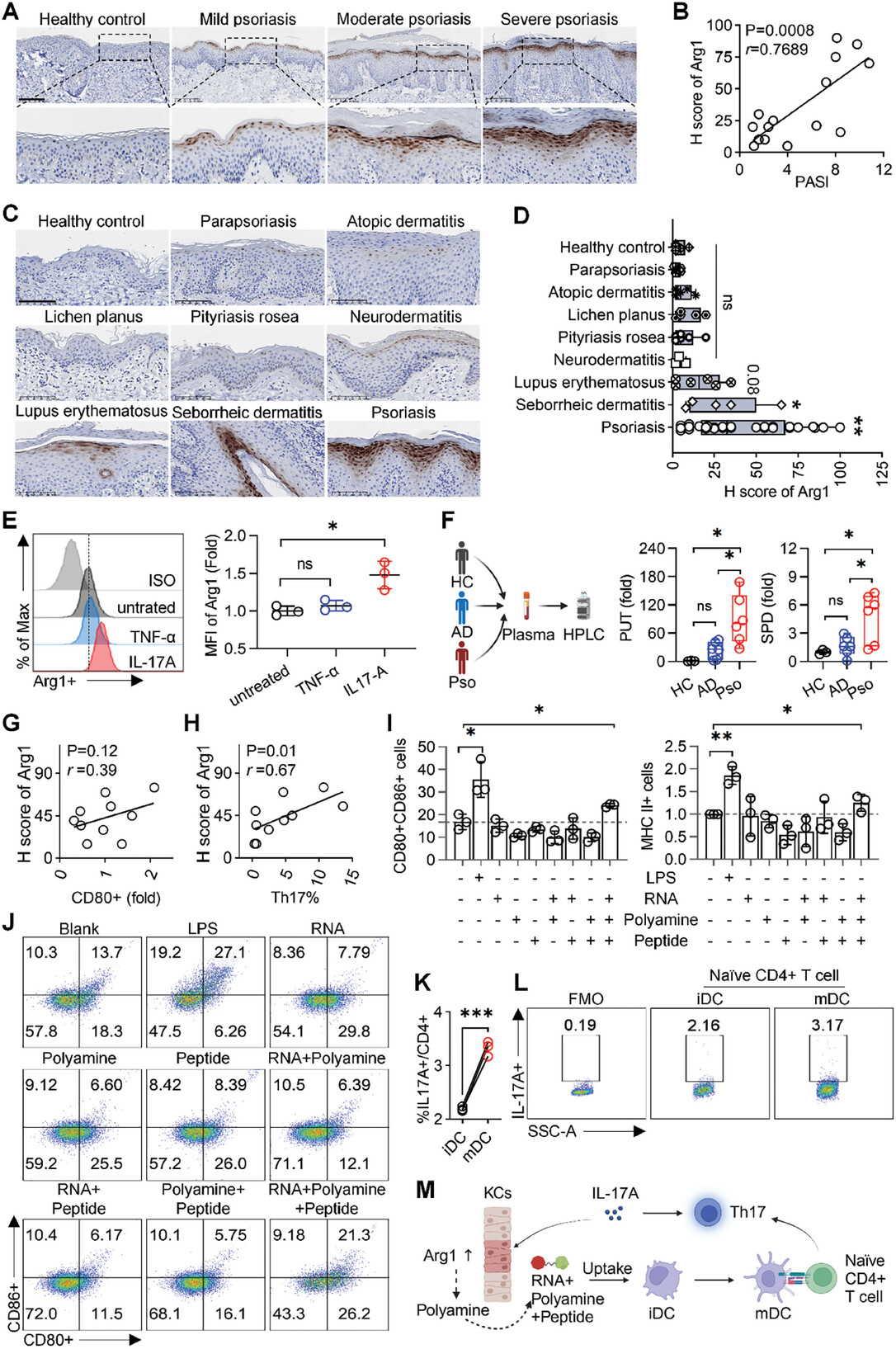
图1A:免疫组化染色显示,银屑病患者皮肤表皮中Arg1的表达高于健康对照组。
图1B:线性回归分析表明,Arg1表达水平(H评分)与银屑病面积和严重程度指数(PASI评分)呈正相关。
图1C-D:对多种鳞屑性红斑皮肤病患者皮肤切片进行免疫组化分析,发现副银屑病、特应性皮炎等疾病中Arg1表达可忽略不计,而红斑狼疮、脂溢性皮炎和银屑病中Arg1过表达。
图1E:体外实验中,用不同细胞因子刺激HaCaT细胞,只有IL-17A能诱导Arg1上调,且呈浓度依赖性。
图1F:高效液相色谱(HPLC)分析显示,银屑病患者血浆中腐胺(PUT)和亚精胺(SPD)水平高于特应性皮炎患者,特应性皮炎患者与健康对照无显著差异。
图1G-H:在咪喹莫特(IMQ)诱导的银屑病小鼠模型中,皮肤样本的线性回归分析表明,Arg1表达(H评分)与免疫标记物(DCs中的CD80和CD4+T细胞中的Th17)呈正相关。
图1I-J:用RNA+多胺+肽复合物刺激骨髓来源的DCs(BMDCs),其成熟标记物显著增加。
图1K-L:将未成熟的CD4+T细胞与经RNA+多胺+肽复合物预处理的BMDCs共培养,成熟的DCs促进CD4+IL17A+细胞(Th17)的分化。
图1M:展示了Arg1/多胺介导银屑病发展的机制示意图。
这些结果表明,Arg1在银屑病中特异性过表达,且Arg1/多胺参与了代谢和免疫紊乱的循环关系,推动了银屑病的发展。
2.减少银屑病特异性自身抗原降低DCs的成熟和Th17细胞的活化
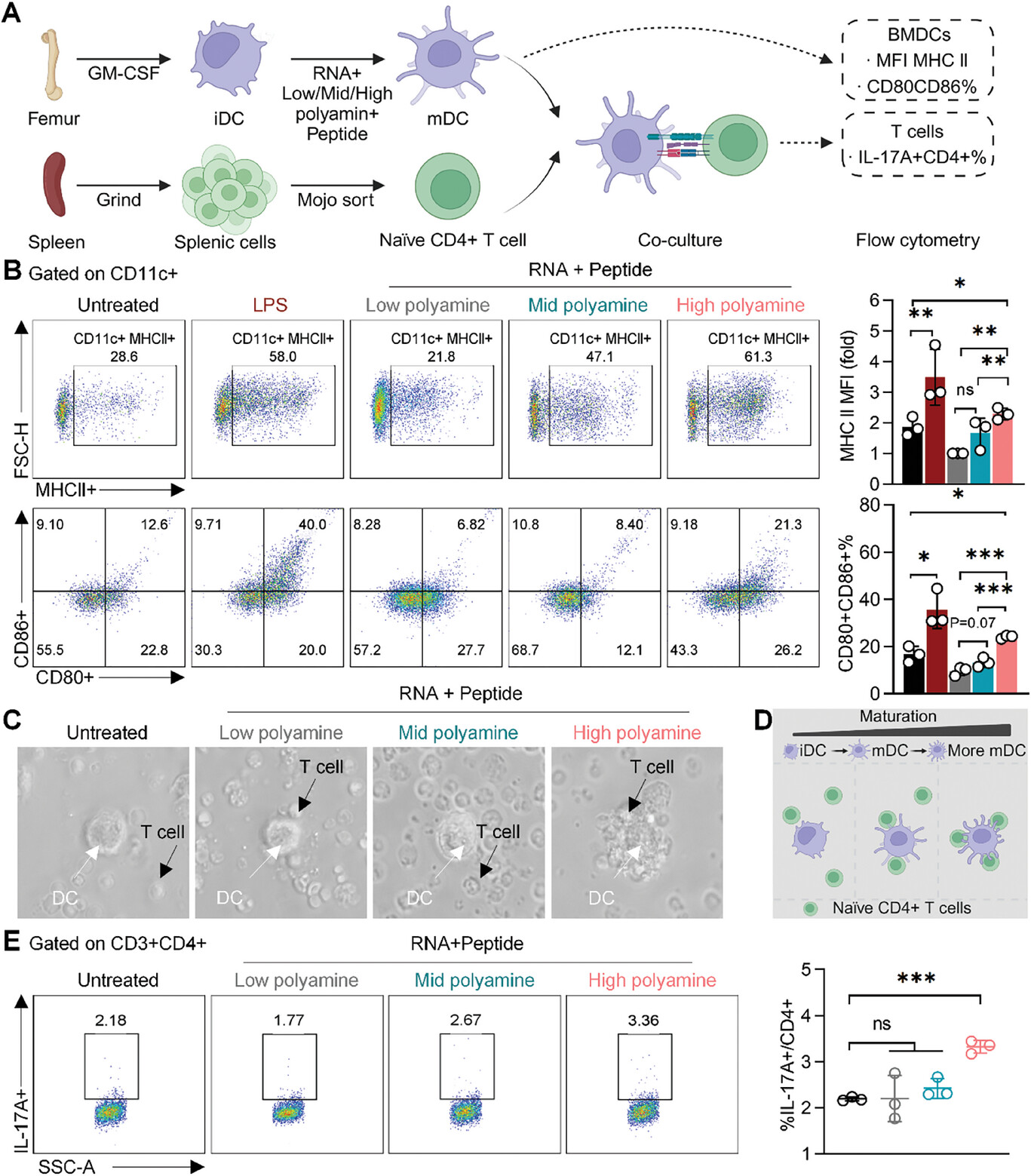
图2A:展示了用银屑病特异性抗原(RNA+低/中/高多胺+肽复合物)预处理的BMDCs与未成熟CD4+T细胞共培养的示意图。
图2B:流式细胞术分析显示,随着多胺浓度增加,RNA+多胺+肽复合物刺激的BMDCs中MHCII、CD80和CD86的表达升高,RNA+高多胺+肽复合物组的MHCII表达增加最为显著。
图2C-D:显微镜图像和示意图显示,由于DCs上MHCII表达降低,CD4+T细胞与BMDCs的相互作用减少。
图2E:流式细胞术分析表明,与高多胺组相比,用RNA+低/中多胺+肽复合物预处理的BMDCs与未成熟CD4+T细胞共培养时,IL17A+CD4+T细胞的百分比降低。
这些结果表明,降低多胺浓度可减弱DC-T细胞相互作用,减少Th17分化,靶向Arg1介导的多胺生成可能为银屑病治疗提供新策略。
3.nor@MSC-EVs的工程设计和特性及其对角质形成细胞代谢紊乱和银屑病表型的调节作用
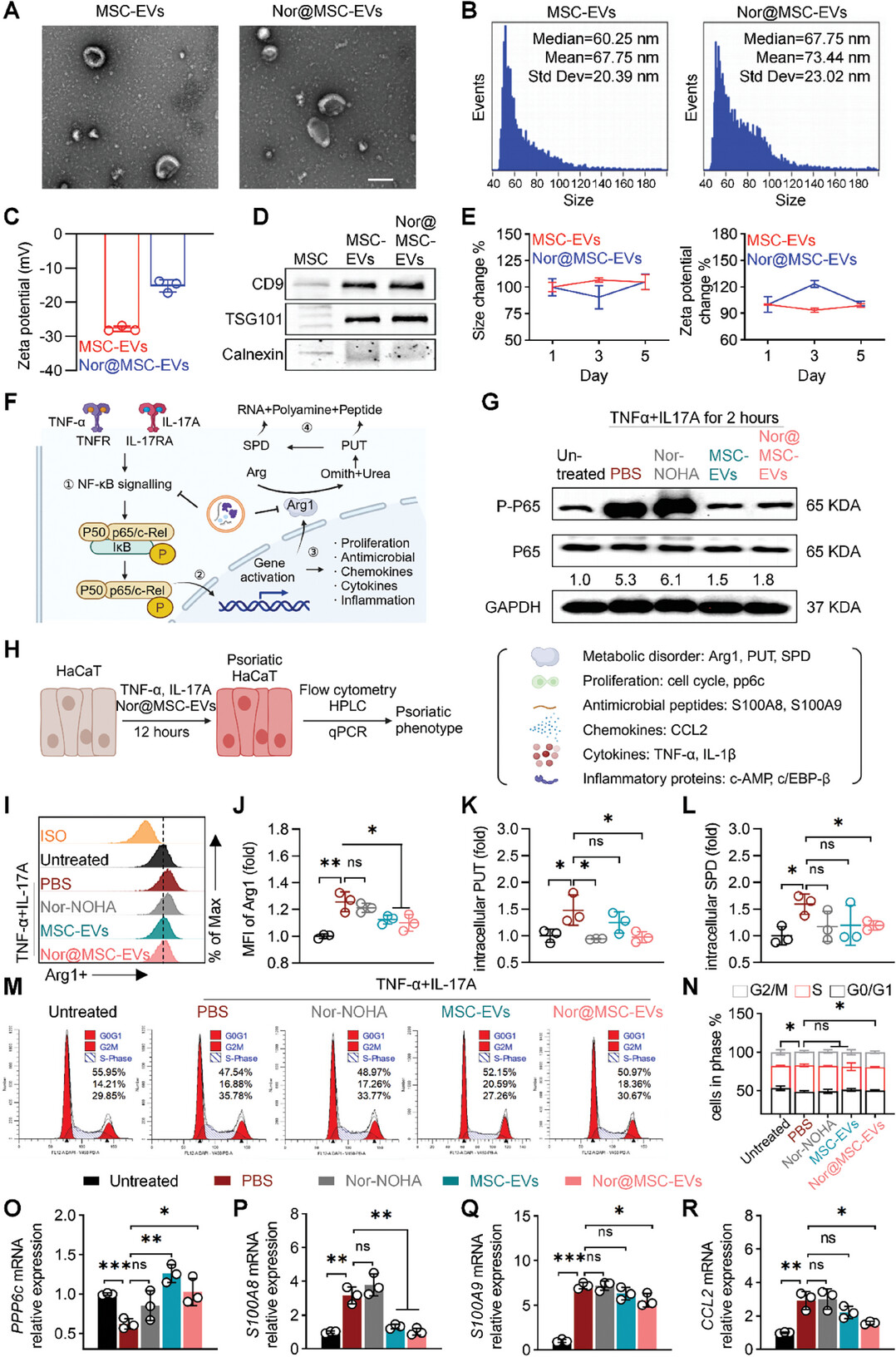
图3A:透射电镜(TEM)图像显示,MSC-EVs和nor@MSC-EVs均呈典型的双凹盘状。
图3B:纳米流式分析测得MSC-EVs的峰值直径为60.2nm,nor@MSC-EVs为67.7nm。
图3C:动态光散射(DLS)测量显示,nor@MSC-EVs的zeta电位从MSC-EVs的-27.8mV变为-15.2mV,证实nor-NOHA成功装载到MSC-EVs中。
图3D:Western blot分析表明,MSC-EVs和nor@MSC-EVs均表达常见的EV生物标志物CD9和TSG101,而钙连蛋白表达为阴性,进一步验证了MSC-EVs的成功纯化和修饰。
图3E:DLS分析显示,MSC-EVs和nor@MSC-EVs在4°CPBS中储存5天,其物理化学性质无显著变化。
图3F:展示了TNF-α和IL-17A激活HaCaT细胞中NF-κB信号通路的示意图以及nor@MSC-EVs的抑制作用。
图3G:蛋白质免疫印迹分析显示,与PBS组相比,未处理组的p-p65/p65显著增加,MSC-EVs组和nor@MSC-EVs组的p-p65/p65显著降低,表明二者对NF-κB激活有抑制作用。
图3H:展示了诱导HaCaT细胞产生银屑病表型的示意图。
图3I-J:流式细胞术分析表明,与其他组相比,MSC-EVs和nor@MSC-EVs能有效抑制Arg1的表达。
图3K-L:HPLC分析显示,nor-NOHA组和MSC-EVs组的细胞内多胺水平降低,nor@MSC-EVs组的PUT和SPD明显降低。
图3M-N:流式细胞术分析表明,nor@MSC-EVs有效限制了角质形成细胞从G1期到S期的进展,S期细胞百分比从PBS组的35.8%降至nor@MSC-EVs组的30.7%。
图3O:qPCR结果显示,nor@MSC-EVs组中PPP6C基因(负调控G1-S期转换)表达上调,从PBS组的0.6倍增加到1.0倍。
图3P-Q:qPCR分析显示,nor@MSC-EVs组中抗菌肽S100A8和S100A9的表达显著降低。
图3R:qPCR分析表明,nor@MSC-EVs组中趋化因子CCL2的表达降低至PBS组的近50%。
这些结果表明,成功制备了nor@MSC-EVs,且其能抑制NF-κB信号通路,减少Arg1介导的多胺生成,抑制角质形成细胞的过度增殖和炎症相关蛋白的表达,改善银屑病表型。
4.Nor@MSC-EVs体外直接调节免疫紊乱
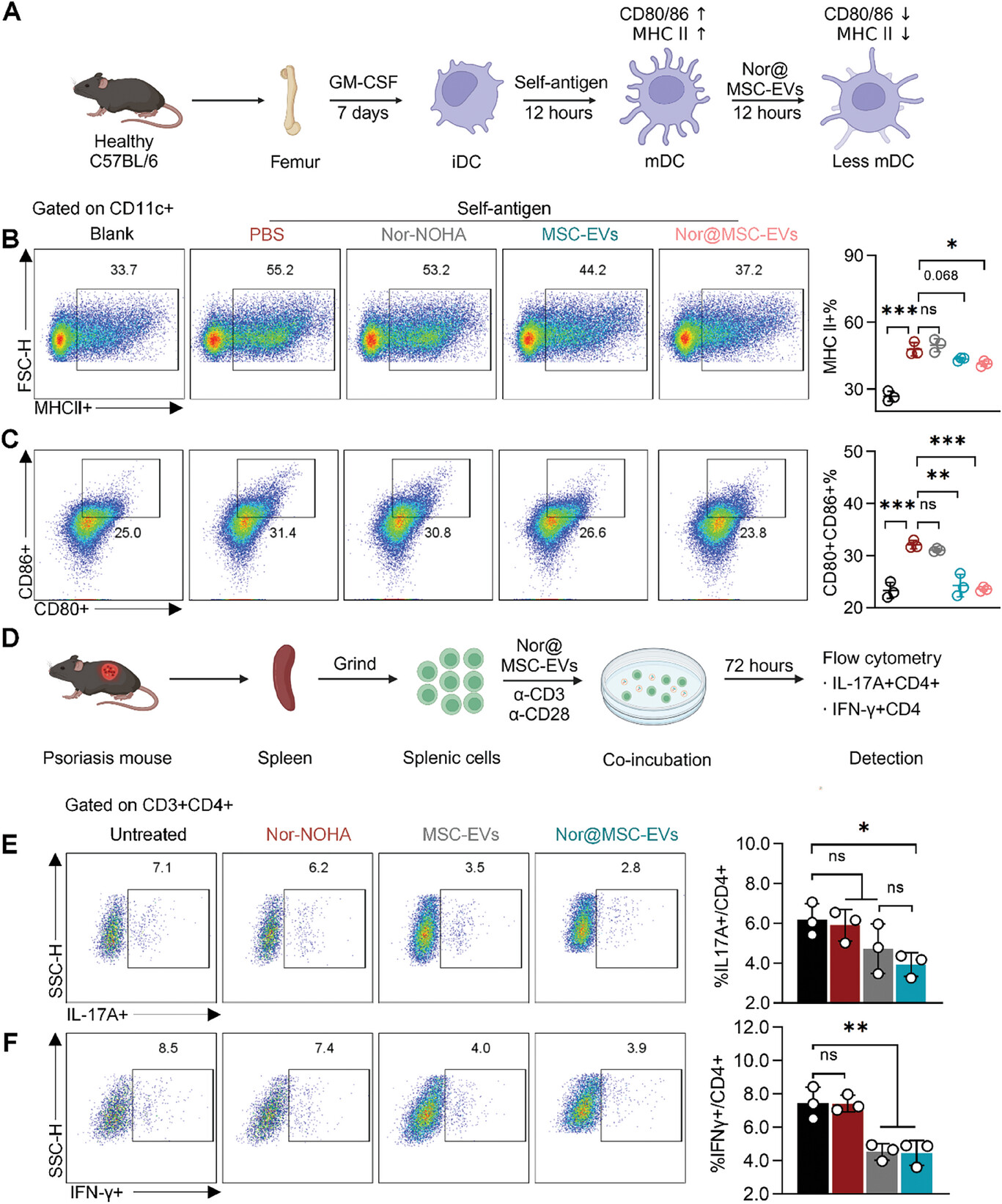
图4A:展示了BMDCs的分离、培养、刺激和处理的示意图。
图4B:流式细胞术分析显示,与空白对照相比,PBS组BMDCs中MHCII的表达显著增加,经MSC-EVs和nor@MSC-EVs处理后,MHCII的表达分别从PBS组的55.2%降至44.2%和37.2%。
图4C:流式细胞术分析表明,MSC-EVs和nor@MSC-EVs处理后,BMDCs中协同刺激分子CD80和CD86的表达显著降低。
图4D:展示了从银屑病小鼠中分离、培养和处理脾细胞的示意图。
图4E-F:流式细胞术分析显示,与未处理对照组相比,nor@MSC-EVs显著降低了IL-17A+CD4+T细胞(Th17)的百分比,从7.1%降至2.8%,MSC-EVs和nor@MSC-EVs组中IFN-γ+CD4+T细胞(Th1细胞)的百分比也显著降低。
这些结果表明,MSC-EVs和nor@MSC-EVs可直接抑制BMDCs的成熟以及Th1和Th17细胞的分化,发挥直接的免疫调节作用,且工程化过程未改变MSC-EVs的免疫调节能力。
5.nor@MSC-EVs在IMQ诱导的银屑病小鼠体内的生物分布和治疗研究
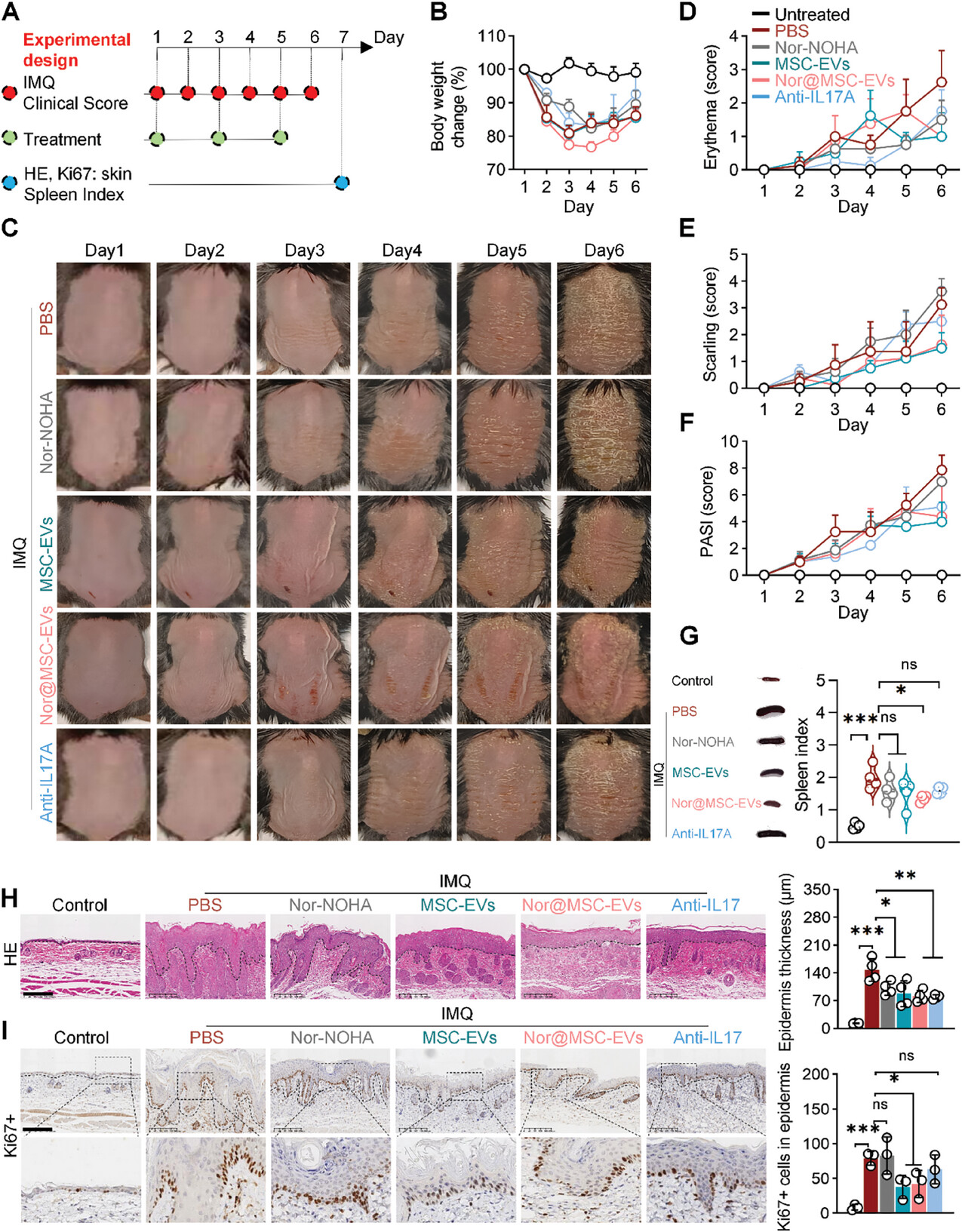
图5A:展示了在IMQ诱导的银屑病小鼠模型中进行治疗研究的实验设计。
图5B:治疗期间,PBS、nor-NOHA、MSC-EVs、nor@MSC-EVs和抗IL17A组的小鼠体重无明显变化。
图5C:代表性图像显示,与PBS和nor-NOHA组相比,MSC-EVs、nor@MSC-EVs和抗IL17A组的皮肤病变明显改善,表现为红肿和鳞屑减少。
图5D-F:相应的临床评分显示,MSC-EVs、nor@MSC-EVs和抗IL17A组的红斑、鳞屑和总PASI评分降低。
图5G:nor@MSC-EVs组的脾脏指数(脾脏重量/体重)与PBS组相比显著降低,表明其有效抑制了全身炎症。
图5H:HE染色分析显示,PBS组的平均表皮厚度显著增加,治疗后所有组的表皮厚度均显著降低,nor@MSC-EVs组和抗IL17A组对表皮增生的抑制作用最强。
图5I:免疫染色和定量分析表明,与PBS组相比,MSC-EVs和nor@MSC-EVs组中Ki67+细胞(细胞增殖标记物)的数量显著减少。
这些结果表明,nor@MSC-EVs在IMQ诱导的银屑病小鼠模型中能有效减轻皮肤病变,抑制全身炎症和角质形成细胞的过度增殖,是缓解银屑病症状的最有效治疗选择。
6.nor@MSC-EVs通过批量RNA测序分析抑制NF-κB和细胞因子信号通路
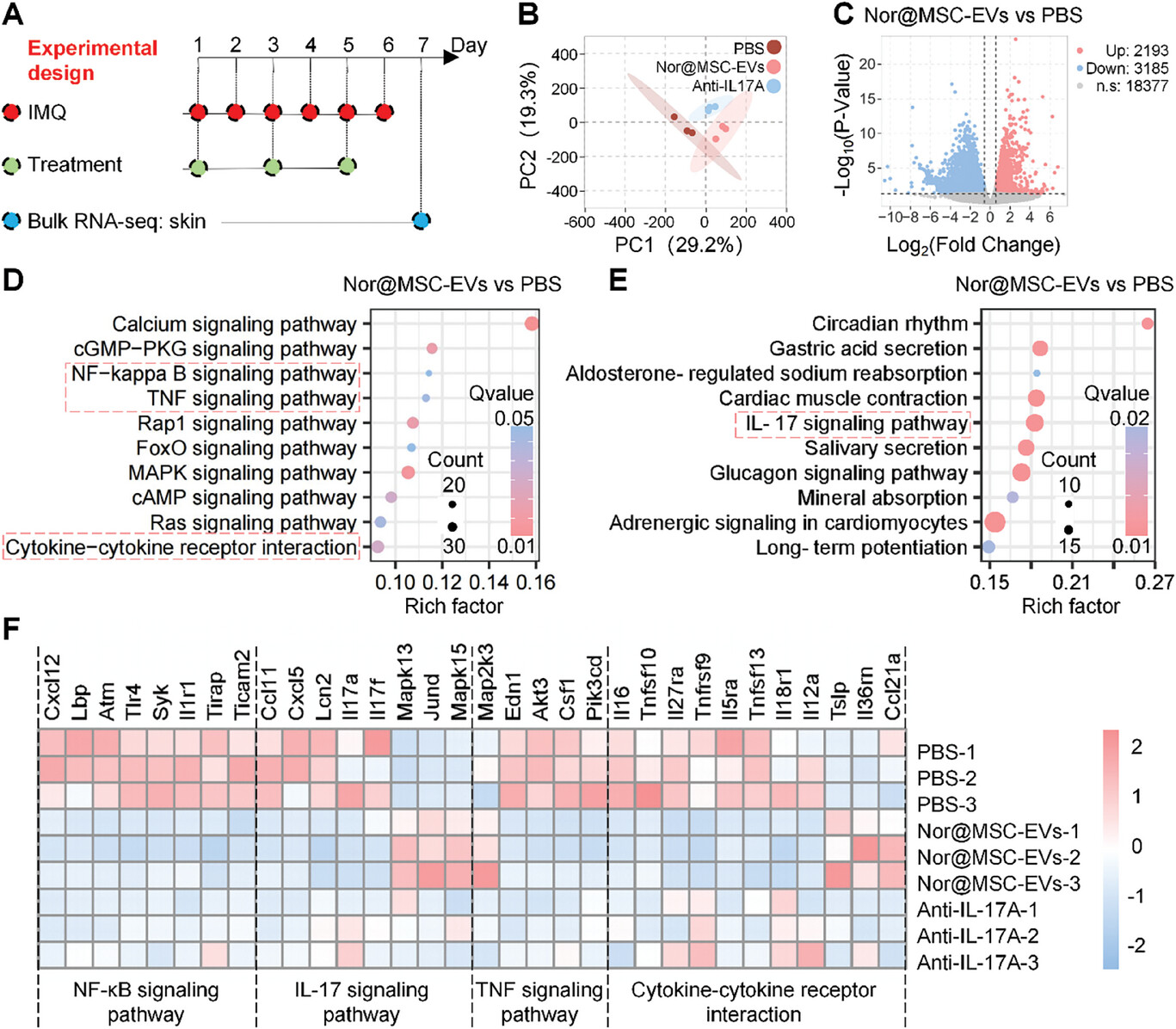
图6A:展示了分析银屑病小鼠皮肤转录组的实验流程。
图6B:主成分分析(PCA)显示,PBS、nor@MSC-EVs和抗IL17A组的基因表达模式不同。
图6C:火山图分析显示,与PBS组相比,nor@MSC-EVs组有5378个显著差异表达基因(DEGs),其中2193个上调,3185个下调。
图6D-E:KEGG注释分析显示,DEGs在环境信息处理和机体系统相关的信号通路中富集,尤其是NF-κB、TNF-α、IL-17信号通路和细胞因子-细胞因子受体相互作用。
图6F:热图显示,nor@MSC-EVs和抗IL-17A处理后,NF-κB、TNF-α和IL-17信号通路相关基因以及细胞因子-细胞因子受体相互作用相关基因的表达下调。
这些结果表明,nor@MSC-EVs通过抑制NF-κB和细胞因子信号通路,调节相关基因表达,为其治疗银屑病的疗效提供了机制解释。
7.nor@MSC-EVs治疗后表皮和血浆中多胺水平降低
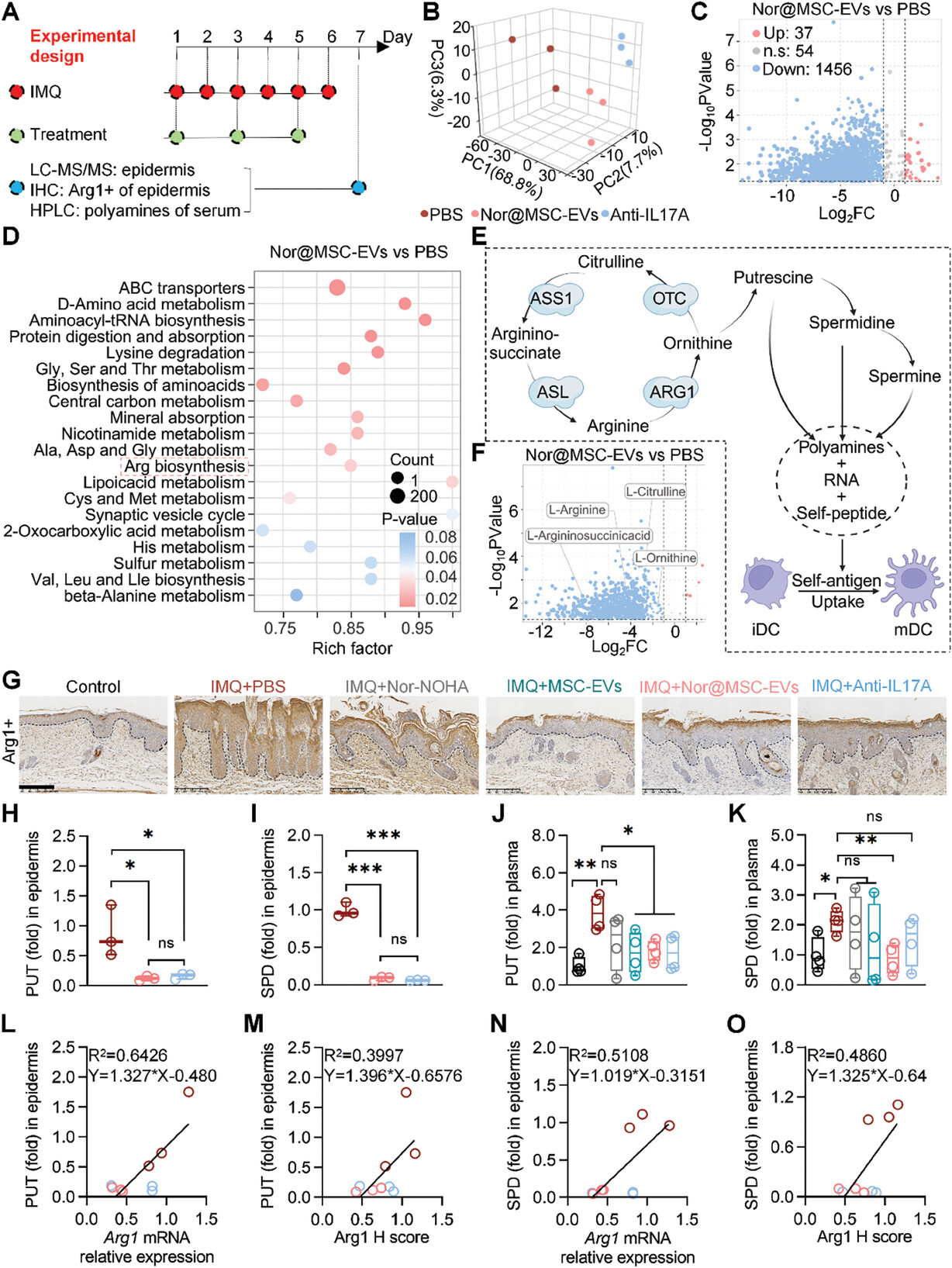
图7A:展示了分析IMQ诱导的银屑病小鼠表皮和血浆中局部和全身代谢物的实验流程。
图7B:PCA分析清楚地区分了PBS、nor@MSC-EVs和抗IL17A组的样本分类。
图7C:火山图分析显示,与PBS组相比,nor@MSC-EVs组有37种代谢物上调,1456种下调。
图7D:KEGG富集分析显示,差异调节代谢物(DRMs)在D-氨基酸代谢、中央碳代谢、精氨酸生物合成途径等中显著富集。
图7E:展示了精氨酸生物合成、下游多胺代谢及其对免疫稳态影响的示意图。
图7F:火山图分析证实,与PBS组相比,nor@MSC-EVs组中精氨酸代谢途径的底物和产物下调。
图7G:免疫组化分析显示,与PBS组相比,MSC-EVs和nor@MSC-EVs组中Arg1的H评分显著降低。
图7H-K:LC-MS/MS和HPLC分析显示,nor@MSC-EVs和抗IL17A处理后,表皮和血浆中PUT和SPD水平显著降低。
图7L-O:线性回归分析表明,多胺水平与Arg1表达呈正相关。
这些结果表明,nor@MSC-EVs通过抑制Arg1表达,显著降低了局部和全身多胺水平,影响精氨酸代谢及免疫稳态。
8.nor@MSC-EVs对IMQ诱导的银屑病小鼠局部和全身免疫紊乱的治疗作用
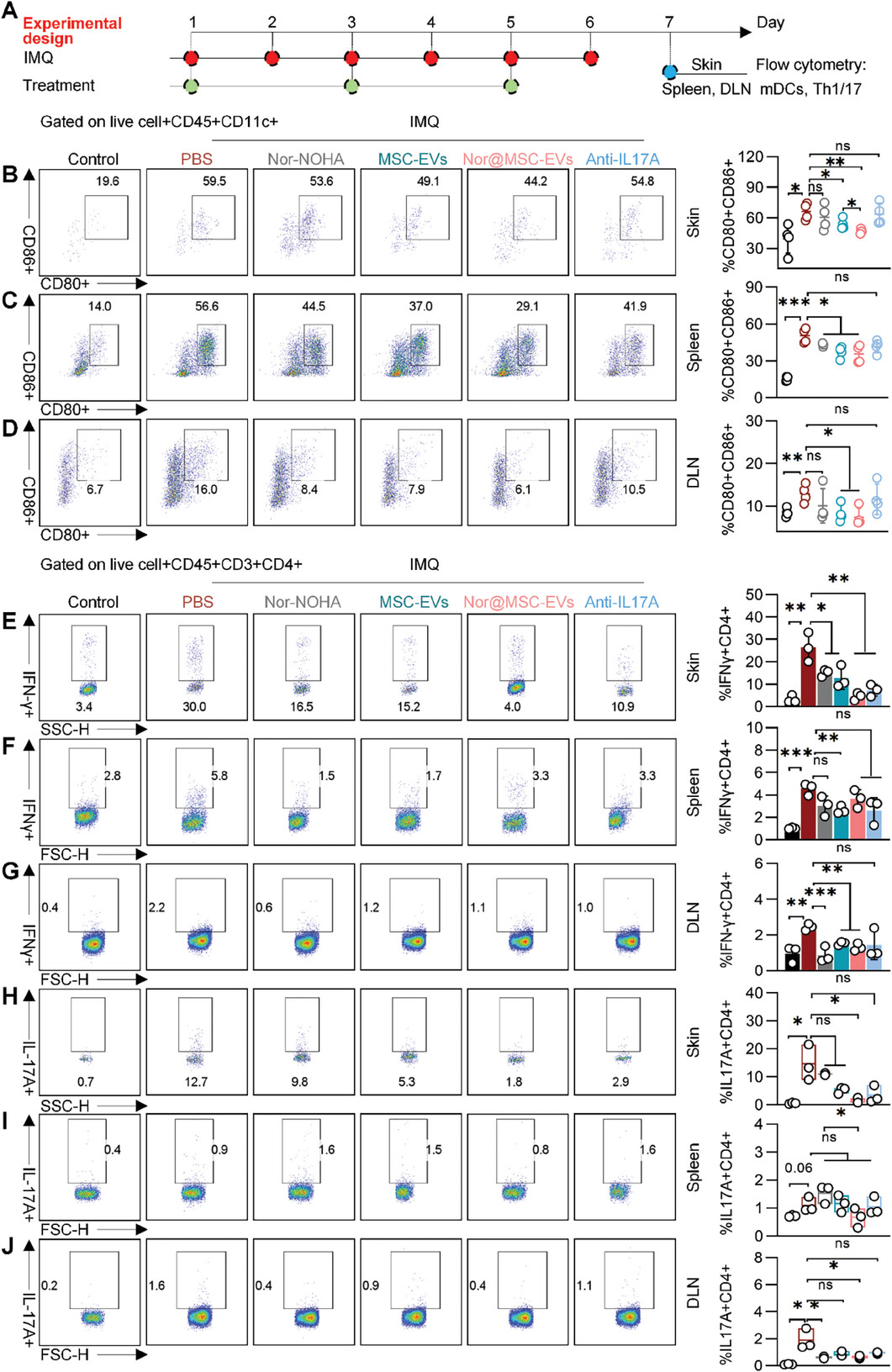
图8A:展示了评估PBS、nor-NOHA、MSC-EVs、nor@MSC-EVs和抗IL17A对IMQ诱导的银屑病小鼠局部(皮肤)和全身(脾脏和引流淋巴结,dLN)免疫调节作用的实验设计。
图8B:流式细胞术分析显示,与PBS组相比,MSC-EVs和nor@MSC-EVs组皮肤病变中CD80+CD86+的CD11c+细胞比例显著降低。
图8C-D:流式细胞术分析表明,与PBS组相比,MSC-EVs和nor@MSC-EVs组脾脏和dLN中CD80+CD86+的CD11c+细胞百分比降低。
图8E-G:流式细胞术分析显示,与PBS组相比,nor@MSC-EVs组皮肤病变、脾脏和dLN中IFN-γ+CD4+细胞的百分比显著降低。
图8H-J:流式细胞术分析表明,与PBS组相比,nor@MSC-EVs组皮肤病变、脾脏和dLN中IL-17A+CD4+细胞的百分比显著降低。
这些结果表明,nor@MSC-EVs有效调节了银屑病小鼠模型的局部和全身免疫紊乱,抑制了DCs的成熟和Th1/17细胞的分化。
结论
本研究发现Arg1在银屑病中特异性过表达,其介导的多胺生成可激活DCs/Th17轴,加重免疫紊乱。工程化的nor@MSC-EVs通过抑制Arg1/polyamine代谢,清除自身抗原,抑制NF-κB信号通路,有效调节局部和全身代谢及免疫紊乱,在体内外均展现出优于MSC-EVs和临床药物抗IL17A的治疗效果,为银屑病治疗提供了新的策略和潜在的临床应用方向。但研究存在局限性,如仅使用一种动物模型,需进一步评估nor@MSC-EVs在人体的生物安全性和长期稳定性等,未来还需更多研究和临床试验验证其疗效和转化可能性。






