研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
15+的出圈发文选题!“外泌体”顶刊思路,真正实现发文自由!
557 人阅读发布时间:2025-03-21 14:06
癌症免疫疗法成效有限,给癌症患者的治疗带来了挑战。然而,若能更深入地了解肿瘤微环境中导致T细胞功能障碍的因素,并制定有效策略来对抗肿瘤诱导的免疫抑制,有望取得重大进展。

湾湾今天分享的是发表在【SciTransl Med】(IF:15.8)上题为“Tumor extracellular vesicle-derived PD-L1 promotes T cell senescence through lipid metabolism reprogramming”的研究,该研究称肿瘤来源的细胞外囊泡(tEVs)可诱导T细胞衰老及抑制。程序性死亡配体1(PD-L1)作为tEVs中的关键成分,在人和小鼠的T细胞中引发DNA损伤和脂质代谢亢进。这导致脂质代谢酶的表达升高,胆固醇和脂滴形成增加,进而致使细胞衰老。在分子层面,tEVs来源的PD-L1激活了环磷腺苷效应元件结合蛋白(CREB)以及信号转导与转录激活因子(STAT)信号通路,促进了人和小鼠T细胞的脂质代谢并加速衰老。在细胞过继转移和黑色素瘤小鼠模型中,抑制肿瘤中细胞外囊泡(EVs)的合成,或阻断效应T细胞中的CREB信号通路、胆固醇合成以及脂滴形成,可在体外和体内避免tEVs介导的T细胞衰老。同样的处理方式在人和小鼠黑色素瘤模型中,还增强了过继转移T细胞疗法和抗PD-L1免疫检查点疗法的抗肿瘤功效。这些研究明确了肿瘤介导的免疫抑制与潜在免疫疗法耐药性之间的机制联系,并为癌症免疫疗法提供了新策略。
研究结果
1.肿瘤来源的细胞外囊泡(tEVs)诱导T细胞衰老
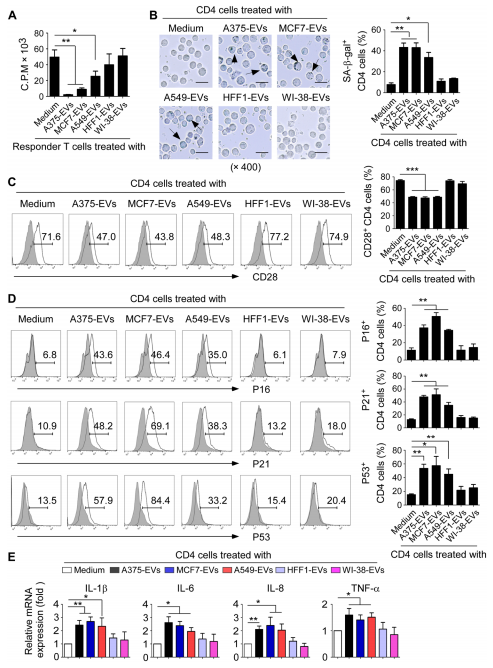
图1A:使用[³H]-胸苷测定法,将来自健康人类供体的抗CD3激活的T细胞,与从A375、MCF7和A549细胞系或正常成纤维细胞HFF1和WI-38细胞系纯化的EVs共培养48小时后的增殖情况。结果显示,肿瘤细胞系来源的tEVs显著抑制T细胞增殖,而正常成纤维细胞来源的EVs对T细胞增殖无抑制作用。
图1B:左图为抗CD3激活的来自健康供体的CD4⁺T细胞与所示肿瘤细胞系或正常成纤维细胞纯化的EVs共培养3天后的SA-β-gal染色图像;右图是对SA-β−gal+T细胞的定量分析。结果表明,肿瘤细胞系来源的tEVs促进了T细胞的衰老,正常成纤维细胞来源的EVs则无此效果。
图1C-D:左图为抗CD3激活的CD4⁺T细胞与所示EVs共培养3天后,CD28、P16、P21和P53表达的流式细胞术分析图;右图是对阳性T细胞的定量分析,结果显示,肿瘤细胞系来源的tEVs下调了CD28的表达,同时增加了P16、P21和P53的表达,而正常成纤维细胞来源的EVs对这些分子的表达影响较小。
图1E:激活的CD4⁺T细胞与不同类型的所示EVs共培养48小时后,炎症细胞因子mRNA表达的实时定量PCR检测结果。结果表明,肿瘤细胞系来源的tEVs增加了促炎细胞因子IL-1β、IL-6、IL-8和TNF-α的基因表达。
2.tEVs中的PD-L1是诱导T细胞衰老的原因
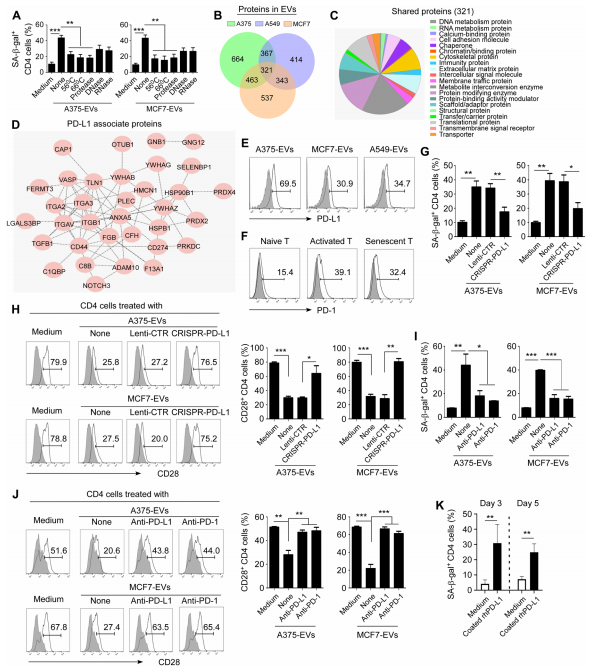
图2A:在A375-EVs处理和MCF7-EVs处理条件下,不同处理的抗CD3激活的CD4+T细胞中SA-β-gal染色的定量结果。结果显示,用蛋白酶或加热处理tEVs后,其诱导T细胞衰老的能力显著降低,而用DNase或RNase处理对tEVs诱导的T细胞衰老影响较小。
图2B:通过质谱分析对从肿瘤细胞系A375、MCF7和A549纯化的tEVs中的蛋白质组分进行蛋白质组学分析。结果显示,三种tEVs中共有321种共享蛋白,这些是tEVs的核心蛋白成分。
图2C:使用PANTHER分类系统对三个不同tEVs中共享的321种蛋白的信号通路和功能进行分析,并以饼图展示。这些蛋白参与代谢、细胞黏附和免疫等多种重要信号通路。
图2D:使用STRING数据库分析共享的321种tEVs来源蛋白中与PD-L1相关的分子及其相互作用。
图2E:通过流式细胞术分析tEVs与醛/硫酸乳胶珠孵育后PD-L1的表达情况。结果表明,A375、MCF7和A549肿瘤细胞来源的tEVs中均存在PD-L1。
图2F:该图展示了抗CD3激活的CD4⁺T细胞在有无tEVs处理72小时后PD-1的表达情况,未处理的幼稚CD4⁺T细胞作为对照。结果显示,PD-1在衰老和活化的T细胞中均有表达。
图2G:与从转染了CRISPR-Cas9PD-L1−1−sgRNA(CRISPR-PD-L1)或对照质粒pLentiV2(Lenti-CTR)的肿瘤细胞系A375和MCF7纯化的tEVs共培养3天的SA-β−gal+T细胞的定量分析。结果显示,来自PD-L1敲除肿瘤细胞系的tEVs诱导的衰老T细胞群体明显少于对照载体转染的肿瘤细胞系来源的tEVs。
图2H:对与从转染了CRISPR-PD-L1或对照质粒Lenti-CTR的肿瘤细胞系A375和MCF7纯化的tEVs共培养3天的T细胞进行CD28表达的流式细胞术分析,右图是对阳性T细胞的定量分析。结果显示,来自PD-L1敲除肿瘤细胞系的tEVs对共培养T细胞的CD28表达影响较小。
图2I:与经或未经抗人PD-L1中和抗体预处理的tEVs共培养3天的SA-β−gal+T细胞的定量分析,经或未经抗人PD-1中和抗体预处理的CD4⁺T细胞与tEVs共培养3天的情况。结果显示,阻断tEVs中的PD-L1或预处理T细胞的PD-1抗体可防止tEVs诱导的T细胞衰老。
图2J:对与经或未经抗人PD-L1中和抗体预处理的tEVs共培养3天的T细胞进行CD28表达的流式细胞术分析,抗PD-1组指经或未经抗人PD-1中和抗体预处理的CD4⁺T细胞。右图是对阳性T细胞的定量分析。结果表明,阻断tEVs中的PD-L1可防止tEVs诱导的T细胞CD28表达丧失。
图2K:该图展示了在预先包被重组人PD-L1和山羊抗人免疫球蛋白GFc抗体的24孔板中培养3或5天的抗CD3激活的CD4⁺T细胞中SA-β−gal+T细胞的定量分析。结果显示,板结合的重组人PD-L1足以诱导CD4⁺T细胞衰老。
3.DNA损伤反应和CREB信号通路调控tEVs诱导的T细胞衰老
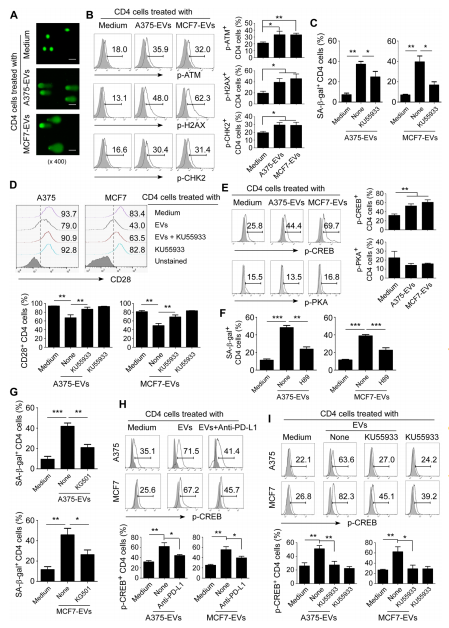
图3A:使用碱性彗星试验检测抗CD3激活的T细胞在经或不经指定tEVs共培养72小时后的DNA链断裂情况。结果显示,与A375和MCF7细胞来源的tEVs共培养的T细胞出现更长的尾巴,表明发生了DNA损伤。
图3B:通过流式细胞术分析与A375和MCF7肿瘤细胞来源的tEVs共培养5天的CD4⁺T细胞中ATM、H2AX和CHK2的磷酸化激活情况,右图是对阳性T细胞的定量分析。结果显示,tEVs处理促进了ATM、H2AX和CHK2的磷酸化。
图3C:抗CD3激活的T细胞在经或未经KU55933预处理过夜,然后与tEVs共培养3天后SA-β−gal+T细胞的定量分析。结果显示,阻断ATM信号可减少tEVs诱导的SA-β−gal+T细胞群体。
图3D:抗CD3激活的T细胞在经或未经KU55933预处理过夜,与所示tEVs共培养3天后CD28表达的流式细胞术分析及定量结果展示。结果表明,阻断ATM信号可防止tEVs处理的T细胞中CD28表达的丧失。
图3E:通过流式细胞术分析与A375和MCF7肿瘤细胞来源的tEVs共培养3天的CD4⁺T细胞中CREB和PKA的磷酸化激活情况及定量结果展示。结果显示,tEVs处理增加了CREB的磷酸化,但PKA的磷酸化变化不大。
图3F-G:抗CD3激活的T细胞在经或未经PKA抑制剂H89(和CREB抑制剂KG501)处理,然后与tEVs共培养3天后的SA-β-gal染色情况。结果显示,抑制PKA或CREB信号可阻止tEVs介导的T细胞衰老。
图3H-I:经或未经抗人PD-L1中和抗体(和KU55933预处理的CD4⁺T细胞)预处理的A375和MCF7肿瘤细胞来源的tEVs与T细胞共培养3天后,处理的T细胞中p-CREB的表达情况及阳性T细胞的定量分析。结果显示,阻断PD-L1活性或ATM相关的DNA损伤反应可减少tEVs诱导的CREB磷酸化。
4.tEVs在其诱导衰老的T细胞中促进过度的脂质代谢
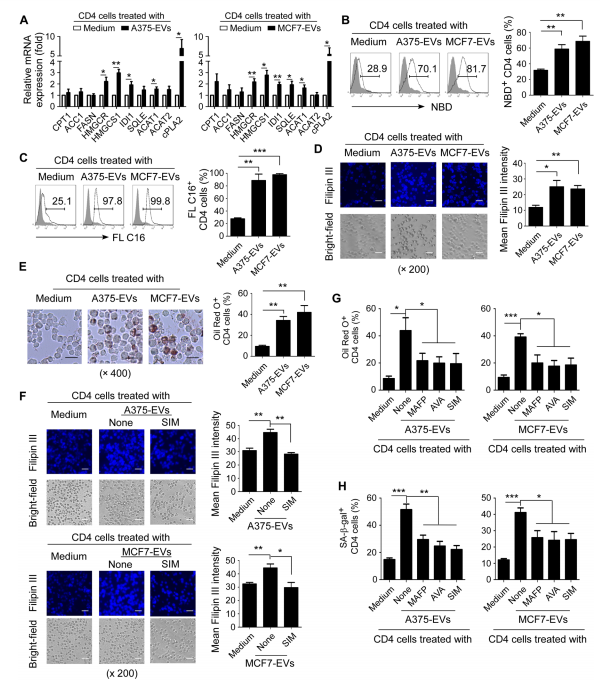
图4A:通过RT-PCR评估抗CD3激活的CD4⁺T细胞与tEVs共培养后脂质代谢相关酶的基因表达情况。结果显示,tEVs处理显著增加了与胆固醇代谢(HMGCR、HMGCS1、IDI1、SQLE)、胆固醇酯形成(ACAT)和磷脂代谢(cPLA2α)相关关键酶的基因表达,而对脂肪酸代谢相关关键酶的表达影响较小。
图4B-C:、抗CD3激活的CD4⁺T细胞与tEVs共培养3天后,通过流式细胞术检测的NBD和BODIPYFLC16的摄取量。结果显示,tEVs处理增强了CD4⁺T细胞对胆固醇和脂肪酸的摄取。
图4D:抗CD3激活的CD4⁺T细胞与tEVs共培养3天,用filipinIII染色(蓝色)后的荧光/明场显微镜图像,及使用ImageJ对filipinIII荧光强度的定量分析。结果显示,tEVs处理导致CD4⁺T细胞中胆固醇含量增加。
图4E:左图为抗CD3激活的CD4⁺T细胞与tEVs共培养3天的油红O染色结果及定量分析。结果表明,tEVs处理增加了衰老CD4⁺T细胞中脂质滴(LDs)的积累。
图4F:用胆固醇抑制剂SIM预处理过夜,然后与A375肿瘤和MCF7肿瘤来源的tEVs共培养3天的T细胞的filipinIII染色和定量分析。结果显示,SIM处理减少了tEVs处理的T细胞中胆固醇的积累。
图4G-H:抗CD3激活的CD4⁺T细胞用脂质代谢抑制剂MAFP、AVA或SIM预处理过夜,然后与tEVs共培养3天的油红O染色和SA-β-gal染色结果。结果显示,这些抑制剂处理可减少tEVs处理的T细胞中LDs的形成,并阻止tEVs诱导的T细胞衰老。
5.CREB信号通路与STAT信号通路协同调节肿瘤来源细胞外囊泡(tEVs)诱导的T细胞脂质代谢和衰老
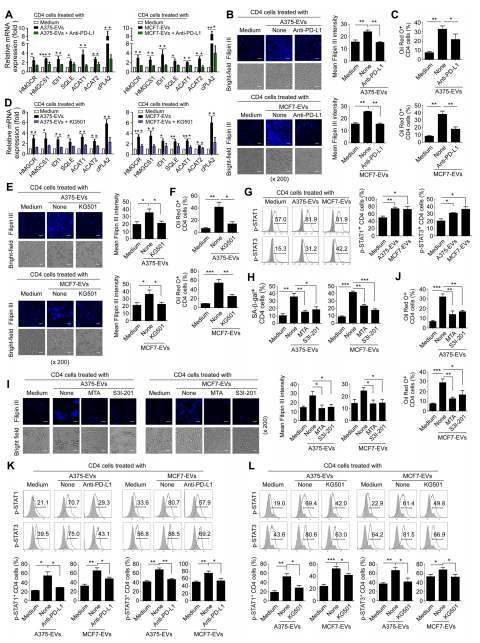
图5A:抗CD3激活的CD4⁺T细胞与经抗人PD-L1抗体预处理的tEVs共培养48小时后,脂质代谢相关酶mRNA表达的RT-PCR分析结果。数据显示,阻断tEVs中的PD-L1显著降低了tEVs诱导的胆固醇和磷脂代谢相关关键酶的基因表达增加。
图5B:抗CD3激活的CD4⁺T细胞与经抗PD-L1预处理的tEVs共培养72小时后的filipinIII染色情况及荧光强度定量分析,结果表明阻断PD-L1减少了tEVs诱导的CD4⁺T细胞中胆固醇积累。
图5C:抗CD3激活的CD4⁺T细胞与经抗PD-L1预处理的tEVs共培养72小时后的油红O染色分析结果,数据显示阻断PD-L1可减少tEVs诱导的CD4⁺T细胞中脂质滴(LDs)积累。
图5D:抗CD3激活的CD4⁺T细胞经CREB抑制剂KG501预处理过夜,再与tEVs共培养48小时后,脂质代谢相关酶mRNA表达的RT-PCR分析图。数据表明抑制CREB信号可抑制tEVs介导的胆固醇和磷脂代谢相关关键酶的基因表达增加。
图5E:经KG501预处理过夜的抗CD3激活的CD4⁺T细胞与tEVs共培养72小时后的filipinIII染色图。定量数据显示抑制CREB信号减少了tEVs诱导的CD4⁺T细胞中胆固醇积累。
图5F:经KG501预处理过夜的抗CD3激活的CD4⁺T细胞与tEVs共培养72小时后的油红O染色分析结果,数据表明抑制CREB信号减少了tEVs诱导的CD4⁺T细胞中LDs形成。
图5G:抗CD3激活的CD4⁺T细胞与tEVs共培养48小时后,p-STAT1和p-STAT3表达的流式细胞术分析图,定量数据显示tEVs处理增加了CD4⁺T细胞中STAT1和STAT3的磷酸化激活。
图5H:抗CD3激活的CD4⁺T细胞经STAT1抑制剂MTA或STAT3抑制剂S3I-201预处理过夜,再与tEVs共培养72小时后的SA-β-gal染色结果,数据表明抑制STAT1或STAT3信号可阻止tEVs介导的T细胞衰老。
图5I:经STAT1抑制剂MTA或STAT3抑制剂S3I-201预处理过夜的抗CD3激活的CD4⁺T细胞与tEVs共培养72小时后的filipinIII染色图,定量数据显示抑制STAT1或STAT3信号减少了tEVs处理的T细胞中胆固醇积累。
图5J:经STAT1抑制剂MTA或STAT3抑制剂S3I-201预处理过夜的抗CD3激活的CD4⁺T细胞与tEVs共培养72小时后的油红O染色结果,数据表明抑制STAT1或STAT3信号减少了tEVs处理的T细胞中LDs形成。
图5K:抗CD3激活的CD4⁺T细胞与经抗人PD-L1抗体预处理的tEVs共培养48小时后,STAT1/STAT3磷酸化的流式细胞术分析图,定量数据显示阻断tEVs中的PD-L1减少了tEVs诱导的STAT1和STAT3信号的激活和磷酸化。
图5L:经CREB抑制剂KG501预处理过夜的抗CD3激活的CD4⁺T细胞与tEVs共培养48小时后,STAT1/STAT3磷酸化的流式细胞术分析图,定量数据显示抑制CREB信号可防止tEVs介导的STAT1和STAT3在T细胞中的激活。
6.tEVs在体内促进T细胞衰老并伴有脂质积累
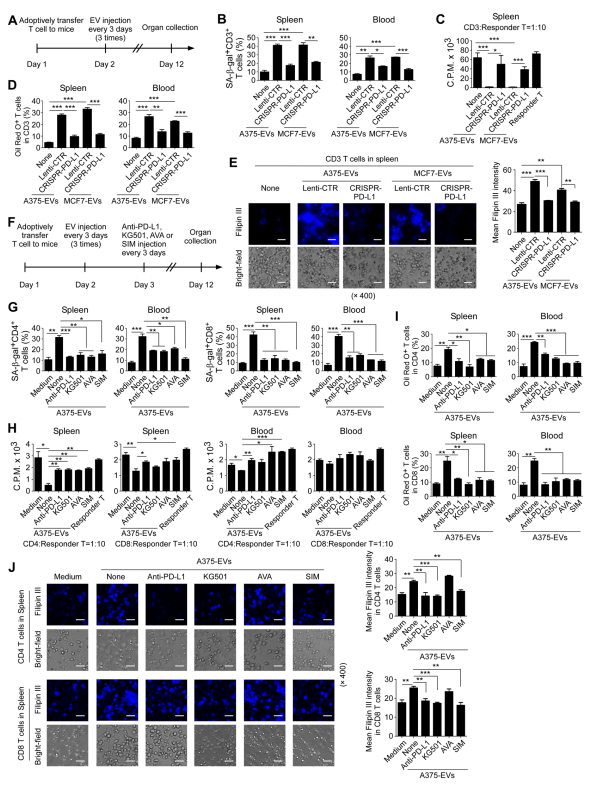
图6A:过继转移T细胞模型示意图,将tEVs注射到Rag2−/−小鼠体内。预先激活的人CD3+T细胞,通过静脉注射过继转移到Rag2−/−小鼠体内。从A375和MCF7细胞系纯化得到tEVs,分为有或无PD-L1缺失的情况,再通过静脉注射到小鼠体内。
图6B:在第12天从注射tEVs的小鼠血液和脾脏中分离出的转移CD3⁺T细胞的SA-β-gal染色结果。数据显示,注射来自对照载体转染肿瘤细胞的tEVs增加了衰老T细胞群体,而注射来自PD-L1敲除肿瘤细胞系的tEVs则减少了衰老T细胞群体。
图6C:在第12天从注射tEVs的小鼠血液和脾脏中分离出的转移CD3+T细胞的抑制活性,通过[³H]-胸苷测定法检测。结果表明,来自对照载体转染肿瘤细胞tEVs处理的T细胞对其他应答T细胞增殖的抑制活性较强,而来自PD-L1敲除肿瘤细胞系tEVs处理的T细胞抑制活性较弱。
图6D:对第12天从注射tEVs的小鼠血液和脾脏中分离出的转移CD3⁺T细胞的油红O染色分析结果,数据显示来自对照载体转染肿瘤细胞tEVs处理的T细胞中脂质滴积累较多。
图6E:在第12天从注射tEVs的小鼠脾脏中分离出的转移CD3⁺T细胞的filipinIII染色图,右图定量数据表明来自对照载体转染肿瘤细胞tEVs处理的T细胞中胆固醇含量较高。
图6F:在Rag2小鼠体内阻断T细胞中PD-L1、CREB信号或脂质代谢以防止tEVs介导的T细胞衰老的示意图。激活的CD3⁺细胞经预处理后注射到小鼠体内,之后注射经处理的tEVs和相关抑制剂。
图6G:在第12天从注射tEVs且经不同处理的小鼠血液和脾脏中分离出的转移CD4⁺和CD8⁺T细胞的SA-β-gal染色结果。数据表明,注射tEVs显著诱导了T细胞衰老,而给予抗PD-L1、KG-501、AVA或SIM可减少衰老T细胞群体。
图6H:在第12天从注射tEVs且经不同处理的小鼠血液和脾脏中分离出的转移CD4⁺和CD8⁺T细胞,使用[3H]-胸腺嘧啶核苷掺入试验检测的抑制活性。结果显示,tEVs使效应T细胞转化为抑制性T细胞,而给予抗PD-L1、KG-501、AVA或SIM可逆转T细胞的抑制活性。
在图6I:第12天从注射tEVs且经不同处理的小鼠血液和脾脏中分离出的转移CD4⁺和CD8⁺T细胞的油红O染色分析结果,数据表明给予抗PD-L1、KG-501、AVA或SIM可减少tEVs介导的T细胞中LDs形成。
图6J:第12天从注射tEVs且经不同处理的小鼠脾脏中分离出的转移CD4⁺和CD8⁺T细胞的filipinIII染色图,右图定量数据显示给予抗PD-L1、KG-501或SIM可减少tEVs介导的T细胞中胆固醇含量,而AVA对胆固醇含量影响不大。
7.阻断肿瘤细胞产生EVs可防止效应T细胞衰老,并增强肿瘤特异性T细胞介导的抗肿瘤功效
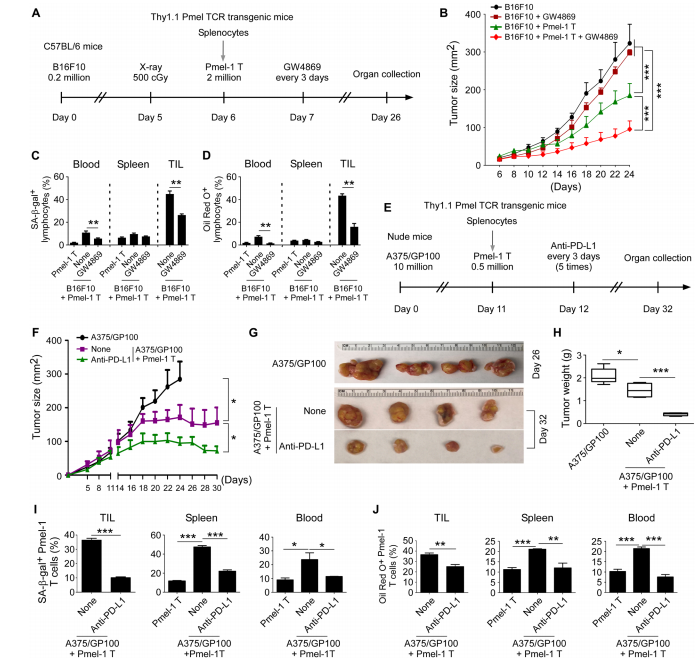
图7A:实验示意图,将小鼠B16F10肿瘤细胞皮下注射到C57BL/6小鼠体内,在肿瘤接种后第6天,将激活的Pmel-1T细胞经静脉注射到荷瘤小鼠体内,之后每隔3天给小鼠注射GW4869,共注射4次。
图7B:肿瘤体积变化,数据以每组4只小鼠的平均值±标准差表示。结果显示,单独使用GW4869对辐照的荷瘤小鼠肿瘤生长影响不大,但GW4869与过继T细胞转移疗法联合使用可增强抗肿瘤免疫力,抑制肿瘤生长。
图7C-D:在肿瘤注射后第26天,从荷瘤小鼠血液、脾脏和肿瘤中分离出转移的Pmel-1T细胞,分别进行SA-β-gal染色和油红O染色。数据显示,GW4869给药可防止肿瘤特异性T细胞衰老和脂质积累。
图7E:实验示意图,将人A375/GP100肿瘤细胞皮下注射到裸鼠体内,在肿瘤接种后第11天,将激活的Pmel-1T细胞经静脉注射到荷瘤小鼠体内,之后每隔3天给小鼠注射抗人PD-L1抗体,共注射5次。
图7F:肿瘤体积变化,数据以每组4或5只小鼠的平均值±标准差表示。结果表明,过继转移Pmel-1T细胞可抑制肿瘤生长,抗PD-L1抗体治疗显著促进了gp100特异性CD8⁺T细胞对肿瘤生长的抑制作用。
图7G:不同组荷瘤小鼠的代表性肿瘤大小。
图7H:实验终点时不同组小鼠的肿瘤重量。结果显示,抗PD-L1抗体与T细胞转移疗法联合治疗组的肿瘤重量明显低于其他两组。
图7I-J:在肿瘤注射后第32天,从荷瘤小鼠血液、脾脏和肿瘤中分离出转移的Pmel-1T细胞,分别进行SA-β-gal染色和油红O染色。数据显示,抗PD-L1治疗显著防止了T细胞衰老和LDs形成。
8.通过抑制CREB信号传导和脂质代谢逆转效应T细胞衰老,可增强肿瘤特异性T细胞和抗PD-L1检查点免疫疗法介导的抗肿瘤功效
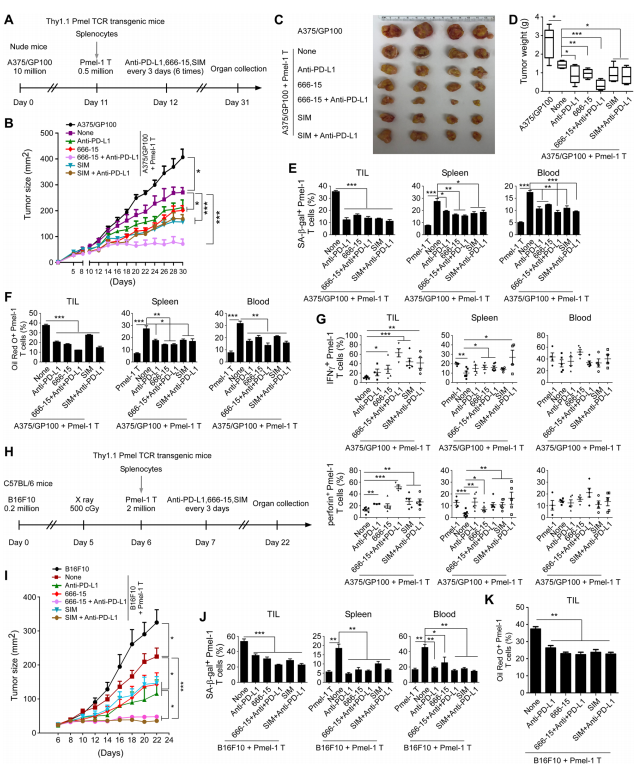
图8A:实验示意图,将人A375/GP100肿瘤细胞皮下注射到裸鼠体内,激活的Pmel-1T细胞经预处理后,在肿瘤接种后第11天经静脉注射到荷瘤小鼠体内,之后每隔3天给小鼠注射抗人PD-L1抗体、666-15或SIM,共注射6次。
图8B:肿瘤体积变化。结果显示,给予CREB信号抑制剂666-15或胆固醇合成抑制剂SIM可增强Pmel-1T细胞对肿瘤生长的抑制作用,抗PD-L1治疗效果相似,且抗PD-L1、666-15与T细胞疗法联合治疗对肿瘤生长的抑制作用最强。
图8C:不同组荷瘤小鼠的代表性肿瘤大小。
图8D:实验终点时不同组小鼠的肿瘤重量。结果表明,联合治疗组的肿瘤大小和重量均小于T细胞疗法单独治疗组和肿瘤单独治疗组,且抗PD-L1与666-15联合治疗的效果优于其他组合。
图8E:在第31天从荷瘤小鼠血液、脾脏和肿瘤中分离出的转移Pmel-1T细胞的SA-β-gal染色分析结果,数据显示666-15或SIM单独或与抗PD-L1联合治疗可防止T细胞衰老。
图8F:在第31天从荷瘤小鼠血液、脾脏和肿瘤中分离出的转移Pmel-1T细胞的油红O染色分析结果,数据表明666-15或SIM单独或与抗PD-L1联合治疗可减少LDs形成。
图8G:在第31天从荷瘤小鼠血液、脾脏和肿瘤中分离出的转移Pmel-1T细胞中IFN-γ和穿孔素产生的流式细胞术分析结果,数据显示抗PD-L1、666-15或SIM单独治疗可增加IFN-γ+和穿孔素细胞群体,联合治疗可促进更多IFN-γ和穿孔素分泌,但在荷瘤小鼠血液中未发现显著变化。
图8H:实验示意图,将小鼠B16F10肿瘤细胞皮下注射到C57BL/6小鼠体内,在肿瘤接种后第6天,将激活的Pmel-1T细胞经静脉注射到荷瘤小鼠体内,之后在不同时间给小鼠注射抗小鼠PD-L1抗体、666-15或SIM。
图8I:示肿瘤体积变化。结果显示,给予抗PD-L1抗体、CREB信号抑制剂666-15或胆固醇合成抑制剂SIM可增强Pmel-1T细胞对B16黑色素瘤。
结论
该研究指出癌症免疫疗法虽有前景,但整体效率受限,肿瘤诱导的免疫抑制是关键障碍。研究发现tEVs可诱导T细胞衰老与功能失调,PD-L1是其关键分子,且PD-L1/PD-1信号传导主要促进T细胞衰老而非耗竭。tEVs能介导T细胞脂质代谢重编程,过度脂质代谢与T细胞衰老及功能失调存在因果关系。此外,抑制CREB信号通路、胆固醇合成等可阻断肿瘤特异性T细胞衰老,增强抗肿瘤免疫,这些调节T细胞衰老和代谢的策略与免疫检查点阻断疗法结合或能提升癌症免疫治疗效果。不过,研究存在局限性,如PD-L1/PD-1信号传导调控机制不明,研究多在体外和小鼠模型中进行,未探索信号抑制对肿瘤生长的体内影响等。本研究为癌症免疫疗法提供了新机制与策略。






