研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
脊髓修复“未解之谜”破防!外泌体携miR-5121“潜入”血管细胞,竟靠自噬“复活”屏障?
275 人阅读发布时间:2025-04-23 11:45
脊髓损伤(SCI)是一种严重的神经系统疾病,会导致运动、感觉和自主神经功能障碍,严重影响患者的生活质量。SCI后,血脊髓屏障(BSCB)被破坏,引发缺血缺氧,进一步加剧脊髓微环境失衡。A2型星形胶质细胞在缺血缺氧条件下产生,已有研究表明其能促进SCI修复,但A2型星形胶质细胞来源的外泌体(A2-Exos)在SCI中的作用尚未明确。

今天分享的是发表在【J Nanobiotechnology】(IF:10.6)上题为“Exosome-shuttled miR-5121 from A2 astrocytes promotes BSCB repair after traumatic SCI by activating autophagy in vascular endothelial cells”的研究,该研究旨在探讨A2-Exos在SCI修复(尤其是BSCB修复)中的作用,并阐明其潜在机制。
研究结果
1、SCI后BSCB损伤及A2星形胶质细胞增多
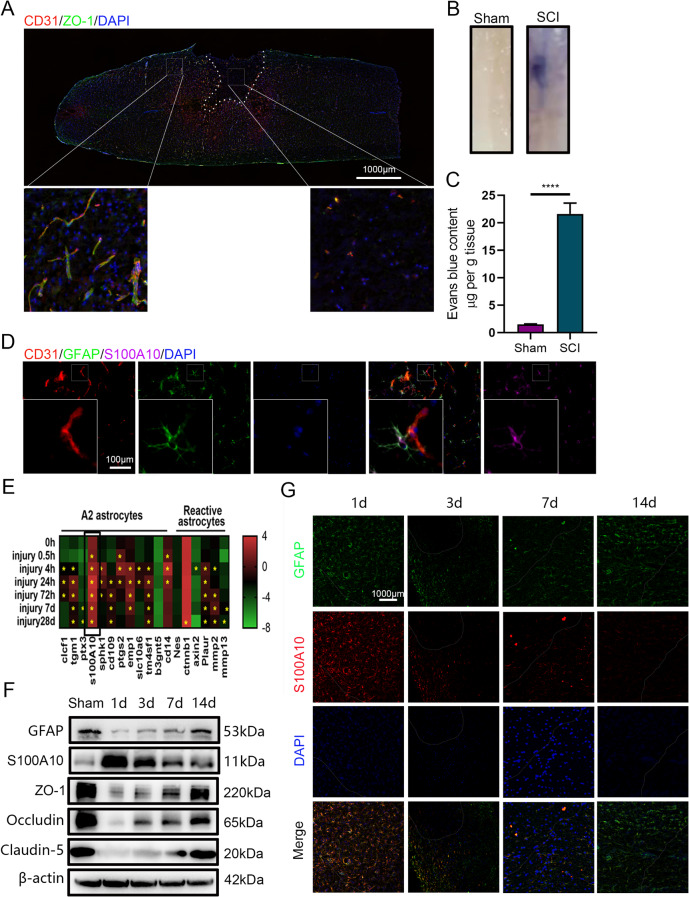
图1A:免疫荧光共染色显示,SCI小鼠损伤部位血管标记物CD31和紧密连接蛋白ZO-1的表达水平显著低于未损伤区域。
图1B-C:EB染料注射实验显示,SCI组损伤部位出现明显的EB渗漏,而假手术组未见渗漏,证实SCI后BSCB破坏。
图1D:免疫荧光染色显示,SCI后损伤部位血管周围星形胶质细胞中A2型星形胶质细胞特异性标记物S100A10高表达。
图1E-F:GEO数据库分析和Westernblot结果显示,SCI后S100A10表达显著增加,在第1天达到峰值并持续至第28天;同时,紧密连接蛋白表达在SCI后急剧下降,至第14天修复完成。
图1G:免疫荧光染色显示,SCI后第1、3、7、14天,S100A10表达随时间推移逐渐增加。
这些结果表明,SCI导致BSCB损伤,同时诱导A2型星形胶质细胞增殖,提示A2型星形胶质细胞可能参与BSCB修复。
2、A2-Exos在体内促进运动功能恢复和BSCB重建
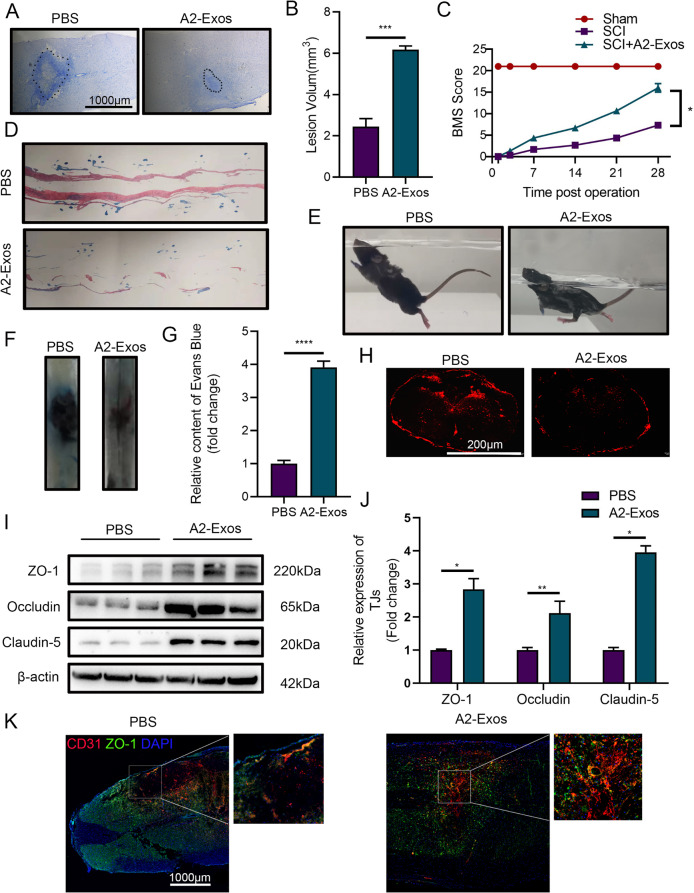
图2A-B:尼氏染色显示,A2-Exos处理组在SCI后28天的损伤面积显著小于PBS对照组。
图2C:BMS评分显示,A2-Exos组小鼠的神经功能评分在SCI后各时间点均高于PBS组。
图2D-E:足迹分析和游泳实验显示,A2-Exos组小鼠的下肢运动功能在SCI后28天出现部分恢复,而PBS组未恢复。
图2F-H:EB染料渗漏实验显示,A2-Exos处理组在SCI后7天的EB渗漏量显著减少,荧光显微镜下可见损伤部位染料分布减少。
图2I-K:Westernblot和免疫荧光染色显示,A2-Exos处理组的紧密连接蛋白(ZO-1、Occludin、Claudin-5)表达显著增加。
这些结果表明,A2-Exos在体内可促进SCI小鼠的运动功能恢复和BSCB完整性修复。
3、A2-Exos在体外重建BSCB
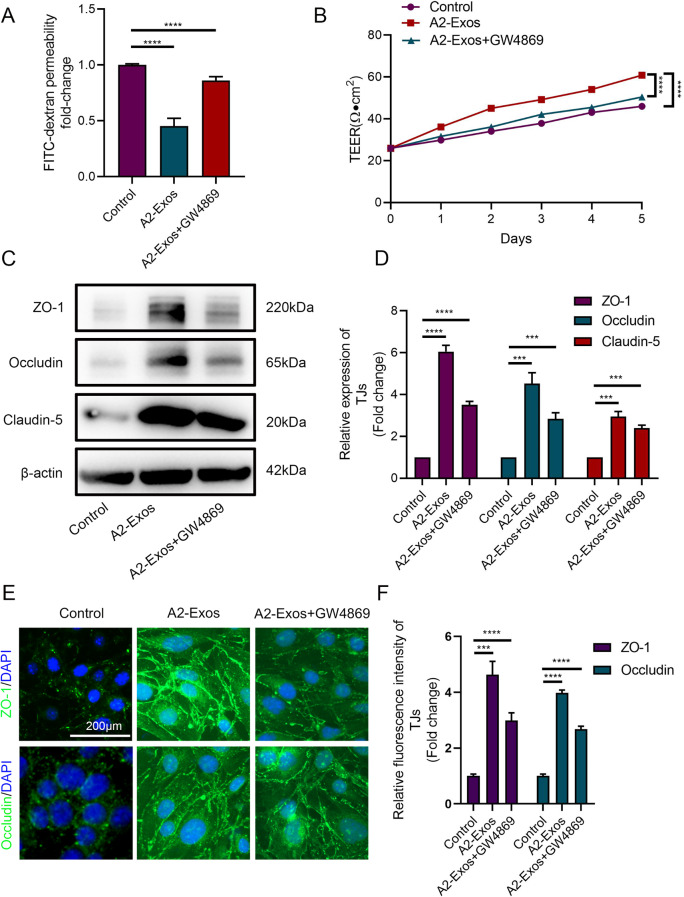
图3A-B:Transwell实验和TEER测量显示,A2-Exos处理显著降低bEnd.3内皮细胞的FITC-葡聚糖通透性,并提高TEER值,模拟SCI微环境下的BSCB稳定性增强。
图3C-F:Westernblot和免疫荧光染色显示,A2-Exos处理组的紧密连接蛋白表达显著增加,而外泌体抑制剂GW4869可部分逆转这些效应。
这些结果表明,A2-Exos在体外可通过增强紧密连接蛋白表达和降低内皮细胞通透性来促进BSCB修复。
4、miR-5121在体内促进BSCB恢复
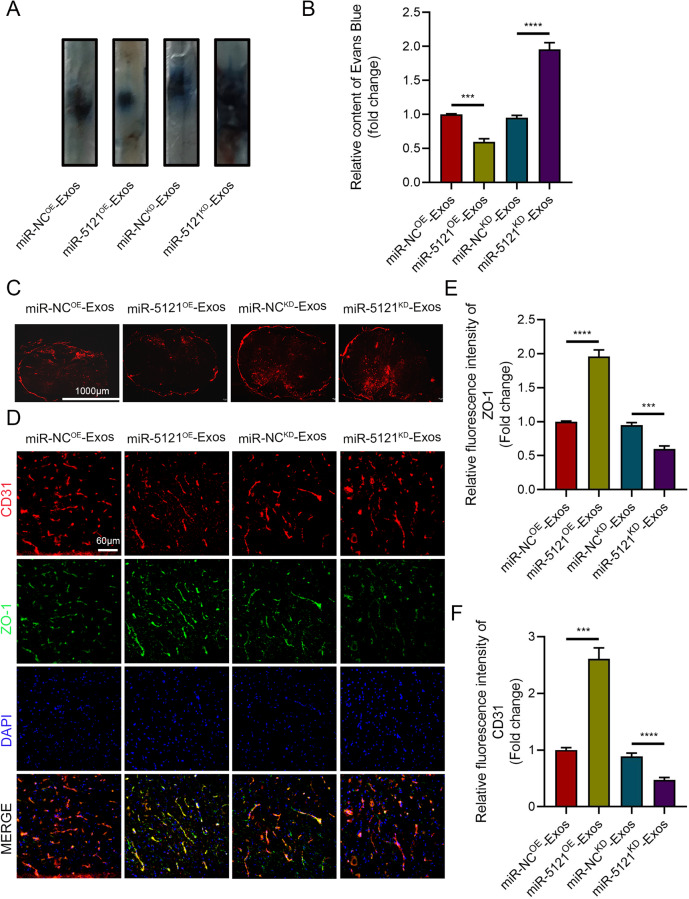
图4A-B:EB染料渗漏实验显示,miR-5121过表达(miR-5121OE)的A2-Exos处理组在SCI后7天的EB渗漏量显著低于阴性对照组,而miR-5121敲低(miR-5121KD)组的渗漏量增加。
图4C:荧光显微镜下,miR-5121OE组的EB染料分布减少,miR-5121KD组分布增多。
图4D-F:免疫荧光染色显示,miR-5121OE组的CD31和ZO-1共表达增加,提示BSCB形成增强;miR-5121KD组则相反。
这些结果表明,A2-Exos中的miR-5121在体内可显著促进BSCB修复。
5、miR-5121在体外促进BSCB恢复
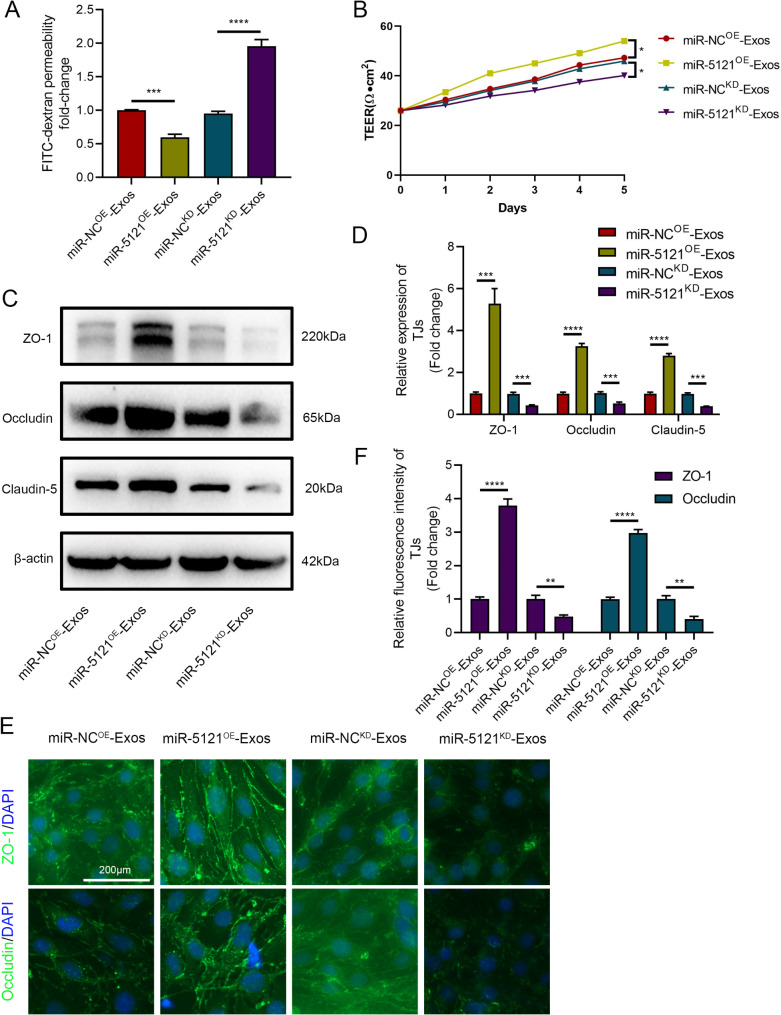
图5A-B:TEER测量和FITC-葡聚糖通透性实验显示,miR-5121OE的A2-Exos处理组内皮细胞的TEER值升高、通透性降低,而miR-5121KD组则相反。
图5C-F:Westernblot和免疫荧光染色显示,miR-5121OE组的紧密连接蛋白表达显著增加,miR-5121KD组表达减少。
这些结果表明,miR-5121在体外通过增强紧密连接蛋白表达和内皮细胞屏障功能促进BSCB修复。
6、miR-5121通过抑制AKT2促进BSCB修复
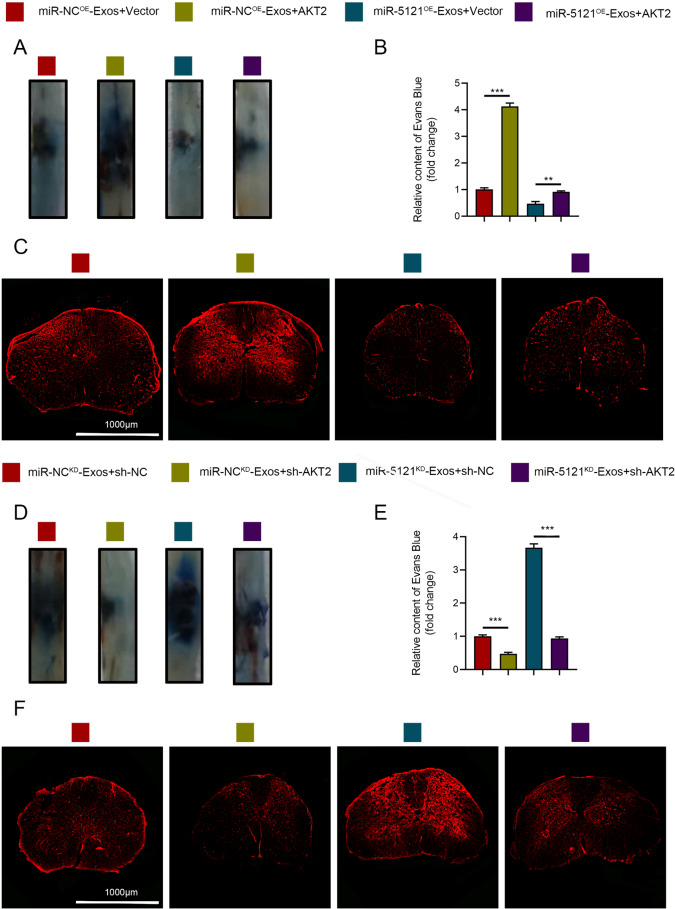
图6A-C:体内实验显示,AKT2过表达可增加EB渗漏量,削弱miR-5121OE的保护作用;AKT2敲低则减少渗漏量,逆转miR-5121KD的损伤效应。
图6D:在miR-5121敲低背景下(miR-5121KD-Exos),AKT2敲低(miR-5121KD-Exos+sh-AKT2)可显著减少EB渗漏面积,逆转miR-5121KD导致的BSCB修复缺陷。
图6E:EB渗漏定量显示,miR-5121KD-Exos+sh-AKT2组的渗漏量显著低于miR-5121KD-Exos+sh-NC组(**P<0.0001)。
图6F:荧光显微镜下,miR-5121KD-Exos+sh-AKT2组的染料分布较miR-5121KD-Exos+sh-NC组明显减少,提示AKT2敲低可挽救miR-5121缺失导致的BSCB破坏。
这些结果表明,AKT2过表达会削弱 BSCB 修复,而AKT2敲低则可增强修复能力,且在miR-5121缺失条件下,敲低AKT2仍能部分恢复BSCB完整性。这进一步验证了miR-5121通过抑制 AKT2 介导 BSCB 修复的体内机制。
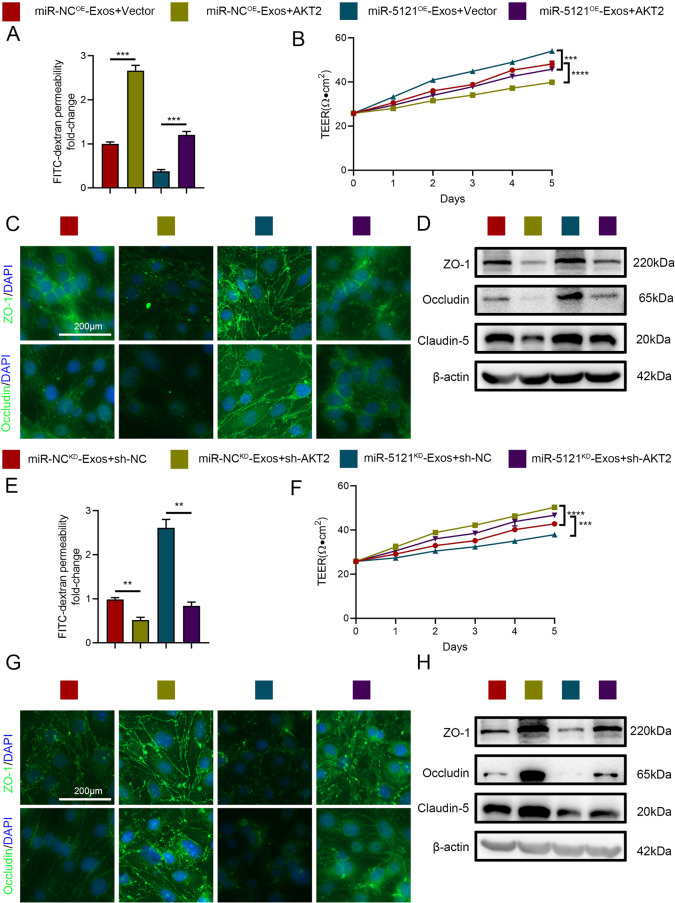
图7A-H:体外实验显示,AKT2过表达增加内皮细胞通透性、降低TEER值和紧密连接蛋白表达;AKT2敲低则产生相反效果,且能逆转miR-5121KD的负面作用。
这些结果表明,miR-5121通过靶向抑制AKT2发挥促进BSCB修复的作用。
7、A2-Exos和miR-5121促进内皮细胞自噬
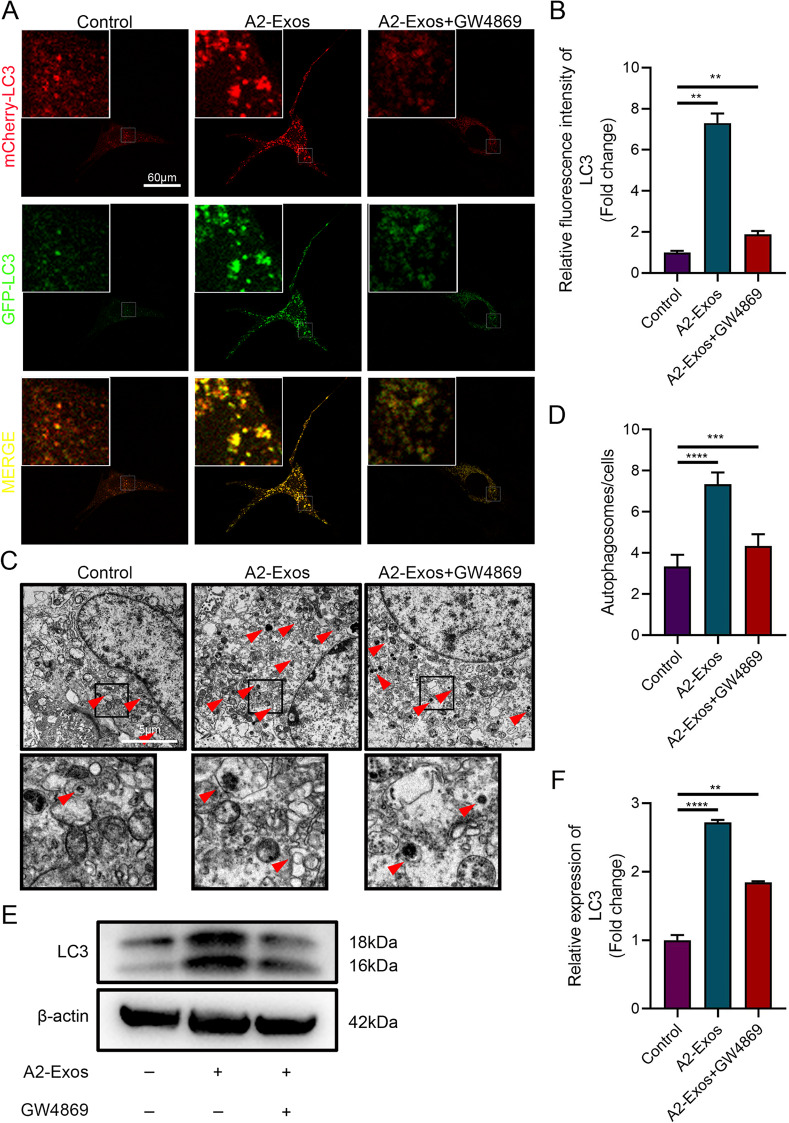
图8A:mCherry-GFP-LC3荧光染色显示,与对照组(Control)相比,A2-Exos处理组的bEnd.3内皮细胞中自噬体(LC3阳性puncta)数量显著增多;而预先用外泌体抑制剂GW4869处理后,A2-Exos诱导的自噬体数量明显减少。
图8B:LC3荧光强度定量分析表明,A2-Exos组的LC3表达水平显著高于对照组,GW4869预处理则部分逆转了这一效应。
图8C:透射电镜(TEM)观察显示,A2-Exos处理组内皮细胞内可见大量双层膜结构的自噬体,而对照组自噬体数量较少;GW4869预处理后,自噬体数量显著减少。
图8D:自噬体数量定量统计显示,A2-Exos组的自噬体数量显著多于对照组,GW4869组则显著低于A2-Exos组。
图8E-F:Westernblot分析显示,A2-Exos组的自噬标记蛋白LC3-II/LC3-I比值显著高于对照组,GW4869预处理则降低了LC3-II/LC3-I比值,表明A2-Exos可激活内皮细胞自噬。
这些结果表明,A2-Exos通过诱导内皮细胞自噬体形成和上调LC3表达,显著增强bEnd.3细胞的自噬活性,且这一效应依赖于外泌体的递送功能。
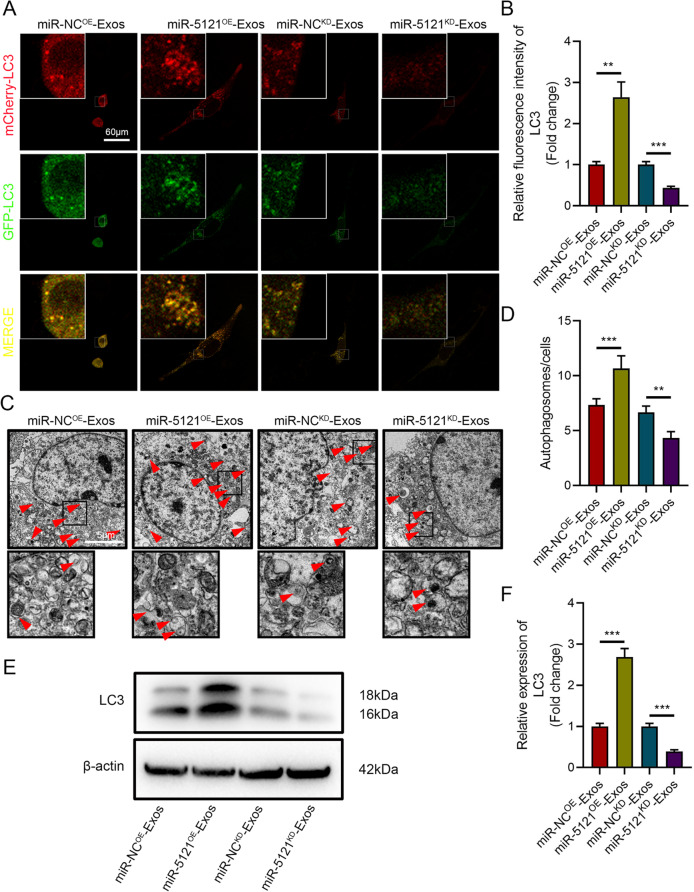
图9A:mCherry-GFP-LC3荧光染色显示,与阴性对照外泌体(miR-NCOE-Exos)相比,miR-5121过表达外泌体(miR-5121OE-Exos)处理的bEnd.3细胞中,自噬体(LC3阳性点状结构)数量显著增多;而miR-5121敲低外泌体(miR-5121KD-Exos)处理组的自噬体数量明显减少。
图9B:LC3荧光强度定量分析表明,miR-5121OE-Exos组的LC3表达水平显著高于miR-NCOE-Exos组,miR-5121KD-Exos组则显著低于miR-NCKD-Exos组。
图9C:透射电镜(TEM)观察显示,miR-5121OE-Exos组内皮细胞内可见大量双层膜结构的自噬体,而miR-5121KD-Exos组的自噬体数量明显减少。
图9D:自噬体数量定量统计显示,miR-5121OE-Exos组的自噬体数量显著多于miR-NCOE-Exos组,miR-5121KD-Exos组则显著低于miR-NCKD-Exos组。
图9E:Westernblot分析显示,miR-5121OE-Exos组的自噬标记蛋白LC3-II/LC3-I比值显著高于miR-NCOE-Exos组,miR-5121KD-Exos组的LC3-II/LC3-I比值则低于miR-NCKD-Exos组。
这些结果表明,miR-5121通过诱导内皮细胞自噬体形成和增强LC3蛋白表达,显著激活bEnd.3细胞的自噬通路,从而促进BSCB修复。miR-5121的促自噬作用是其介导A2-Exos修复BSCB的关键机制之一。
8、miR-5121通过AKT2/mTOR/p70S6K通路调控自噬
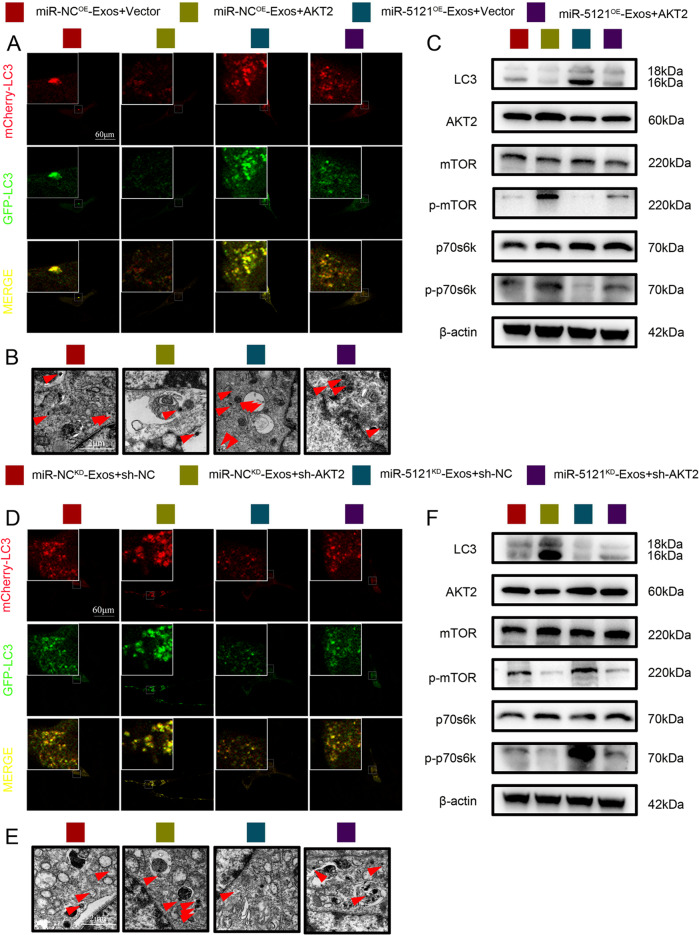
图10A-F:Westernblot显示,AKT2过表达抑制自噬相关蛋白LC3表达,并激活mTOR/p70S6K通路;AKT2敲低则增强LC3表达,抑制mTOR/p70S6K通路,且miR-5121的效应可被AKT2过表达逆转。
这些结果表明,miR-5121通过抑制AKT2激活自噬,其机制与调控AKT2/mTOR/p70S6K信号通路相关。
结论
本研究首次发现A2-Exos通过递送miR-5121促进BSCB修复,其机制为miR-5121靶向抑制AKT2,激活内皮细胞自噬,并调控AKT2/mTOR/p70S6K信号通路。A2-Exos具有易获取、丰度高的特点,为SCI的治疗提供了新的潜在策略。






